BỘ ĐỀ THI+HƯỚNG DẪN CHẤM CHÍNH THỨC CÁC SỞ GIÁO DỤC KÌ THI CHỌN HỌC SINH GIỎI CẤP TỈNH LỚP 9 THCS NĂM HỌC 2011-2012 MÔN HÓA HỌC
LINK DOCS.GOOGLE: https://drive.google.com/file/d/0B_NNtKpVZTUYSGNvaGlNdVl0LXM/view?usp=sharing
LINK DOCS.GOOGLE:
https://drive.google.com/file/d/0B_NNtKpVZTUYSGNvaGlNdVl0LXM/view?usp=sharing
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
www.twitter.com/daykemquynhon<br />
www.google.com/+DạyKèmQuyNhơn<br />
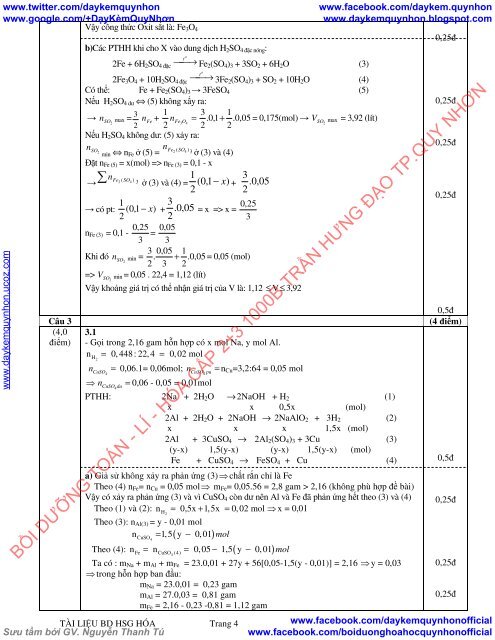
Vậy công thức Oxit sắt là: Fe 3 O 4<br />
www.daykemquynhon.ucoz.com<br />
Câu 3<br />
(4,0<br />
điểm)<br />
b)Các PTHH khi cho X vào dung dịch H 2 SO 4 đặc nóng :<br />
t<br />
2Fe + 6H 2 SO 4 đặc<br />
⎯⎯→<br />
o<br />
Fe 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O (3)<br />
t<br />
2Fe 3 O 4 + 10H 2 SO 4 đặc<br />
⎯⎯→<br />
o<br />
3Fe 2 (SO 4 ) 3 + SO 2 + 10H 2 O (4)<br />
Có thể: Fe + Fe 2 (SO 4 ) 3 → 3FeSO 4 (5)<br />
Nếu H 2 SO 4 dư ⇔ (5) không xẩy ra:<br />
→ nSO<br />
max =<br />
3 1 3 1<br />
n<br />
2<br />
Fe<br />
+ nFe<br />
=<br />
2<br />
3O<br />
.0,1 + .0, 05 = 0,175(mol) → V<br />
4<br />
SO<br />
2 2 2<br />
2<br />
max = 3,92 (lít)<br />
Nếu H 2 SO 4 không dư: (5) xảy ra:<br />
n SO2<br />
n Fe 2 SO<br />
min ⇔ n Fe ở (5) = ( 4 ) 3 ở (3) và (4)<br />
Đặt n Fe (5) = x(mol) => n Fe (3) = 0,1 - x<br />
→∑n Fe<br />
1 3<br />
2 ( SO4 ) 3 ở (3) và (4) = (0,1 − x)<br />
+ .0, 05<br />
2 2<br />
1 3<br />
→ có pt: (0,1 − x)<br />
+ .0, 05<br />
0,25<br />
= x => x =<br />
2 2<br />
3<br />
0,25 0,05<br />
n Fe (3) = 0,1 - =<br />
3 3<br />
3 0,05 1<br />
Khi đó nSO 2<br />
min = . + .0, 05 = 0,05 (mol)<br />
2 3 2<br />
=> VSO 2 min = 0,05 . 22,4 = 1,12 (lít)<br />
Vậy khoảng giá trị có thể nhận giá trị của V là: 1,12 ≤ V≤ 3,92<br />
3.1<br />
- Gọi trong 2,16 gam hỗn hợp có x mol Na, y mol Al.<br />
n = 0, 448: 22,4 = 0,02 mol<br />
n<br />
H 2<br />
CuSO 4<br />
⇒ n<br />
= 0,06.1= 0,06mol; n<br />
CuSO4du<br />
CuSO4<br />
pu<br />
= 0,06 - 0,05 = 0,01mol<br />
TÀI LIỆU BD HSG <strong>HÓA</strong> Trang 4<br />
Sưu tầm bởi GV. Nguyễn Thanh Tú<br />
= n Cu =3,2:64 = 0,05 mol<br />
PTHH: 2Na + 2H 2 O →2NaOH + H 2 (1)<br />
x x 0,5x (mol)<br />
2Al + 2H 2 O + 2NaOH → 2NaAlO 2 + 3H 2 (2)<br />
x x x 1,5x (mol)<br />
2Al + 3CuSO 4 → 2Al 2 (SO 4 ) 3 + 3Cu (3)<br />
(y-x) 1,5(y-x) (y-x) 1,5(y-x) (mol)<br />
Fe + CuSO 4 → FeSO 4 + Cu (4)<br />
a) Giả sử không xảy ra phản ứng (3) ⇒ chất rắn chỉ là Fe<br />
Theo (4) n Fe = n Cu = 0,05 mol⇒ m Fe = 0,05.56 = 2,8 gam > 2,16 (không phù hợp đề bài)<br />
Vậy có xảy ra phản ứng (3) và vì CuSO 4 còn dư nên Al và Fe đã phản ứng hết theo (3) và (4)<br />
Theo (1) và (2): n = 0,5x + 1,5x = 0,02 mol ⇒ x = 0,01<br />
H 2<br />
Theo (3): n Al(3) = y - 0,01 mol<br />
n = 1,5 y − 0,01 mol<br />
CuSO 4<br />
( )<br />
Theo (4): = = − ( − )<br />
n n 0,05 1,5 y 0,01 mol<br />
Fe CuSO 4 (4)<br />
Ta có : m Na + m Al + m Fe = 23.0,01 + 27y + 56[0,05-1,5(y - 0,01)] = 2,16 ⇒ y = 0,03<br />
⇒ trong hỗn hợp ban đầu:<br />
m Na = 23.0,01 = 0,23 gam<br />
m Al = 27.0,03 = 0,81 gam<br />
m Fe = 2,16 - 0,23 -0,81 = 1,12 gam<br />
www.facebook.com/daykem.quynhon<br />
www.daykemquynhon.blogspot.com<br />
0,25đ<br />
0,25đ<br />
0,25đ<br />
0,25đ<br />
0,5đ<br />
(4 điểm)<br />
BỒI DƯỠNG TOÁN - LÍ - <strong>HÓA</strong> <strong>CẤP</strong> 2+3 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
0,5đ<br />
0,25đ<br />
0,25đ<br />
0,25đ<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial