campo eléctrico y propiedades eléctricas de la materia - Novella
campo eléctrico y propiedades eléctricas de la materia - Novella
campo eléctrico y propiedades eléctricas de la materia - Novella
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
“libro_ffi” — 2008/8/5 — 9:06 — page 8 — #24<br />
8 FUNDAMENTOS FÍSICOS DE LA INGENIERÍA<br />
aportaciones <strong>de</strong> este mo<strong>de</strong>lo fueron fundamentalmente dos, siendo <strong>la</strong> primera <strong>de</strong> el<strong>la</strong>s <strong>la</strong><br />
existencia <strong>de</strong> órbitas en <strong>la</strong>s que el electrón no emitía energía electromagnética. Por otro <strong>la</strong>do,<br />
postu<strong>la</strong>ba que los niveles energéticos permitidos para un electrón estaban cuantizados en<br />
múltiplos enteros <strong>de</strong> <strong>la</strong> constante <strong>de</strong> P<strong>la</strong>nck, por lo que un electrón, al cambiar <strong>de</strong> órbita,<br />
emitía o absorbía cantida<strong>de</strong>s fijas <strong>de</strong> energía. Esto supuso <strong>la</strong> segunda aportación <strong>de</strong>l mo<strong>de</strong>lo<br />
Bohr, pues así se justificaban los espectros discretos <strong>de</strong> radiación y absorción que se producen<br />
en los gases como consecuencia <strong>de</strong> saltos <strong>de</strong> sus electrones entre distintas órbitas.<br />
Con su mo<strong>de</strong>lo, Bohr caracterizó los niveles cuánticos <strong>de</strong>l átomo <strong>de</strong> hidrógeno, encontrándose<br />
una correcta correspon<strong>de</strong>ncia con los espectros <strong>de</strong> radiación observados en el <strong>la</strong>boratorio<br />
para ese gas. Sin embargo, al intentar tras<strong>la</strong>dar el mo<strong>de</strong>lo a otros elementos, se encontró con<br />
que los espectros mostraban niveles <strong>de</strong> energía distintos en electrones que pertenecían a los<br />
mismos niveles energéticos conocidos. La solución a este problema <strong>la</strong> aportaron Arnold Sommerfeld<br />
y Wolfgang Pauli, entre 1920 y 1925, concluyendo que <strong>de</strong>ntro <strong>de</strong> un mismo nivel<br />
podían existir dos o más subniveles.<br />
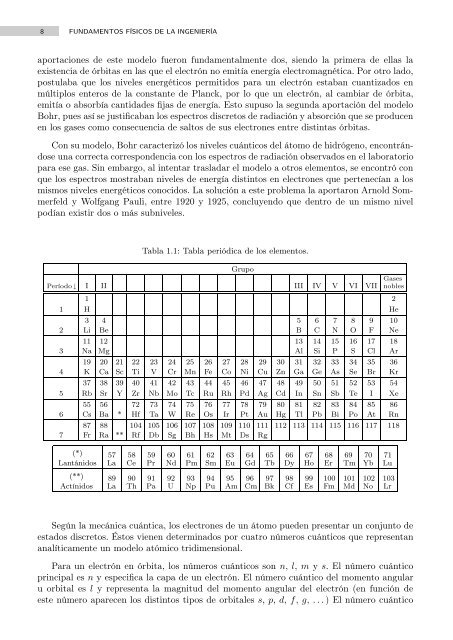
Tab<strong>la</strong> 1.1: Tab<strong>la</strong> periódica <strong>de</strong> los elementos.<br />
Grupo<br />
Período ↓ I II III IV V VI VII<br />
Gases<br />
nobles<br />
1 2<br />
1 H He<br />
3 4 5 6 7 8 9 10<br />
2 Li Be B C N O F Ne<br />
11 12 13 14 15 16 17 18<br />
3 Na Mg Al Si P S Cl Ar<br />
19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36<br />
4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr<br />
37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54<br />
5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe<br />
55 56 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86<br />
6 Cs Ba * Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn<br />
87 88 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118<br />
7 Fr Ra ** Rf Db Sg Bh Hs Mt Ds Rg<br />
(*)<br />
Lantánidos<br />
(**)<br />
Actínidos<br />
57<br />
La<br />
89<br />
La<br />
58<br />
Ce<br />
90<br />
Th<br />
59<br />
Pr<br />
91<br />
Pa<br />
60<br />
Nd<br />
92<br />
U<br />
61<br />
Pm<br />
93<br />
Np<br />
62<br />
Sm<br />
94<br />
Pu<br />
63<br />
Eu<br />
95<br />
Am<br />
Según <strong>la</strong> mecánica cuántica, los electrones <strong>de</strong> un átomo pue<strong>de</strong>n presentar un conjunto <strong>de</strong><br />
estados discretos. Éstos vienen <strong>de</strong>terminados por cuatro números cuánticos que representan<br />
analíticamente un mo<strong>de</strong>lo atómico tridimensional.<br />
Para un electrón en órbita, los números cuánticos son n, l, m y s. El número cuántico<br />
principal es n y especifica <strong>la</strong> capa <strong>de</strong> un electrón. El número cuántico <strong>de</strong>l momento angu<strong>la</strong>r<br />
u orbital es l y representa <strong>la</strong> magnitud <strong>de</strong>l momento angu<strong>la</strong>r <strong>de</strong>l electrón (en función <strong>de</strong><br />
este número aparecen los distintos tipos <strong>de</strong> orbitales s, p, d, f, g, . . . ) El número cuántico<br />
64<br />
Gd<br />
96<br />
Cm<br />
65<br />
Tb<br />
97<br />
Bk<br />
66<br />
Dy<br />
98<br />
Cf<br />
67<br />
Ho<br />
99<br />
Es<br />
68<br />
Er<br />
100<br />
Fm<br />
69<br />
Tm<br />
101<br />
Md<br />
70<br />
Yb<br />
102<br />
No<br />
71<br />
Lu<br />
103<br />
Lr