Cycle de Krebs.pdf - IBMC
Cycle de Krebs.pdf - IBMC
Cycle de Krebs.pdf - IBMC
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
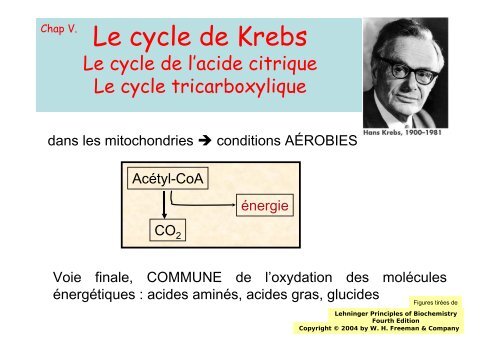
Chap V.<br />
Le cycle <strong>de</strong> <strong>Krebs</strong><br />
Le cycle <strong>de</strong> l’aci<strong>de</strong> citrique<br />
Le cycle tricarboxylique<br />
dans les mitochondries conditions AÉROBIES<br />
Acétyl-CoA<br />
énergie<br />
CO 2<br />
Voie finale, COMMUNE <strong>de</strong> l’oxydation <strong>de</strong>s molécules<br />
énergétiques : aci<strong>de</strong>s aminés, aci<strong>de</strong>s gras, gluci<strong>de</strong>s<br />
Figures tirées <strong>de</strong><br />
Lehninger Principles of Biochemistry<br />
Fourth Edition<br />
Copyright © 2004 by W. H. Freeman & Company
Vue générale du cycle <strong>de</strong> l’aci<strong>de</strong> citrique<br />
C6<br />
C4<br />
C6<br />
C4<br />
C5<br />
C4<br />
C4<br />
C4
‣ 2 carbones entrent dans le cycle, 2 autres carbones en sortent<br />
sous forme <strong>de</strong> CO 2<br />
‣ 4 réactions d’oxydo réduction ont lieu<br />
- 6 électrons sont transférés sur 3 NAD +<br />
- 1 paire d’atomes d’hydrogène (2 électrons) sont transférés<br />
sur FAD<br />
‣ 1 liaison phosphate, riche en énergie est formée à chaque<br />
tour (1 GTP)<br />
Régénération <strong>de</strong> NAD + et <strong>de</strong> FAD conduit à la formation <strong>de</strong> 3<br />
ATP et <strong>de</strong> 2 ATP respectivement, dans la chaîne respiratoire<br />
3×3 + 1×2 + 1×1 = 12 ATP
Vue détaillée du cycle <strong>de</strong> l’aci<strong>de</strong> citrique
I. Les 9 étapes en détail<br />
1. Con<strong>de</strong>nsation <strong>de</strong> l’oxaloacétate et <strong>de</strong> l’acétyl coenzyme A<br />
C<br />
COO-<br />
O<br />
CH 2 + C CH 3<br />
COO - S-CoA<br />
Oxaloacétate<br />
Acétyl-CoA<br />
+ H 2 O<br />
Citrate synthétase<br />
CH 2<br />
C COO -<br />
HO<br />
C COO -<br />
CH 2<br />
COO -<br />
COO -<br />
Aci<strong>de</strong> citrique<br />
+ HS-CoA + H +<br />
Intermédiaire =<br />
Citryl-CoA<br />
HO<br />
CH 2<br />
O<br />
C<br />
S-CoA<br />
CH 2 COO -
2. + 3. Isomérisation du citrate<br />
-<br />
OOC<br />
COO -<br />
C H<br />
C OH<br />
CH 2<br />
COO - COO -<br />
C<br />
C<br />
CH 2<br />
COO -<br />
COO -<br />
C OH<br />
C H<br />
CH 2<br />
COO -<br />
H<br />
H 2 O H H 2 O<br />
H<br />
-<br />
OOC<br />
-<br />
OOC<br />
aconitase<br />
aconitase<br />
Citrate Cis-Aconitate Isocitrate
4. Oxydo-réduction I<br />
isocitrate + NAD + α-cétoglutarate + CO 2 + NADH + H +<br />
COO -<br />
CH 2<br />
NAD +<br />
COO -<br />
CH 2<br />
H + CO 2<br />
COO -<br />
CH 2<br />
H C COO -<br />
H C COO -<br />
CH 2<br />
H<br />
C<br />
COO -<br />
OH<br />
NADH + H +<br />
C<br />
O<br />
COO -<br />
C<br />
O<br />
COO -<br />
Isocitrate Oxalosuccinate α-cétoglutarate<br />
Isocitrate déshydrogénase
5. Décarboxylation oxydative<br />
α-cétoglutarate + NAD + + CoA<br />
succinyl-CoA + CO 2 + NADH<br />
COO -<br />
COO -<br />
CH 2<br />
+ NAD + + HS-CoA<br />
CH 2<br />
CH 2<br />
CH 2<br />
+ CO 2 +<br />
NADH + H +<br />
C<br />
O<br />
C<br />
O<br />
COO -<br />
S-CoA<br />
Enz = complexe α-cétoglutarate déshydrogénase<br />
Cofacteurs = NAD + , CoA, TPP, lipoami<strong>de</strong>, FAD
6. Formation d’une liaison riche en énergie<br />
‣ succinyl~CoA + Pi + GDP<br />
succinate + GTP + CoA<br />
Succinyl CoA synthétase<br />
‣Transfert sur ADP<br />
GTP + ADP GDP + ATP<br />
Nucléosi<strong>de</strong> diphosphate kinase<br />
7. Régénération <strong>de</strong> l’oxaloacétate<br />
COO -<br />
COO -<br />
COO - COO -<br />
CH 2<br />
CH<br />
+ FAD + FADH 2<br />
CH 2<br />
succinate HC<br />
déshydrogénase<br />
succinate<br />
fumarate
COO -<br />
8. COO -<br />
COO - stéréospécifique) COO -<br />
CH<br />
HO C H<br />
HC<br />
fumarase<br />
CH 2<br />
(trans addition<br />
fumarate<br />
L-malate<br />
9.<br />
COO -<br />
HO C<br />
CH 2<br />
H<br />
COO -<br />
L-malate<br />
COO -<br />
+ NAD + C O<br />
+ NADH + H +<br />
malate<br />
déshydrogénas<br />
CH 2<br />
e<br />
COO -<br />
oxaloacétate
II. Bilan du cycle <strong>de</strong> l’aci<strong>de</strong> citrique<br />
acétyl-CoA + oxaloacétate + H 2 O citrate + CoA + H +<br />
citrate<br />
cis-aconitate + H 2 O<br />
cis-aconitate + H 2 O<br />
isocitrate<br />
isocitrate + NAD +<br />
α-cétoglutarate + CO 2 + NADH<br />
α-cétoglutarate + NAD + + CoA<br />
succinyl-CoA + CO 2 + NADH<br />
succinyl-CoA + Pi + GDP<br />
succinate + GTP + CoA<br />
succinate + FAD (lié)<br />
fumarate + FADH 2 (lié)<br />
fumarate +H 2 O<br />
malate<br />
malate + NAD + oxaloacétate + NADH + H +<br />
Acétyl-CoA + 2 H 2 O + 3 NAD + + FAD + GDP + Pi<br />
2 CO 2 + 3 NADH + FADH 2 + GTP + 2 H + + CoA
Bilan énergétique du cycle <strong>de</strong> <strong>Krebs</strong><br />
isocitrate déshydrogénase<br />
1 NADH formé<br />
3 liaisons ~<br />
α-cétoglutarate déshydrogénase<br />
1 NADH formé<br />
3 liaisons ~<br />
succinyl CoA synthétase<br />
1 GTP formé<br />
1 liaison ~<br />
succinate déshydrogénase<br />
1 FADH 2 formé<br />
malate déshydrogénase<br />
1 NADH formé<br />
2 liaisons ~<br />
3 liaisons ~<br />
12 liaisons ~
III. Particularités et mécanismes<br />
‣ entrée du pyruvate dans la mitochondrie (cf. avant)<br />
‣ <strong>de</strong>venir <strong>de</strong>s atomes <strong>de</strong> C :<br />
oxaloacétate<br />
S-CoA<br />
citrate<br />
isocitrate<br />
succinate<br />
+ CO2<br />
succinyl-CoA<br />
CO 2<br />
α-cétoglutarate
‣ complexe <strong>de</strong> l’α-cétoglutarate déshydrogénase<br />
Très semblable au complexe pyruvate déshydrogénase<br />
Mêmes cofacteurs : TPP, lipoami<strong>de</strong>, CoA, FAD, NAD +<br />
3 enzymes :<br />
A’ : α-cétoglutarate déshydrogénase<br />
B’ : transsuccinylase<br />
C’ : dihydrolipoyl déshydrogénase<br />
A<br />
B<br />
C<br />
A’<br />
B’<br />
C’<br />
A<br />
B<br />
C’<br />
A’<br />
B’<br />
C<br />
Complexes fonctionnels
‣ La citrate synthétase<br />
oxaloacétate + acétyl-CoA<br />
citrate + CoA<br />
- enzyme = 2 monomères en interaction<br />
- (a) = enzyme sans substrat<br />
- (b) = enzyme avec substrats changement conformationnel,<br />
le site actif « se referme »<br />
- présence d’histidines dans le site actif qui stabilisent les<br />
différents intermédiaires
‣ L’aconitase<br />
• Aspect structural :<br />
COO -<br />
COO -<br />
COO -<br />
2<br />
2<br />
CH<br />
CH 2<br />
CH 2<br />
3<br />
COO -<br />
3<br />
C ou C COO -<br />
HO C COO -<br />
4<br />
4<br />
CH 2 CH<br />
CH 2<br />
5<br />
5<br />
COO - COO -<br />
COO -<br />
citrate<br />
HO<br />
1<br />
1<br />
A<br />
B<br />
COO -<br />
cis aconitate<br />
COO -<br />
2<br />
2<br />
C H ou CH 2<br />
3<br />
3<br />
HC COO -<br />
HC COO -<br />
4<br />
4<br />
CH 2<br />
H C OH<br />
5<br />
5<br />
COO - COO -<br />
isocitrate<br />
1<br />
1
‣ Comment l’enzyme peut elle être spécifique sur une<br />
molécule symétrique<br />
•<br />
•<br />
•<br />
Site OH<br />
Site COO - CH 2 COO -<br />
Site<br />
CH 2<br />
COO -<br />
Molécule symétrique reconnue <strong>de</strong> manière asymétrique
• Aspect fonctionnel :<br />
Aconitase inhibée par fluoroacétate<br />
COO -<br />
CH 2<br />
F<br />
fluoroacétate<br />
Site OH<br />
Fluor<br />
CoA-SH<br />
Dichapetelum cymosum<br />
F CH 2<br />
O<br />
C<br />
CH 2<br />
COO - Site<br />
Blocage<br />
COO -<br />
CH 2<br />
Fe 2+<br />
Site COO -<br />
HO<br />
F<br />
C<br />
C<br />
Aconitase<br />
oxaloacétate<br />
COO -<br />
S-CoA<br />
fuoroacétyl CoA<br />
COO -<br />
H<br />
fluorocitrate
IV. Régulation du cycle <strong>de</strong> <strong>Krebs</strong>
Régulation du cycle :<br />
‣ Complexe pyruvate déshydrogénase :<br />
• Acétyl-CoA inhibe la transacétylase<br />
• NADH inh. Dihydrolipoyl déshydrogénase<br />
• modification covalente : P <strong>de</strong> Ser<br />
ATP, NADH, Acétyl-CoA<br />
P si<br />
ADP NAD + CoA<br />
• déphosphorylation si pyruvate élevé<br />
élevés<br />
‣ Citrate synthétase :<br />
• inhibée allostériquement par ATP<br />
(ATP baisse l’affinité <strong>de</strong> l’enzyme par l’Acétyl-CoA)
‣ Isocitrate déshydrogénase :<br />
• stimulation allostérique par ADP<br />
(ADP augmente l’affinité pour les substrats)<br />
• NADH inhibe l’enzyme car déplace le NAD +<br />
‣ α-cétoglutarate déshydrogénase :<br />
• inhibition par succinyl-CoA et par NADH<br />
Résumé : si taux énergétique cellulaire élevé, vitesse du<br />
cycle et vitesse d’incorporation <strong>de</strong> C 2 réduites
V. Le cycle <strong>de</strong> l’aci<strong>de</strong> citrique : source <strong>de</strong> précurseurs
Remarques :<br />
• Dans situation alimentaire désespérée :<br />
voie néoglucogenèse : oxaloacétate gluci<strong>de</strong>s (glucose pour<br />
le cerveau)<br />
• Compensation par réactions anaplérotiques :<br />
Ex :<br />
pyruvate + CO 2 + ATP + H 2 O<br />
pyruvate carboxylase<br />
oxaloacétate + ADP + Pi + 2 H +
VI. <strong>Cycle</strong> <strong>de</strong> <strong>Krebs</strong> et Béribéri<br />
‣ paralysie / tremblement mains + pieds, parfois tout le corps<br />
‣ provoqué par carence en vitamine B1 = thiamine<br />
TPP = groupe prosthétique <strong>de</strong> 3 enzymes importants<br />
<strong>Cycle</strong> <strong>de</strong> <strong>Krebs</strong><br />
Voie <strong>de</strong>s<br />
pentoses<br />
• pyruvate déshydrogénase<br />
• α-cétoglutarate déshydrogénase<br />
• transcétolases<br />
Activités enzymatiques faibles<br />
Extrême Orient / riz, faible teneur en vit. B1
VII. Le cycle glyoxylique<br />
NADH + H +<br />
Oxaloacétate<br />
NAD + Malate<br />
déshydrogénase<br />
Acétyl-CoA<br />
CoASH<br />
Glucose<br />
Malate<br />
Fumarate<br />
CoASH<br />
Malate<br />
synthase<br />
Acétyl-CoA<br />
Glyoxylate<br />
Citrate<br />
Isocitrate<br />
Isocitrate lyase<br />
CO 2<br />
Succinate<br />
α-cétoglutarate<br />
Succinyl CoA<br />
CO 2<br />
Bilan : 2 Acétyl-CoA + NAD + + 2 H 2 O succinate + 2 CoA + NADH + H +<br />
Remarque : Acétate + CoA + ATP<br />
Acétyl-CoA + AMP + PPi