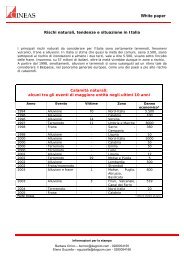
Flamma fumo est proxima (Dove c'è fumo c'è fiamma ... - Cineas
Flamma fumo est proxima (Dove c'è fumo c'è fiamma ... - Cineas
Flamma fumo est proxima (Dove c'è fumo c'è fiamma ... - Cineas
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
3. Calore di combustione/Potere calorifico<br />
Tutte le reazioni di combustione sono chiaramente esotermiche e quindi<br />
avvengono con rilascio di calore. E’ possibile ricavare per calcolo, nei casi<br />
semplici, o sperimentalmente qu<strong>est</strong>a quantità di calore (calore di combustione,<br />
ΔHc). Consideriamo qualche caso semplice:<br />
• C + O2 → CO2 ΔHc = -393,50 kJ/mol<br />
• H2 + 1/2O2 → H2O ΔHc = -240,96 “<br />
• CO + 1/2O2 → CO2 ΔHc = -283,00 “<br />
• CH4 + 2O2 → CO2 + 2H2O(g) ΔHc = -802, 3 “<br />
• CH4 + 2O2 → CO2 + 2H2O(l) ΔHc = -890,3 “<br />
Il ΔHc ha sempre il segno meno. In qu<strong>est</strong>i casi il ΔHc può essere facilmente calcolato<br />
conoscendo i calori di formazione dei reagenti e dei prodotti (ΔHf ) e applicando la legge<br />
di Hess:<br />
ΔHc = Σ ΔHf prodotti - Σ ΔHf reagenti<br />
Molti calori di formazione si trovano in apposite compilazioni oppure sul sito<br />
http://webbook.nist.gov/chemistry.<br />
Per gli esempi precedenti i rispettivi calori di formazione sono:<br />
• C, O2, H2 (i ΔHf degli elementi, per convenzione, sono uguali a 0)<br />
• CO2 = -393,5 kJ/mol<br />
• H2O g = -241,8 “<br />
• H2O l = -285,8 “<br />
• CH4 = -74,8 “<br />
Consideriamo l’ultima reazione, la combustione del metano con l’acqua allo stato<br />
liquido:<br />
CH4 + 2O2 → CO2 + 2H2O(l), per la legge di Hess avremo<br />
ΔHc = [(-393,5) + (-285,8 x2)] – [(-74,8) + (0)] = -965,1 + 74,8 = -890,3 kJ/mol<br />
Come si vede nel caso del metano (ma qu<strong>est</strong>o vale per tutti i combustibili che<br />
contengono idrogeno) si ottengono due valori del ΔHc secondo lo stato fisico<br />
dell’acqua che si forma tra i prodotti di combustione: liquida o allo stato di vapore<br />
(gas). La differenza è fornita dal calore di evaporazione dell’acqua (44 kJ/mol a<br />
25°C). Nelle fiamme, negli incendi, nella maggior parte delle combustioni<br />
industriali, l’acqua rimane come vapore e, di conseguenza, è più appropriato<br />
utilizzare il dato con l’acqua come vapore.<br />
Si definisce potere calorifico di un combustibile la quantità di calore generata nella<br />
combustione totale dall’unità di peso (kg per i solidi e i liquidi) o di volume m 3 (per i<br />
gas). Per i combustibili che contengono idrogeno o umidità, si distinguono due<br />
poteri calorifici:<br />
Potere calorifico superiore, quando l’acqua è considerata allo stato liquido;