Rapporto sulle biotecnologie del settore ... - Farmindustria
Rapporto sulle biotecnologie del settore ... - Farmindustria
Rapporto sulle biotecnologie del settore ... - Farmindustria
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
7.a L’iter regolatorio di un farmaco<br />
biotech in Italia: un’ulteriore sfida<br />
per l’innovazione<br />
IL CoNTESTo DI RIFERIMENTo<br />
Come noto, le <strong>biotecnologie</strong> costituiscono un fattore centrale<br />
<strong>del</strong> progresso nel <strong>settore</strong> farmaceutico, oggetto di legislazione<br />
comunitaria. Tale comparto, ed in particolar modo quello dei<br />
farmaci biotecnologici, è ad oggi in assoluto il <strong>settore</strong> industriale<br />
maggiormente normato. Tutto il processo che va dalla ricerca e<br />
sviluppo (R&S), alla produzione, alla commercializzazione di un<br />
nuovo farmaco è fortemente regolamentato. I farmaci, infatti,<br />
sin dalla loro ideazione e fino alla fase <strong>del</strong>lo smaltimento e <strong>del</strong>la<br />
distruzione, sono disciplinati in maniera puntuale da normative<br />
che hanno portata sia nazionale sia sovranazionale.<br />
<strong>Rapporto</strong> <strong>sulle</strong> <strong>biotecnologie</strong> <strong>del</strong> <strong>settore</strong> farmaceutico in Italia – 2013<br />
Approfondimenti<br />
07<br />
L’iter regolatorio da seguire per trasformare un’innovazione<br />
in un prodotto disponibile sul mercato risulta essere ampio e<br />
caratterizzato da un consistente impiego di risorse e tempo.<br />
Tali peculiarità determinano sicuramente un differente<br />
impatto <strong>sulle</strong> aziende a seconda <strong>del</strong>le loro dimensioni<br />
(piccole/grandi aziende farmaceutiche) fermo restando che<br />
queste si trovano peraltro già ad operare in un comparto<br />
nel quale i forti investimenti effettuati in ricerca e sviluppo<br />
hanno tempi lunghi per tradursi in ricavi: infatti per<br />
raggiungere il mercato il prodotto impiega fra gli 11<br />
ed i 14 anni (Figura 7.1).<br />
Appare infatti evidente che solo le grandi imprese farmaceutiche<br />
nel processo di ricerca, sviluppo e commercializzazione dei<br />
farmaci biotecnologici possono sfruttare il know-how presente<br />
in house, le competenze pregresse maturate nelle varie funzioni<br />
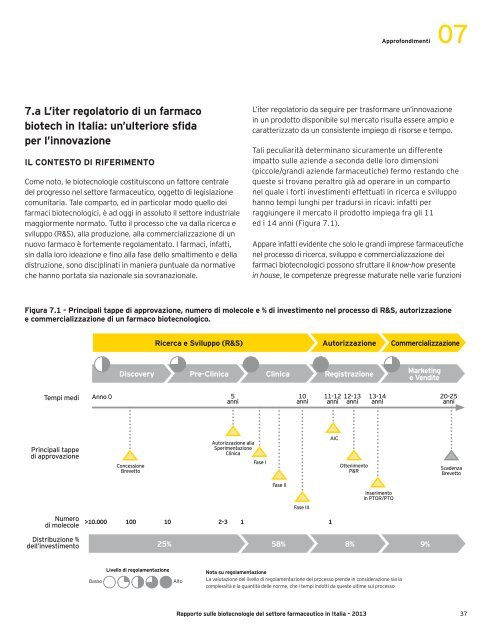
Figura 7.1 - Principali tappe di approvazione, numero di molecole e % di investimento nel processo di R&S, autorizzazione<br />
e commercializzazione di un farmaco biotecnologico.<br />
Tempi medi<br />
Principali tappe<br />
di approvazione<br />
Ricerca e Sviluppo (R&S) Autorizzazione Commercializzazione<br />
Discovery Pre-Clinica Clinica Registrazione<br />
Anno 0 5<br />
anni<br />
Concessione<br />
Brevetto<br />
Autorizzazione alla<br />
Sperimentazione<br />
Clinica<br />
Fase I<br />
Marketing<br />
e Vendite<br />
Fase II<br />
Inserimento<br />
in PTOR/PTO<br />
Fase III<br />
Numero<br />
>10.000 100 10 2-3 1 1<br />
di molecole<br />
Distribuzione %<br />
<strong>del</strong>l’investimento 25% 58% 8% 9%<br />
Livello di regolamentazione<br />
Basso Alto<br />
10<br />
anni<br />
11-12<br />
anni 12-13<br />
anni<br />
AIC<br />
Ottenimento<br />
P&R<br />
13-14<br />
anni<br />
Nota su regolamentazione<br />
La valutazione <strong>del</strong> livello di regolamentazione <strong>del</strong> processo prende in considerazione sia la<br />
complessità e la quantità <strong>del</strong>le norme, che i tempi indotti da queste ultime sul processo<br />
20-25<br />
anni<br />
Scadenza<br />
Brevetto<br />
37