Parte 2 - CusMiBio - Università degli Studi di Milano
Parte 2 - CusMiBio - Università degli Studi di Milano
Parte 2 - CusMiBio - Università degli Studi di Milano
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Sano o malato<br />
Schede informative <strong>di</strong> tre malattie monogeniche<br />
Scheda 1: ANEMIA FALCIFORME (SCD) #OMIM 141900.0243<br />
L’anemia falciforme, chiamata anche DREPANOCITOSI e SICKLE- CELL DISEASE (dal nome greco e inglese<br />
usato rispettivamente per in<strong>di</strong>care la parola italiana “falce”, è una malattia ere<strong>di</strong>taria autosomica recessiva<br />
caratterizzata dalla classica forma a falce che hanno i globuli rossi <strong>degli</strong> in<strong>di</strong>vidui affetti.<br />
CAUSE. Questa malattia è causata da una mutazione nel<br />
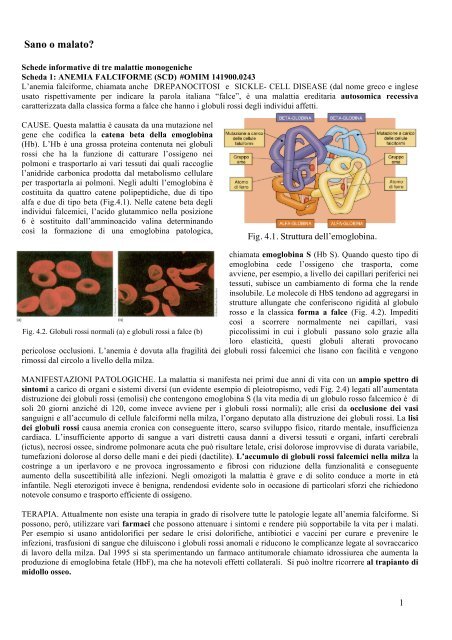
gene che co<strong>di</strong>fica la catena beta della emoglobina<br />
(Hb). L’Hb è una grossa proteina contenuta nei globuli<br />
rossi che ha la funzione <strong>di</strong> catturare l’ossigeno nei<br />
polmoni e trasportarlo ai vari tessuti dai quali raccoglie<br />
l’anidride carbonica prodotta dal metabolismo cellulare<br />
per trasportarla ai polmoni. Negli adulti l’emoglobina è<br />
costituita da quattro catene polipepti<strong>di</strong>che, due <strong>di</strong> tipo<br />
alfa e due <strong>di</strong> tipo beta (Fig.4.1). Nelle catene beta <strong>degli</strong><br />
in<strong>di</strong>vidui falcemici, l’acido glutammico nella posizione<br />
6 è sostituito dall’amminoacido valina determinando<br />
così la formazione <strong>di</strong> una emoglobina patologica,<br />
Fig. 4.1. Struttura dell’emoglobina.<br />
chiamata emoglobina S (Hb S). Quando questo tipo <strong>di</strong><br />
emoglobina cede l’ossigeno che trasporta, come<br />
avviene, per esempio, a livello dei capillari periferici nei<br />
tessuti, subisce un cambiamento <strong>di</strong> forma che la rende<br />
insolubile. Le molecole <strong>di</strong> HbS tendono ad aggregarsi in<br />
strutture allungate che conferiscono rigi<strong>di</strong>tà al globulo<br />
rosso e la classica forma a falce (Fig. 4.2). Impe<strong>di</strong>ti<br />
così a scorrere normalmente nei capillari, vasi<br />
Fig. 4.2. Globuli rossi normali (a) e globuli rossi a falce (b) piccolissimi in cui i globuli passano solo grazie alla<br />
loro elasticità, questi globuli alterati provocano<br />
pericolose occlusioni. L’anemia è dovuta alla fragilità dei globuli rossi falcemici che lisano con facilità e vengono<br />
rimossi dal circolo a livello della milza.<br />
MANIFESTAZIONI PATOLOGICHE. La malattia si manifesta nei primi due anni <strong>di</strong> vita con un ampio spettro <strong>di</strong><br />
sintomi a carico <strong>di</strong> organi e sistemi <strong>di</strong>versi (un evidente esempio <strong>di</strong> pleiotropismo, ve<strong>di</strong> Fig. 2.4) legati all’aumentata<br />
<strong>di</strong>struzione dei globuli rossi (emolisi) che contengono emoglobina S (la vita me<strong>di</strong>a <strong>di</strong> un globulo rosso falcemico è <strong>di</strong><br />
soli 20 giorni anziché <strong>di</strong> 120, come invece avviene per i globuli rossi normali); alle crisi da occlusione dei vasi<br />
sanguigni e all’accumulo <strong>di</strong> cellule falciformi nella milza, l’organo deputato alla <strong>di</strong>struzione dei globuli rossi. La lisi<br />
dei globuli rossi causa anemia cronica con conseguente ittero, scarso sviluppo fisico, ritardo mentale, insufficienza<br />
car<strong>di</strong>aca. L’insufficiente apporto <strong>di</strong> sangue a vari <strong>di</strong>stretti causa danni a <strong>di</strong>versi tessuti e organi, infarti cerebrali<br />
(ictus), necrosi ossee, sindrome polmonare acuta che può risultare letale, crisi dolorose improvvise <strong>di</strong> durata variabile,<br />
tumefazioni dolorose al dorso delle mani e dei pie<strong>di</strong> (dactilite). L’accumulo <strong>di</strong> globuli rossi falcemici nella milza la<br />
costringe a un iperlavoro e ne provoca ingrossamento e fibrosi con riduzione della funzionalità e conseguente<br />
aumento della suscettibilità alle infezioni. Negli omozigoti la malattia è grave e <strong>di</strong> solito conduce a morte in età<br />
infantile. Negli eterozigoti invece è benigna, rendendosi evidente solo in occasione <strong>di</strong> particolari sforzi che richiedono<br />
notevole consumo e trasporto efficiente <strong>di</strong> ossigeno.<br />
TERAPIA. Attualmente non esiste una terapia in grado <strong>di</strong> risolvere tutte le patologie legate all’anemia falciforme. Si<br />
possono, però, utilizzare vari farmaci che possono attenuare i sintomi e rendere più sopportabile la vita per i malati.<br />
Per esempio si usano antidolorifici per sedare le crisi dolorifiche, antibiotici e vaccini per curare e prevenire le<br />
infezioni, trasfusioni <strong>di</strong> sangue che <strong>di</strong>luiscono i globuli rossi anomali e riducono le complicanze legate al sovraccarico<br />
<strong>di</strong> lavoro della milza. Dal 1995 si sta sperimentando un farmaco antitumorale chiamato idrossiurea che aumenta la<br />
produzione <strong>di</strong> emoglobina fetale (HbF), ma che ha notevoli effetti collaterali. Si può inoltre ricorrere al trapianto <strong>di</strong><br />
midollo osseo.<br />
1
FREQUENZA DELL’ALLELE DELLA ANEMIA FALCIFORME. Questa malattia è rara in Europa ma molto<br />
frequente in Africa, tra i neri d’America e in genere nelle zone malariche del pianeta. Questa <strong>di</strong>versa <strong>di</strong>stribuzione è<br />
dovuta al fatto che i globuli rossi <strong>degli</strong> in<strong>di</strong>vidui portatori (eterozigoti) hanno maggiore resistenza verso il Plasmo<strong>di</strong>um<br />
falciparum, l’agente della malaria, rispetto ai globuli rossi dei soggetti sani. Questo vantaggio genetico <strong>degli</strong> eterozigoti<br />
ha favorito il mantenimento dell’allele dell’anemia falciforme nelle zone malariche. L’alta frequenza <strong>di</strong> questa<br />
mutazione presso la popolazione nera Americana è un retaggio genetico delle origini africane. Tra i neri d’America,<br />
l’anemia falciforme ha una frequenza <strong>di</strong> 1/500 nascite e circa 1 in<strong>di</strong>viduo su 12 è eterozigote. Lo stesso vale per i<br />
citta<strong>di</strong>ni americani con origini nelle regioni paludose dell’Italia, Grecia, <strong>di</strong> Cipro e del Me<strong>di</strong>o Oriente.<br />
Scheda 2: IPERCOLESTEROLEMIA FAMILIARE TIPO A (FH) #OMIM 143890<br />
Delle varie forme <strong>di</strong> ipercolesterolemia familiare (FH), la ipercolesterolemia <strong>di</strong> tipo A è una malattia ere<strong>di</strong>taria<br />
autosomica dominante caratterizzata da un elevato livello <strong>di</strong> colesterolo nel sangue dovuto a un <strong>di</strong>fetto del recettore<br />
che consente l’ingresso del colesterolo nelle cellule. Il colesterolo è un composto steroideo molto importante per le<br />
cellule animali in quanto è un componente essenziale delle membrane.<br />
Il colesterolo, sia quello prodotto ex novo (principalmente dalle cellule del fegato e dell’intestino) che quello<br />
introdotto con la <strong>di</strong>eta, circola nel sangue in particelle lipoproteiche; se è presente in eccesso, favorisce la formazione<br />
<strong>di</strong> placche all'interno delle arterie (fenomeno detto aterosclerosi) che portano alla loro occlusione.<br />
La colesterolemia, cioè la quantità <strong>di</strong> colesterolo totale nel sangue, si misura in milligrammi per decilitro <strong>di</strong> sangue<br />
(mg/dl). Il valore normale è <strong>di</strong> 150/200 mg/dl, circa. Nelle analisi, oltre al valore del colesterolo totale, viene riportato<br />
anche il valore delle lipoproteine. Queste comprendono:<br />
A) le lipoproteine LDL (Low Density Lipoprotein:<br />
lipoproteina a bassa densità, Fig. 4.3) che contengono il<br />
colesterolo che verrà assorbito dalle cellule in seguito al legame<br />
delle LDL al recettore specifico sulla membrana cellulare. Se le<br />
LDL sono in eccesso, rispetto alla capacità <strong>di</strong> assorbimento dei<br />
vari tessuti, il colesterolo può depositarsi sulla parete interna<br />
delle arterie formando le placche aterosclerotiche;<br />
B) le lipoproteine HDL (High Density Lipoprotein: lipoproteina<br />
ad alta densità) che raccolgono il colesterolo in eccesso da tutti<br />
gli organi e lo trasportano al fegato da dove viene eliminato nella<br />
bile. Questo colesterolo viene chiamato "colesterolo buono",<br />
anche se, in realtà, non esiste un colesterolo "buono" e uno<br />
"cattivo", in quanto è sempre lo stesso colesterolo che viene<br />
trasportato da proteine <strong>di</strong>verse.<br />
CAUSE. La forma più comune <strong>di</strong> FH <strong>di</strong> tipo A è la forma<br />
eterozigote (1 su 500 nati vivi) in cui i valori <strong>di</strong> colesterolemia<br />
vanno da 220 a 550 mg/dl; nella forma omozigote, molto più<br />
grave, ma anche più rara (1 su 1.000.000 nati vivi ), i valori <strong>di</strong><br />
colesterolemia sono compresi tra 550 e 1000 mg/dl.<br />
La FH <strong>di</strong> tipo A è dovuta alle alterazioni <strong>di</strong> un gene, situato sul<br />
cromosoma 19, che co<strong>di</strong>fica una proteina recettore localizzata<br />
sulla membrana cellulare che ha la funzione <strong>di</strong> captare le LDL e<br />
pemetterne l'entrata nelle cellule. Una volta trasportate all'interno<br />
delle cellule, le LDL vengono degradate dagli enzimi lisosomiali e<br />
il colesterolo liberato inibisce l'enzima 3-idrossi-3metil-glutaril-<br />
CoA riduttasi, necessario per la sintesi <strong>di</strong> nuovo colesterolo. Se<br />
manca il recettore <strong>di</strong> membrana o è prodotto in quantità<br />
Fig. 4.3 Una particella LDL è costituita da un<br />
monostrato <strong>di</strong> fosfolipi<strong>di</strong> e da molecole <strong>di</strong><br />
colesterolo libero (all’esterno) e esterificato ad aci<strong>di</strong><br />
grassi (all’interno). Una molecola <strong>di</strong> apoproteina B-<br />
100 è inclusa nel monostrato lipi<strong>di</strong>co e me<strong>di</strong>a il<br />
legame della LDL al recettore. Una particella LDL<br />
tipica contiene circa 800 molecole <strong>di</strong> fosfolipi<strong>di</strong> e<br />
500 molecole <strong>di</strong> colesterolo libero nel monostrato<br />
esterno e circa 1500 molecole <strong>di</strong> colesterolo<br />
esterificato al suo interno.<br />
La forma B <strong>di</strong> HF (OMIM #144010) è dovuta a<br />
mutazioni del gene della apoproteina B-100 che<br />
co<strong>di</strong>fica una proteina incapace <strong>di</strong> legare il recettore.<br />
insufficiente (come negli eterozigoti) o ne è prodotta una forma alterata, le LDL si accumulano nel sangue dando<br />
origine alle placche aterosclerotiche e la sintesi <strong>di</strong> colesterolo intracellulare aumenta. Delle circa 150 mutazioni <strong>di</strong><br />
questo gene (in alcuni casi il recettore è <strong>di</strong>fettivo e non lega le LDL in altri ha ridotta affinità per le LDL, oppure<br />
lega le LDL ma non è in grado <strong>di</strong> internalizzarle), in Italia ne sono state in<strong>di</strong>viduate 72 che presentano una particolare<br />
<strong>di</strong>stribuzione regionale.<br />
MANIFESTAZIONI PATOLOGICHE. La formazione <strong>di</strong> placche aterosclerotiche (ateromi) rende <strong>di</strong>fficile la<br />
circolazione del sangue e può essere causa <strong>di</strong> problemi car<strong>di</strong>ocircolatori, con rischio <strong>di</strong> infarto che, pur variando da<br />
persona a persona, è comunque legato al valore della colesterolemia. Un tipico sintomo <strong>di</strong> FH è la comparsa (dopo i<br />
30-40 anni negli eterozigoti, entro i primi 4 anni negli omozigoti) <strong>di</strong> accumuli <strong>di</strong> grasso chiamati xantomi a livello dei<br />
2
ten<strong>di</strong>ni (negli eterozigoti) o nella cute dei gomiti e delle ginocchia (negli omozigoti). Tuttavia, nel 40% <strong>degli</strong><br />
eterozigoti gli xantomi possono essere assenti del tutto, e anche le altre manifestazioni patologiche, come gli<br />
xantelasmi (accumuli <strong>di</strong> grasso all'esterno dell'occhio) o l'arco corneale (piccola lunetta che si forma dentro l'occhio<br />
alla periferia della cornea) possono essere assenti o manifestarsi in forma lieve. In questi casi, l'eterozigote può<br />
scoprire <strong>di</strong> essere affetto da FH solo in seguito a controlli ematici casuali e forse troppo tar<strong>di</strong> per instaurare una<br />
adeguata terapia. In assenza <strong>di</strong> trattamenti specifici, gli uomini intorno ai 35 anni e le donne intorno ai 45 anni hanno<br />
alto rischio <strong>di</strong> andare incontro a gravi problemi car<strong>di</strong>ocircolatori.<br />
Negli omozigoti il quadro clinico è più grave. I sintomi sono riscontrabili entro i primi 4 anni <strong>di</strong> vita e i problemi<br />
car<strong>di</strong>ocircolatori compaiono già nell'infanzia, determinando molto spesso la morte per infarto prima dei 20 anni.<br />
TERAPIA. Le semplici raccomandazioni <strong>di</strong>etetiche non sono sufficienti a ridurre le manifestazioni patologiche <strong>di</strong><br />
questa malattia, perchè l'organismo produce comunque colesterolo <strong>di</strong> per sé. I pazienti adulti vengono trattati con le<br />
statine, potenti inibitori dell'enzima 3-idrossi-3-metil-glutaril-Co A riduttasi che è necessario, come già detto, per la<br />
sintesi del colesterolo. Insieme alle statine vengono somministrate anche delle resine che sequestrano il colesterolo<br />
sotto forma <strong>di</strong> aci<strong>di</strong> biliari e ne permettono l'espulsione con le feci, e l'ezetimide che inibisce selettivamente<br />
l'assorbimento <strong>di</strong> colesterolo a livello intestinale. E' importante, in ogni caso, evitare tutti i fattori <strong>di</strong> rischio <strong>di</strong><br />
malattie car<strong>di</strong>ovascolari, come fumo, alcool, stress e tenere sotto controllo la pressione arteriosa.<br />
Negli omozigoti la terapia d'elezione è però rappresentata dalla LDL- aferesi che consiste, ogni due settimane circa,<br />
nella rimozione extracorporea delle LDL dal sangue con una speciale apparecchiatura.<br />
Scheda 3: EMOFILIA A (HEMA) #OMIM 306700<br />
L’emofilia è una malattia per cui il sangue fatica a coagulare con conseguenti gravi rischi in caso <strong>di</strong> ferite o possibilità<br />
<strong>di</strong> emorragie interne anche in assenza <strong>di</strong> traumi. La causa va ricercata nell'assenza <strong>di</strong> alcune proteine in<strong>di</strong>spensabili<br />
per la coagulazione (Fig. 4.4). Nell'85% dei casi, si tratta del fattore VIII (emofiliaA, HEMA) e, nei restanti casi, del<br />
fattore IX (emofilia B, HEMB), entrambi prodotti dal fegato. I geni del fattore VIII e IX della coagulazione sono<br />
localizzati sul cromosoma X. La malattia si manifesta solo nei maschi, mentre le femmine sono portatrici sane.<br />
Rarissime sono le femmine malate, il che fa pensare che la con<strong>di</strong>zione <strong>di</strong> omozigosi per l'emofilia sia letale nella<br />
femmina allo stato fetale. Esistono forme <strong>di</strong> emofilia A <strong>di</strong> gravità <strong>di</strong>versa (<strong>di</strong>pendente dal tipo <strong>di</strong> mutazione). Il 60%<br />
<strong>degli</strong> in<strong>di</strong>vidui con emofilia A ha la forma grave.<br />
1 2<br />
3<br />
Fig. 4.4 La cascata <strong>degli</strong> eventi della coagulazione e i<br />
principali fattori coinvolti. Il fattore VIII è coinvolto<br />
nella emostasi secondaria e nella crescita del coagulo. Il<br />
fattore IX (non in<strong>di</strong>cato nella figura) è una delle<br />
proteine della cascata <strong>di</strong> reazioni che portano<br />
all’attivazione della protrombina a trombina.<br />
CAUSE. Malattia molto eterogenea geneticamente (vedere §2.4) in quanto dovuta a molte mutazioni <strong>di</strong>verse del gene<br />
del fattore VIII. Il catalogo OMIM riporta 270 varianti alleliche principali.<br />
3
MANIFESTAZIONI PATOLOGICHE. I soggetti emofilici gravi sono a rischio <strong>di</strong> emorragie per cure dentistiche, o<br />
durante operazioni chirurgiche o in seguito a traumi. Soffrono <strong>di</strong> emorragie interne, che insorgono in assenza <strong>di</strong><br />
traumi o ferite e senza alcuna causa apparente. Ripetuti versamenti <strong>di</strong> sangue nelle articolazioni provocano forme <strong>di</strong><br />
invali<strong>di</strong>tà (problemi articolari e riduzione delle capacità motorie).<br />
Emofilia: un pò <strong>di</strong> storia<br />
La documentazione storica sull'emofilia è molto antica. Già nel III- V sec. a.C. la normativa giudaica proibiva<br />
<strong>di</strong> sottoporre a circoncisione (una pratica rituale, presente in alcuni popoli, in cui ai bambini viene tagliato<br />
l'anello prepuziale che circonda il glande nel pene) i bambini con parenti morti per emorragia durante tale<br />
pratica. Tuttavia, solo a partire dal XIX secolo si iniziano gli stu<strong>di</strong> e le osservazioni che porteranno ad in<strong>di</strong>viduare<br />
il ruolo delle madri nella trasmissione della malattia e la possibilità <strong>di</strong> prevenire la morte <strong>degli</strong> affetti con le<br />
trasfusioni. Nel 1942 viene <strong>di</strong>mostrata l'ere<strong>di</strong>tarietà legata al cromosoma X e negli ultimi 50 anni, con il rapido<br />
progresso delle tecniche del DNA ricombinante, è stato possibile attivare una terapia con il fattore VIII<br />
ricombinante che ha portato la speranza <strong>di</strong> vita <strong>degli</strong> emofilici a superare i 50 anni.<br />
Indubbiamente, nella storia il caso più eclatante <strong>di</strong> emofilia è quello che riguarda la regina Vittoria e i suoi<br />
<strong>di</strong>scendenti, l'ultimo dei quali è morto nel 1945. Esiste però, nella famiglia reale spagnola, una pronipote della<br />
regina Vittoria, Olimpia, che ha avuto un figlio maschio morto da bambino <strong>di</strong> una malattia del sangue e che<br />
potrebbe essere l'unica portatrice vivente sulla quale effettuare il test genetico in grado <strong>di</strong> <strong>di</strong>agnosticare quale tipo<br />
<strong>di</strong> emofilia, A o B, ha colpito l'intera famiglia reale e forse <strong>di</strong> in<strong>di</strong>viduarne l'esatta mutazione. A questo proposito si<br />
ricorda che questa mutazione deve essere comparsa in uno dei gameti (paterno o materno) da cui è stata generata<br />
la regina Vittoria, in quanto non c'erano stati casi <strong>di</strong> questa malattia nei suoi ascendenti e che essa potrebbe essere<br />
stata influenzata dall'età paterna, in quanto aveva 52 anni al momento della nascita della figlia.<br />
Attraverso le sue figlie, il cromosoma X mutato della regina Vittoria, oltre che nella famiglia reale spagnola, è<br />
passato in quella reale russa e ha permesso, insieme all'esame dei polimorfismi STR (Short Tandem Repeat), <strong>di</strong><br />
ricostruire la parentela dei nove cadaveri della famiglia dello zar Nicola II, seppelliti ad Ekaterinburg durante la<br />
rivoluzione russa e attribuiti dai me<strong>di</strong>ci legali russi alle salme dello zar, della zarina, <strong>di</strong> tre dei loro 5 figli, del<br />
me<strong>di</strong>co personale dello zar e <strong>di</strong> tre domestici. L'analisi del DNA mitocondriale ha rivelato una stretta affinità tra<br />
la presunta zarina e i suoi tre figli e un parente <strong>di</strong> origine materna ancora vivente (il principe Filippo <strong>di</strong><br />
E<strong>di</strong>mburgo, suo pronipote). Lo stesso è stato verificato per il presunto zar e due suoi parenti <strong>di</strong> origine materna<br />
ancora viventi. Queste analisi del DNA hanno permesso anche <strong>di</strong> scoprire che nella tomba non c'erano tracce nè <strong>di</strong><br />
una delle principesse (probabilmente Maria) e tantomeno dello zarevich Alessio, il figlio emofilico dello zar.<br />
Come si ricorderà, questa incertezza riguardo alla fine della principessa fece sorgere il caso <strong>di</strong> Anna Anderson,<br />
una donna morta nel 1984, che per anni reclamò il titolo <strong>di</strong> principessa della famiglia reale russa. Ma,<br />
recentemente, l'esame dei polimorfismi RFLP del suo DNA estratto da un campione <strong>di</strong> cellule tumorali prelevate<br />
durante un'operazione chirurgica da lei subita quattro anni prima della morte, ha permesso <strong>di</strong> accertare che<br />
nessuna parentela esiste con la famiglia reale russa, risolvendo un caso che aveva appassionato l'opinione<br />
pubblica per più <strong>di</strong> mezzo secolo.<br />
Nonostante che, sulla base <strong>degli</strong> esami fatti col DNA, i resti dei cadaveri trovati a Ekaterinburg si potessero<br />
attribuire alla famiglia reale russa al 98,5%, il 17 Luglio 1998, ai funerali che per essi furono celebrati nell'antica<br />
chiesa della fortezza <strong>di</strong> Pietro e Paolo a S. Pietroburgo, l'arcivescovo della città non presenziò al rito e il patriarca<br />
Alessio II continuò a sostenere che i test del DNA, non essendo infallibili, erano inaffidabili.<br />
TERAPIA. A partire dagli anni sessanta del secolo scorso gli emofilici vengono sottoposti a regolari trasfusioni <strong>di</strong> un<br />
concentrato della proteina mancante, ciò che consente loro una vita quasi normale. II concentrato della proteina però<br />
deriva dal sangue <strong>di</strong> donatori e può essere fonte <strong>di</strong> infezioni (epatite, AIDS). Inoltre il farmaco è molto costoso. Oggi<br />
è <strong>di</strong>sponibile un tipo <strong>di</strong> fattore VIII ottenuto per ingegneria genetica e quin<strong>di</strong> esente da rischi infettivi.<br />
Per l’emofilia A, la terapia sostitutiva con il fattore VIII ricombinante è efficace nella maggior parte dei casi, ma<br />
alcuni soggetti producono anticorpi che riducono o neutralizzano completamente l’attività della proteina.<br />
I progressi della terapia genica sembrano promettenti per la cura <strong>di</strong> questo tipo <strong>di</strong> patologia.<br />
4
A ciascuna storia il suo pe<strong>di</strong>gree. Scenari e simulazione <strong>di</strong> consulenza genetica<br />
Siete un genetista me<strong>di</strong>co e lavorate in un consultorio genetico. Si presentano da voi tre in<strong>di</strong>vidui che richiedono<br />
consulenza genetica. Ciascuno vi racconta la storia della sua famiglia. Costruite in base ai dati raccolti dall’anamnesi<br />
familiare, il pe<strong>di</strong>gree delle 3 famiglie e impostate l’analisi del DNA da richiedere al laboratorio per rispondere alle<br />
domande poste dai 3 pazienti.<br />
Scenario 1. Anemia falciforme #OMIM 141900.0243<br />
In consultorio si presenta una giovane donna (età 35 anni) che vive a <strong>Milano</strong> ma è <strong>di</strong> origine sarda. Ha avuto 3 figli. I<br />
primi due, un maschio e una femmina, sono sani. Al terzo, maschio, che aveva manifestato un ittero dovuto a una crisi<br />
emolitica, è stata <strong>di</strong>agnosticata l’anemia falciforme. E’ in attesa <strong>di</strong> un quarto figlio (è alla fine della sesta settimana <strong>di</strong><br />
gravidanza) e vorrebbe informazioni sul rischio <strong>di</strong> avere un altro figlio malato. Aggiunge che in famiglia c’è un suo<br />
zio scapolo con la stessa patologia. A una indagine più approfon<strong>di</strong>ta, la donna aggiunge che suo marito, il padre dei<br />
suoi figli, è anch’esso sardo <strong>di</strong> origine ed è suo cugino primo.<br />
Viene suggerito alla donna <strong>di</strong> sottoporsi ad amniocentesi per effettuare l’analisi del DNA e determinare il genotipo del<br />
nascituro.<br />
Costruite in base ai dati raccolti dall’anamnesi familiare, il pe<strong>di</strong>gree della famiglia (vedere §2.2). Per controllare se il<br />
pe<strong>di</strong>gree che avete costruito è corretto, controllate a pagina 22.<br />
Che probabilità ha il nascituro <strong>di</strong> essere sano Di avere l’anemia falciforme Di essere portatore dell’allele HbS<br />
L’analisi del DNA consente <strong>di</strong> identificare il genotipo del nascituro e, quin<strong>di</strong>, <strong>di</strong> trasformare una probabilità in un dato<br />
certo. (Se non ricordate la modalità <strong>di</strong> trasmissione ere<strong>di</strong>taria dell’anemia falciforme consultate il catalogo OMIM,<br />
§2.3).<br />
Come abbiamo già detto, la mutazione HbS è una sostituzione <strong>di</strong> base A --> T nella sequenza CCT GAG GAG che<br />
fa cambiare il significato del 6° codone del gene della catena beta dell’Hb (Glu --> Val).<br />
La sequenza mutata CCT GTG GAG non contiene più il sito <strong>di</strong> restrizione dell’enzima MstII<br />
dove N in questo caso è la base G.<br />
Amplificando con la PCR un segmento <strong>di</strong> DNA <strong>di</strong> 376 bp che comprende il sito MstII (posizionato 175 bp<br />
dall’estremità 5’), e <strong>di</strong>gerendo il prodotto della PCR con l’ER MstII, quale è il numero e la lunghezza (in bp) delle<br />
bande che vi aspettate <strong>di</strong> trovare nel caso <strong>di</strong> in<strong>di</strong>vidui omozigoti normali, eterozigoti o omozigoti affetti (vedere §3.5,<br />
Fig. 3.5 e 3.6)<br />
Pr fw<br />
MstII<br />
Anche se sarebbe sufficiente analizzare solo il<br />
DNA del feto, analizzeremo anche il DNA dei<br />
Esone 1<br />
genitori e quello dei fratelli sani per confermare la<br />
Pr rev<br />
con<strong>di</strong>zione <strong>di</strong> eterozigosità dei genitori e poter<br />
identificare tra i fratelli un eventuale portatore.<br />
376 bp<br />
(Hb S)<br />
5' CC/TNAGG 3'<br />
3’ GG/ANTCC 5’<br />
175 + 201 bp<br />
(Hb A)<br />
Scenario 2. Ipercolesterolemia familiare #OMIM 143890<br />
Si presenta in consultorio un giovane <strong>di</strong> 21 anni che appartiene a una famiglia in cui ci sono e ci sono stati parecchi<br />
casi <strong>di</strong> malattia car<strong>di</strong>ovascolare. Il giovane, che non presenta sintomi <strong>di</strong> ipercolesterolemia, vuole fare l’analisi del<br />
DNA per sapere se ha ere<strong>di</strong>tato il gene dell’ipercolesterolemia familiare e, nel caso, per iniziare precocemente una<br />
terapia preventiva e sottoporsi a una <strong>di</strong>eta opportuna.<br />
Descrive così la sua famiglia: “ La famiglia <strong>di</strong> mio padre <strong>di</strong>scende dai Boeri. I miei bisnonni paterni stavano a Città<br />
del Capo. I nonni si sono trasferiti in Europa intorno al 1920 e si sono stabiliti in Olanda e successivamente in Italia. I<br />
nonni paterni sono morti <strong>di</strong> cause a me non note. Mio padre è deceduto l’anno scorso <strong>di</strong> carcinoma al polmone ma<br />
soffriva <strong>di</strong> cuore. Un mio zio paterno è morto <strong>di</strong> infarto abbastanza giovane. Con i suoi figli che vivono in un’altra<br />
città non ci ve<strong>di</strong>amo da tempo. Una zia paterna ha livelli normali <strong>di</strong> colesterolo. Un altro mio zio paterno <strong>di</strong> 40 anni<br />
ha il colesterolo alto, così come sua moglie e una delle sue due figlie. Mia madre, olandese, e mia sorella hanno<br />
normali livelli <strong>di</strong> colesterolo.”<br />
Costruite il pe<strong>di</strong>gree <strong>di</strong> questa famiglia (vedere §2.2) e controllate la risposta a pagina 22.<br />
L’ipercolesterolemia familiare è una patologia che presenta eterogeneità genetica sia allelica che <strong>di</strong> locus (ve<strong>di</strong> §2.4 e<br />
§4.1, legenda della figura 4.3). La FH è 5 volte più frequente nelle popolazioni <strong>di</strong> <strong>di</strong>scendenza Boera rispetto a quelle<br />
<strong>di</strong> Stati Uniti e Europa. Alcune mutazioni sono prevalenti in determinati gruppi etnici.<br />
5
Negli in<strong>di</strong>vidui <strong>di</strong> origine Boera è frequente una mutazione del gene del recettore LDL consistente in una sostituzione<br />
<strong>di</strong> una coppia <strong>di</strong> basi (G C) nell’esone 4 del gene che crea un sito per l’enzima <strong>di</strong> restrizione DdeI: 5’ C/TNAG 3’<br />
3’ GANT/C 5’<br />
La mutazione causa anche una sostituzione amminoaci<strong>di</strong>ca Asp Glu che mo<strong>di</strong>fica la maturazione della proteina<br />
recettore e ne riduce la capacità <strong>di</strong> legare LDL una volta giunta sulla superficie cellulare.<br />
Il probando riferisce che lo zio deceduto si era sottoposto all’analisi del DNA e le analisi in suo possesso confermano<br />
che era portatore della mutazione sopradescritta.<br />
Pr fw<br />
Amplificando con la PCR un segmento <strong>di</strong> DNA <strong>di</strong><br />
DdeI<br />
235 bp che comprende il sito DdeI (posizionato<br />
Esone 4<br />
130 bp dall’estremità 5’), e <strong>di</strong>gerendo il prodotto<br />
Pr rev<br />
della PCR con l’ER DdeI, quale è il numero e la<br />
lunghezza (in bp) delle bande che vi aspettate <strong>di</strong><br />
trovare negli in<strong>di</strong>vidui che hanno ere<strong>di</strong>tato l’allele<br />
235 bp (normale)<br />
mutato (omozigoti o eterozigoti) e in quelli che<br />
non lo hanno (omozigoti normali)<br />
130 + 105 bp (mutato)<br />
Analizzeremo il DNA dei membri della famiglia<br />
<strong>di</strong>sponibili, per in<strong>di</strong>viduare chi è portatore della stessa mutazione identificata nello zio deceduto.<br />
Scenario 3. Emofilia A (HEMA) #OMIM 306700<br />
Sei anni fa ha richiesto consulenza genetica una giovane coppia proveniente da un piccolo centro dell’appennino<br />
marchigiano. All’anamnesi sono stati raccolti i seguenti dati: la donna aveva un fratello emofilico, morto a 8 anni in<br />
seguito ad una emorragia intestinale. I suoi genitori non hanno l’emofilia. Il marito è sano. Il loro primo figlio è un<br />
maschio affetto da emofilia A. La domanda della coppia riguardava il rischio <strong>di</strong> avere altri figli emofilici. La risposta<br />
era stata che ogni figlio maschio aveva 50% <strong>di</strong> probabilità <strong>di</strong> essere emofilico e che era quin<strong>di</strong> consigliabile, in caso <strong>di</strong><br />
una successiva gravidanza in cui fosse accertato il sesso maschile del feto, eseguire l’analisi del DNA fetale per fare<br />
<strong>di</strong>agnosi prenatale <strong>di</strong> malattia.<br />
Essendo l’emofilia A, come abbiamo già detto (ve<strong>di</strong> §2.4) una patologia estremamente eterogenea (il catalogo OMIM<br />
riporta 270 varianti alleliche principali), per identificare quale è la mutazione responsabile della malattia in ogni<br />
singolo caso è necessario effettuare delle analisi del DNA estremamente complesse e laboriose che richiedono<br />
laboratori attrezzati. Una via più semplice e tecnicamente meno impegnativa è quella <strong>di</strong> fare una <strong>di</strong>agnosi in<strong>di</strong>retta <strong>di</strong><br />
malattia utilizzando un marcatore RFLP associato all’allele malattia (ve<strong>di</strong> pag. 15). Sono stati identificati alcuni<br />
RFLP associati al gene che co<strong>di</strong>fica il fattore VIII. Come abbiamo già detto (ve<strong>di</strong> pag. 15), per avere dei risultati<br />
significativi è necessario analizzare il DNA <strong>di</strong> molti in<strong>di</strong>vidui all’interno della famiglia per identificare quale RFLP<br />
utilizzare e quale allele del RFLP scelto è associato all’allele malattia all’interno <strong>di</strong> quella famiglia.<br />
La coppia è ora in attesa <strong>di</strong> un figlio che ecograficamente è risultato maschio. La donna vuole sottoporsi ad<br />
amniocentesi. Si rimette in contatto con il centro <strong>di</strong> <strong>Milano</strong> che consiglia <strong>di</strong> rivolgersi a un laboratorio del capoluogo<br />
della regione <strong>di</strong> residenza che non è attrezzato per l’identificazione <strong>di</strong>retta della mutazione ma è invece<br />
tecnologicamente in grado <strong>di</strong> eseguire una analisi del DNA per identificare RFLP associati alla malattia.<br />
Sono <strong>di</strong>sponibili i DNA della donna che richiede l’analisi e che è in attesa del quarto figlio, <strong>di</strong> sua madre, <strong>di</strong> due suoi<br />
fratelli e <strong>di</strong> una sua sorella; sono <strong>di</strong>sponibili anche i DNA dei tre bambini della signora: il maschio emofilico e due<br />
figlie femmine nate nel frattempo.<br />
Costruite il pe<strong>di</strong>gree <strong>di</strong> questa famiglia (rivedere il §2.2). Se non ricordate la modalità <strong>di</strong> trasmissione ere<strong>di</strong>taria<br />
dell’emofilia A consultate il catalogo OMIM (§2.3). Verificate il vostro pe<strong>di</strong>gree con quello che trovate a pag.22.<br />
Nella famiglia è risultato significativo il RFLP legato a un sito Hind III all’interno dell’introne 19 del gene. Questa<br />
mutazione è una piccola delezione (del AGAG) che crea un sito Hind III 5'A/A G C T T 3'<br />
3'T T C G A/A 5'<br />
Pr fw<br />
HindIII<br />
Introne 19<br />
Pr rev<br />
717 bp (-)<br />
167 + 550 bp (+)<br />
(+)(+)(+<br />
Nella famiglia l’allele malattia è associato all’allele (-)<br />
del RFLP (= assenza della delezione e quin<strong>di</strong> del sito).<br />
Quin<strong>di</strong> l’allele (-) sarà identificato dalla presenza <strong>di</strong> 1<br />
banda e l’allele (+) sarà identificato dalla presenza <strong>di</strong><br />
2 bande.<br />
Amplificando con la PCR un segmento <strong>di</strong> DNA <strong>di</strong><br />
717 bp che comprende il sito HindIII (posizionato 167<br />
bp dall’estremità 5’), e <strong>di</strong>gerendo il prodotto della<br />
PCR con l’ER HindIII, quale è il numero e la lunghezza (in bp) delle bande che vi aspettate <strong>di</strong> trovare nel DNA dei<br />
soggetti malati della famiglia, dei soggetti portatori, dei soggetti sani<br />
6
Tecniche utilizzate in laboratorio<br />
PCR ( Polymerase Chain Reaction)<br />
Si tratta <strong>di</strong> una tecnica innovativa che consiste nell’amplificazione specifica <strong>di</strong> segmenti <strong>di</strong> DNA me<strong>di</strong>ante reazioni<br />
a catena della DNA polimerasi.<br />
Il principio è molto semplice. Data una sequenza <strong>di</strong> DNA genomico a doppio filamento e due corte sequenze<br />
oligonucleoti<strong>di</strong>che (primer), <strong>di</strong> cui una<br />
complementare ad un tratto <strong>di</strong> filamento a<br />
una estremità del DNA da amplificare<br />
(forward primer) e l’altra complementare<br />
ad un altro tratto posto all’altra estremità<br />
(reverse primer), in presenza <strong>di</strong> una DNA<br />
polimerasi termostabile e <strong>di</strong> una miscela <strong>di</strong><br />
desossinucleoti<strong>di</strong> trifosfati in appropriate<br />
con<strong>di</strong>zioni <strong>di</strong> reazione, è possibile copiare<br />
numerosissime volte il tratto compreso tra i<br />
due primer, semplicemente facendo variare<br />
ciclicamente la temperatura <strong>di</strong> reazione.<br />
Infatti, raggiunta la temperatura <strong>di</strong><br />
denaturazione (circa 95°), la doppia elica si apre (fase <strong>di</strong> denaturazione), rendendo <strong>di</strong>sponibile lo stampo per la<br />
sintesi delle catene complementari. Se la temperatura si abbassa, in virtù delle loro minori <strong>di</strong>mensioni e della loro<br />
concentrazione, i primer si legheranno (fase <strong>di</strong> appaiamento o annealing) al DNA stampo prima che si rinaturi e in<br />
presenza <strong>di</strong> una DNA polimerasi con un optimum <strong>di</strong> temperatura elevato (circa 72°C), inizierà la sintesi <strong>di</strong> DNA a<br />
partire dai primer (fase <strong>di</strong> sintesi del DNA o extension), procedendo lungo i filamenti singoli.<br />
Al termine del primo ciclo <strong>di</strong> PCR da una doppia elica <strong>di</strong> DNA se ne ottengono due. Ripetendo il ciclo denaturazione<br />
– annealing – extension numerose volte (in genere da 20 a 30), si ottiene una massiccia amplificazione specifica <strong>di</strong> un<br />
dato tratto <strong>di</strong> DNA, corrispondente a DNA in quantità tale da essere visualizzabile in un gel <strong>di</strong> agarosio me<strong>di</strong>ante<br />
colorazione specifica.<br />
N° cicli Num N° molecole della sequenza <strong>di</strong><br />
DNA DNA bersaglio<br />
1 2<br />
2 4<br />
3 8<br />
4 16<br />
5 32<br />
10 1.024<br />
20 1.048.576<br />
Il metodo <strong>di</strong> analisi del DNA me<strong>di</strong>ante PCR presenta<br />
vantaggi molto evidenti:<br />
♦ è molto rapido (da 60 a 90 minuti),<br />
♦ la manualità è semplicissima,<br />
♦ è automatizzato,<br />
♦ i risultati sono visualizzabili con facilità.<br />
La PCR ha rivoluzionato la genetica molecolare. Le<br />
applicazioni della PCR sono praticamente infinite. I<br />
principali ambiti <strong>di</strong> utilizzo sono la <strong>di</strong>agnosi prenatale <strong>di</strong><br />
malattie genetiche e le indagini <strong>di</strong> me<strong>di</strong>cina legale.<br />
30 1.073.741.824<br />
Il limite più grosso è rappresentato dalla necessità <strong>di</strong> conoscere le sequenze fiancheggianti il tratto <strong>di</strong> DNA che si<br />
vuole amplificare, per poter costruire i primer specifici.<br />
Termociclatori<br />
Il successo della PCR è dovuto in gran parte alla possibilità <strong>di</strong> far avvenire l’intero<br />
processo in modo automatico all’interno <strong>di</strong> strumenti detti termociclatori (thermal<br />
cyclers) in grado <strong>di</strong> variare ciclicamente la temperatura tra le varie fasi <strong>di</strong> ogni ciclo <strong>di</strong><br />
PCR.<br />
Un esempio <strong>di</strong> profilo <strong>di</strong> amplificazione standard impostato me<strong>di</strong>ante un<br />
termociclatore è il seguente:<br />
1. denaturazione del DNA: 30 sec a 94°C<br />
2. appaiamento (annealing) dei primer: 30 sec a 50°-60°C 30-35 cicli<br />
3. sintesi (extension) <strong>di</strong> DNA: 30 sec-5 minuti a 72°C<br />
8
Taq polimerasi<br />
Il successo della PCR è stato possibile grazie anche all’uso <strong>di</strong> una<br />
DNA polimerasi termostabile estratta da batteri termofili (che vivono<br />
ad elevate temperature). Una DNA polimerasi utilizzata nelle reazioni<br />
della PCR è la Taq polimerasi, estratta dal batterio Thermus aquaticus.<br />
L’isolamento <strong>di</strong> DNA polimerasi termostabili ha sollevato gli operatori<br />
dall’ingrato compito <strong>di</strong> aggiungere enzima fresco ad ogni ciclo <strong>di</strong><br />
reazione!<br />
Scelta dei primer<br />
Per ogni PCR, è necessario usare due primer (forward e reverse).<br />
La scelta della coppia <strong>di</strong> primer è critica per una buona riuscita della PCR, ovvero per ottenere l’amplificazione<br />
<strong>di</strong> un tratto <strong>di</strong> DNA in modo specifico.<br />
I primer devono essere “<strong>di</strong>segnati” a livello <strong>di</strong> sequenze uniche nel genoma (presenti una sola volta), in modo che<br />
possano appaiarsi al DNA solo nella zona <strong>di</strong> interesse e non in altre zone<br />
Digestione con enzimi <strong>di</strong> restrizione (ER)<br />
Come abbiamo detto, gli ER sono endonucleasi che tagliano il legame fosfo<strong>di</strong>esterico nel DNA a doppia elica a<br />
livello <strong>di</strong> sequenze specifiche (siti <strong>di</strong> restrizione). La <strong>di</strong>gestione con ER va condotta a 37°C in una soluzione<br />
tampone (fornita insieme all’enzima dal produttore) che garantisce le con<strong>di</strong>zioni ottimali (<strong>di</strong> salinità e pH) per la<br />
<strong>di</strong>gestione. Il tempo <strong>di</strong> incubazione varia a seconda se si <strong>di</strong>gerisce DNA genomico o frammenti <strong>di</strong> DNA corti (ad<br />
esempio, un prodotto <strong>di</strong> PCR, come nel nostro caso). Nel primo caso la <strong>di</strong>gestione richiede almeno 8 ore (o tutta<br />
la notte). Nel secondo caso sono sufficienti da 1-4 ore.<br />
Gli ER sono reagenti costosi e delicati. Temono le contaminazioni (usare precauzioni nel prelevare l’enzima dalla<br />
soluzione stock) e l’inattivazione (si devono conservare a -20°C e, al momento dell’uso, mantenere sempre in un<br />
bagno <strong>di</strong> ghiaccio).<br />
Elettroforesi su gel <strong>di</strong> agarosio<br />
E’ una tecnica che consente <strong>di</strong> separare in base alle loro <strong>di</strong>mensioni (peso molecolare) molecole dotate <strong>di</strong><br />
carica, facendole migrare su un gel in presenza <strong>di</strong> un campo elettrico. Il gel può essere immaginato come una rete<br />
tri<strong>di</strong>mensionale attraverso le cui maglie migrano le molecole sotto l’azione <strong>di</strong> un campo elettrico. Il campo<br />
elettrico è generato da un apparecchio, detto alimentatore.<br />
Per separare molecole <strong>di</strong> DNA si usano gel <strong>di</strong> agarosio. Le<br />
molecole <strong>di</strong> DNA sono cariche negativamente per la<br />
presenza <strong>di</strong> gruppi fosfato e migrano dal polo negativo<br />
(catodo) verso il polo positivo (anodo). Per un certo<br />
intervallo <strong>di</strong> pesi molecolari, la velocità <strong>di</strong> migrazione è<br />
funzione del loro peso molecolare: tanto più grande è la<br />
molecola <strong>di</strong> DNA, tanto minore è la velocità <strong>di</strong> migrazione.<br />
E, viceversa, tanto più piccola è la molecola <strong>di</strong> DNA, tanto<br />
più velocemente migra. Le molecole <strong>di</strong> DNA <strong>di</strong> <strong>di</strong>versa<br />
lunghezza vengono pertanto separate in base alla <strong>di</strong>versa<br />
velocità <strong>di</strong> migrazione.<br />
Per poter determinare la lunghezza delle molecole <strong>di</strong> DNA<br />
in esame separate me<strong>di</strong>ante elettroforesi, vengono “caricati”<br />
sul gel anche i cosiddetti marcatori <strong>di</strong> peso molecolare,<br />
ossia una miscela <strong>di</strong> frammenti <strong>di</strong> DNA <strong>di</strong> cui è noto il peso<br />
molecolare. Confrontando la posizione dei frammenti a peso<br />
molecolare noto con quella dei frammenti <strong>di</strong> DNA in esame, è possibile<br />
calcolarne il peso molecolare, ossia la lunghezza. Dato che il peso<br />
molecolare <strong>di</strong> un frammento <strong>di</strong> DNA è proporzionale al numero <strong>di</strong><br />
coppie <strong>di</strong> nucleoti<strong>di</strong> (basi) che lo costituiscono, <strong>di</strong> solito esso viene<br />
espresso in paia <strong>di</strong> basi (bp).<br />
La separazione elettroforetica dura circa 45 minuti. Al termine, i vari<br />
frammenti <strong>di</strong> DNA, essendo incolori, possono essere visualizzati, con particolari sistemi <strong>di</strong> colorazione. Il DNA<br />
delle <strong>di</strong>verse classi <strong>di</strong> peso molecolare è visibile sotto forma <strong>di</strong> bande <strong>di</strong>stinte: sono le cosiddette bande <strong>di</strong> DNA.<br />
9
Comunemente, per poter visualizzare il DNA, durante la preparazione del gel si aggiunge all’agarosio l’<br />
Eurosafe, una sostanza che ha la proprietà <strong>di</strong> legarsi al DNA e <strong>di</strong> emettere fluorescenza se esposta a luce UV.<br />
Alla fine della corsa, le bande si visualizzano esponendo il gel alla luce ultravioletta<br />
Strumentazione e materiale a <strong>di</strong>sposizione<br />
spruzzette beuta e becker cilindro graduato piastra oscillante<br />
provette eppendorf<br />
provette 5-50 ml<br />
portaprovette<br />
bagnomaria e<br />
termometro<br />
micropipettatrici<br />
P10, P20, P200, P1000<br />
puntali per micropipette<br />
spatola<br />
power supply<br />
(alimentatore)<br />
carta<br />
carta stagnola<br />
contenitori per ghiaccio<br />
camice<br />
guanti<br />
monouso<br />
vaschetta e pettine per<br />
elettroforesi<br />
forno a<br />
microonde<br />
guanto da<br />
forno<br />
enzima <strong>di</strong> restrizione<br />
bilancia<br />
analitica<br />
centrifuga per provette<br />
eppendorf<br />
Principali prefissi e unità <strong>di</strong> misura usate in biologia cellulare e molecolare<br />
Prefisso Simbolo Multiplo o Esempio<br />
sottomultiplo<br />
chilo k 10 3 1 kg è 1.000 grammi<br />
centi c 10 -2 1 cm è 0.01 <strong>di</strong> un metro<br />
milli m 10 -3 1 mL è 10 -3 <strong>di</strong> un litro<br />
micro µ 10 -6 1 µm è 10 -6 <strong>di</strong> un metro<br />
nano n 10 -9 1 ng è 10 -9 <strong>di</strong> un grammo<br />
pico p 10 -12 1 pg è 10 -12 <strong>di</strong> un grammo<br />
Quantità Abbreviazione Equivalente<br />
litro<br />
l<br />
millilitro ml 10 -3 l<br />
(1 mL = 1 cm 3 = 1 cc)<br />
microlitro µl 10 -6 l<br />
(1 µL = 1 mm 3 )<br />
Dal pe<strong>di</strong>gree al DNA e ritorno<br />
10
Schema delle PCR e <strong>di</strong>gestione con enzimi <strong>di</strong> restrizione<br />
Vi vengono forniti i prodotti <strong>di</strong> PCR ottenuti amplificando il DNA dei <strong>di</strong>versi soggetti analizzati in ogni famiglia,<br />
identificabili nei pe<strong>di</strong>gree <strong>di</strong> §6.6. Lo schema delle PCR eseguite è quello riportato nei singoli scenari.<br />
Scenario 1<br />
Pr fw<br />
MstII<br />
Esone 1<br />
Pr rev<br />
376 bp<br />
(Hb S)<br />
Aggiungere ad ogni provetta:<br />
DNA <strong>di</strong> III 1 e III 2<br />
DNA <strong>di</strong> IV1 IV2, IV 3, IV 4<br />
DNA 8 µl<br />
Enzima MstII + tampone 10X 2 µl<br />
175 + 201 bp (Hb A)<br />
Incubare a 37°C per 40 min.<br />
10 µl<br />
Scenario 2<br />
Pr fw<br />
DdeI<br />
Esone 4<br />
Pr rev<br />
Aggiungere ad ogni provetta:<br />
DNA <strong>di</strong> II 6 e II 7<br />
DNA <strong>di</strong> III 3, III 4, III 5, III 6<br />
220 bp (normale)<br />
130 + 90 bp (mutato)<br />
DNA Scenario 3<br />
8 µl<br />
Enzima DdeI + tampone 10X 2 µl<br />
Incubare a 37°C per 40 min.<br />
10 µl<br />
Pr fw<br />
HindIII<br />
Introne 19<br />
Aggiungere ad ogni provetta:<br />
DNA <strong>di</strong> I 2<br />
DNA <strong>di</strong> II 2, II 3, II 4, II 5<br />
DNA <strong>di</strong> III 1, III 2, III 3, III 4<br />
Pr rev<br />
717 bp (-)<br />
DNA 8 µl<br />
Enzima HindIII + tampone 10X 2 µl<br />
167 + 550 bp (+)<br />
(+)(+)(+<br />
Incubare a 37°C per 40 min.<br />
10 µl<br />
11
Elettroforesi su gel <strong>di</strong> agarosio: soluzioni e reagenti forniti<br />
• tampone TBE (Tris-Borato-EDTA) 1x. Questo tampone si prepara facendo una <strong>di</strong>luizione 1:10 della soluzione<br />
“madre” TBE 10x, la cui composizione è:<br />
Tris 108 gr (0,89 M), acido borico 55 gr (0,89 M),<br />
EDTA 9.3 gr (0,02 M) pH 8,3,H 2 O a 1 litro. Il pH<br />
8,3 viene raggiunto automaticamente.<br />
• DNA<br />
• marcatore <strong>di</strong> peso molecolare (DNA del plasmide pUC8 tagliato con l’enzima <strong>di</strong> restrizione HaeIII)<br />
• agarosio in polvere (0.6 gr)<br />
• H 2 O <strong>di</strong>stillata<br />
• Eurosafe (2 µl)<br />
• loa<strong>di</strong>ng dye 6x, già pronto in eppendorf e contenente:<br />
• alcool etilico denaturato<br />
blu <strong>di</strong> bromofenolo 0.25%<br />
xxilene cianolo 0.25%<br />
gglicerolo 30%<br />
Preparazione del gel <strong>di</strong> agarosio<br />
Nota <strong>di</strong> laboratorio: la concentrazione <strong>di</strong> agarosio del gel viene scelta dal ricercatore in base alle <strong>di</strong>mensioni dei<br />
frammenti <strong>di</strong> DNA da separare. Nel nostro caso, dovendo separare frammenti lineari <strong>di</strong> DNA compresi tra 100 e<br />
1000bp si utilizza un gel <strong>di</strong> agarosio al 2%.<br />
Norme <strong>di</strong> lavoro:<br />
per chi ha i capelli lunghi: legarsi i capelli con un elastico<br />
prima <strong>di</strong> cominciare a lavorare, lavarsi le mani<br />
pulire il banco <strong>di</strong> lavoro con alcol etilico denaturato<br />
prima <strong>di</strong> cominciare l’esperimento, lo studente verrà familiarizzato con la strumentazione che dovrà utilizzare,<br />
in modo particolare con le micropipette<br />
Operazioni da svolgere per la preparazione del gel <strong>di</strong> agarosio:<br />
preparare la vaschetta per elettroforesi con bor<strong>di</strong> <strong>di</strong> “nastro adesivo <strong>di</strong> carta”<br />
verificare che il piano su cui si appoggia la vaschetta per elettroforesi sia a bolla<br />
prelevare 30 ml <strong>di</strong> tampone TBE 1x e metterlo nella beuta contenente l’agarosio<br />
Attenzione a non sprecare agarosio: costa 600 euro al chilo!<br />
pesare la beuta contenente la soluzione <strong>di</strong> agarosio e segnare il peso sul protocollo: _______<br />
leggere attentemente la “Nota <strong>di</strong> sicurezza sulla utilizzazione del forno a microonde”<br />
sciogliere l’agarosio nel forno a microonde impostato sulla potenza <strong>di</strong> 500V per 1 minuto. Aprire poi il forno a<br />
microonde, agitare delicatamente la soluzione con una presina, facendo attenzione a non scottarsi. Richiudere il<br />
forno a microonde e sciogliere la soluzione per un ulteriore minuto alla stessa potenza<br />
pesare la soluzione <strong>di</strong> agarosio (l’acqua del tampone, bollendo, è evaporata!) e riportare la soluzione <strong>di</strong><br />
agarosio al peso originale, utilizzando una spruzzetta con H 2 O <strong>di</strong>stillata. Attenzione: far cadere l’acqua<br />
delicatamente, facendola scivolare lungo i bor<strong>di</strong> della beuta, altrimenti si formano delle bolle<br />
aspettare 3-5 minuti, coprendo la beuta contenente la soluzione <strong>di</strong> agarosio con un pezzetto <strong>di</strong> stagnola, per<br />
evitare l’evaporazione. L’agarosio deve raggiungere una temperatura intorno ai 60°C, altrimenti rovina il<br />
supporto <strong>di</strong> plastica della vaschetta dell’elettroforesi. Aggiungere Eurosafe 2 µl e versare la soluzione <strong>di</strong> agarosio,<br />
evitando <strong>di</strong> formare bolle, nella vaschetta per elettroforesi dove è già stato inserito il pettine. I pozzetti si formano<br />
quando, una volta soli<strong>di</strong>ficato il gel, viene tolto il pettine<br />
lasciare soli<strong>di</strong>ficare a temperatura ambiente per circa 15 min. Quando il gel è soli<strong>di</strong>ficato <strong>di</strong>venta opaco<br />
mentre si aspetta la soli<strong>di</strong>ficazione del gel, fare delle prove <strong>di</strong> caricamento dei pozzetti del gel (12µl <strong>di</strong> loa<strong>di</strong>ng<br />
dye 1x) su altri gel già pronti<br />
togliere il nastro <strong>di</strong> carta dalla vaschetta e posizionarla nella camera <strong>di</strong> corsa<br />
versare il tampone TBE 1x nella camera <strong>di</strong> corsa (servono circa 200 ml), evitando che si formino bolle. Se si<br />
formano bolle, toglierle delicatamente con un puntale<br />
togliere lentamente il pettine, tenendosi perpen<strong>di</strong>colare rispetto al gel. I pozzetti che si sono formati nel gel<br />
hanno un volume <strong>di</strong> circa 15 µl<br />
12
Corsa elettroforetica<br />
Operazioni da svolgere per la corsa elettroforetica:<br />
aggiungere 2 µl <strong>di</strong> loa<strong>di</strong>ng dye 6x a ciascuna provetta contenente il DNA. Risospendere con la micropipetta,<br />
evitando <strong>di</strong> formare bolle. Il glicerolo presente nel loa<strong>di</strong>ng dye serve per rendere più densa la soluzione <strong>di</strong> DNA<br />
da caricare nel pozzetto e quin<strong>di</strong> a facilitarne l’entrata nel pozzetto<br />
se si formano bolle, centrifugare brevemente (1 sec) in una microcentrifuga eppendorf (in gergo <strong>di</strong> laboratorio,<br />
si <strong>di</strong>ce “spinnare” da spin, centrifugare)<br />
leggere attentemente la “Nota <strong>di</strong> sicurezza sulla utilizzazione della centrifuga”<br />
posizionare la vaschetta per l’elettroforesi su un foglio nero, perchè sia più facile in<strong>di</strong>viduare i pozzetti<br />
nel primo pozzetto a sinistra, caricare lentamente il marker <strong>di</strong> DNA a peso molecolare noto; caricare poi i<br />
campioni (12 µl) nei pozzetti successivi (ogni pozzetto ha un volume <strong>di</strong> 15 µl), ponendosi con la punta della<br />
micropipetta in un angolo del pozzetto e perpen<strong>di</strong>colare rispetto al gel, facendo attenzione a non bucare il fondo<br />
del pozzetto e a non far uscrie il campione fuori dal pozzetto<br />
chiudere il coperchio della cella elettroforetica<br />
leggere attentemente la “Nota <strong>di</strong> sicurezza sulla utilizzazione dell’apparato per elettroforesi”<br />
collegare i morsetti alla camera <strong>di</strong> corsa e ai poli del generatore <strong>di</strong> corrente, detto anche power supply; il DNA<br />
è carico negativamente e migra verso il polo positivo<br />
fissare il voltaggio al valore costante <strong>di</strong> 100 V e lasciare procedere la corsa elettroforetica per circa 40 min<br />
osservare la migrazione del loa<strong>di</strong>ng dye per valutare la migrazione del DNA, che, essendo incolore, non si può<br />
vedere. Il blu <strong>di</strong> bromofenolo migra alla stessa velocità <strong>di</strong> un frammento <strong>di</strong> DNA a doppia elica <strong>di</strong> circa 300 bp,<br />
mentre lo xilene cianolo migra alla stessa velocità <strong>di</strong> un frammento <strong>di</strong> circa 4.000 bp. Attenzione: la corsa<br />
elettroforetica deve essere fermata quando il blu <strong>di</strong> bromofenolo si trova a circa 1-2 cm dalla fine del gel, in modo<br />
da evitare che il DNA esca dal gel stesso. Se dovesse succedere, si perdono i campioni <strong>di</strong> DNA!<br />
Operazioni da svolgere alla fine della corsa elettroforetica. Questa operazione viene svolta dal tutor:<br />
osservare il gel al transilluminatore<br />
documentare il risultato del gel, facendo una foto al gel<br />
il tampone da elettroforesi TBE (Tris/Borato/EDTA) può essere riutilizzato <strong>di</strong>verse volte. Recuperate il<br />
tampone usato e versatelo in una bottiglia con un imbuto<br />
pulire le apparecchiature ed il banco <strong>di</strong> lavoro con acqua ed etanolo denaturato<br />
dopo aver finito <strong>di</strong> lavorare, lavarsi le mani<br />
leggere attentemente la “Nota <strong>di</strong> sicurezza sullo smaltimento dei rifiuti<br />
13
Analisi dei risultati<br />
14
Consulenza genetica<br />
Scenario 1. Conferma del genotipo eterozigote dei genitori e del genotipo omozigote recessivo <strong>di</strong> IV 3. IV 1<br />
e IV 2 sono sani, IV 4 (il feto) è portatore <strong>di</strong> anemia falciforme.<br />
Scenario 2. II 6 è Hz per la mutazione portata da II 1; II 7 non ha questa mutazione. III 4 (probando) ha<br />
ere<strong>di</strong>tato dal padre la mutazione presente nello zio paterno II 1. Svilupperà la malattia. Dieta e statine III<br />
3, a <strong>di</strong>fferenza del fratello, non ha ere<strong>di</strong>tato la mutazione; III 5 e III 6 non hanno ere<strong>di</strong>tato la mutazione<br />
paterna.<br />
Scenario 3. L’allele malattia è associato all’allele (-) del RFLP (III 1). Tutti gli in<strong>di</strong>vidui sani hanno l’allele<br />
(+). Maschi +/Y (II 3 e II 5); femmine +/+ (II 4) e +/- (portarici, la nonna I 2 e la madre II 2). Il feto III 4 ha<br />
ere<strong>di</strong>tato l’allele (-) dalla madre e quin<strong>di</strong> è emofilico. A richiesta della madre, è possibile eseguire un aborto<br />
terapeutico.<br />
Norme <strong>di</strong> sicurezza <strong>di</strong> sicurezza in laboratorio<br />
Norme <strong>di</strong> sicurezza per l’utilizzo <strong>degli</strong> strumenti <strong>di</strong> laboratorio<br />
Utilizzazione della centrifuga<br />
• chiudere accuratamente il tappo delle provette, per evitare la fuoriuscita <strong>di</strong> liquido<br />
e la formazione <strong>di</strong> aerosol<br />
• assicurarsi che il rotore sia bilanciato: provette <strong>di</strong> ugual peso devono essere<br />
inserite negli alloggiamenti <strong>di</strong>ametralmente opposti<br />
• chiudere il coperchio della centrifuga prima <strong>di</strong> avviarla<br />
• non cercare <strong>di</strong> aprire il coperchio prima del completo arresto del rotore<br />
• in caso <strong>di</strong> fuoriuscita <strong>di</strong> liquido dalle provette, avvertire il personale docente<br />
Utilizzazione dell’apparecchiatura per elettroforesi<br />
• assicurarsi che l’alimentatore sia spento, prima <strong>di</strong> collegare i morsetti<br />
• assicurarsi che il coperchio della vaschetta sia correttamente posizionato, prima <strong>di</strong><br />
collegare i morsetti<br />
• alla fine della corsa, prima <strong>di</strong> rimuovere il coperchio della cella elettroforetica,<br />
spegnere l’alimentatore e staccare i morsetti<br />
Smaltimento dei rifiuti<br />
• tutto il materiale <strong>di</strong>sposable (puntali, provette, pipette ecc.) va messo in appositi<br />
contenitori per rifiuti<br />
• cercare <strong>di</strong> ridurre al minimo il materiale da eliminare, visto i costi elevati del loro<br />
smaltimento.<br />
Manipolazione dell’Eurosafe<br />
• usare i guanti <strong>di</strong>sposable<br />
• evitare <strong>di</strong> spargere il prodotto sul banco <strong>di</strong> lavoro<br />
• terminata l’utilizzazione del prodotto o delle sue soluzioni, provvedere allo<br />
smaltimento<br />
15
Norme generali <strong>di</strong> sicurezza in laboratorio<br />
Qui <strong>di</strong> seguito sono elencate alcune norme elementari <strong>di</strong> sicurezza, che devono essere tassativamente<br />
rispettate.<br />
Entrando in laboratorio, in<strong>di</strong>viduare le vie <strong>di</strong> fuga, in<strong>di</strong>cate dalla segnaletica verde.<br />
In laboratorio indossare sempre il camice. Il camice deve essere chiuso sul davanti, con maniche<br />
lunghe e polsini ad elastico. Al termine delle attività, prima <strong>di</strong> lasciare il laboratorio, togliersi il camice. In<br />
ogni caso, non uscire dal laboratorio, per recarsi in altre aree (biblioteca, uffici, bar, ecc.), senza aver prima<br />
tolto il camice.<br />
Non introdurre in laboratorio borse, zaini o altro materiale non necessario.<br />
Indossare guanti monouso durante la manipolazione <strong>di</strong> sangue o <strong>di</strong> materiale da esso derivato non<br />
fissato. I guanti devono essere rimossi con attenzione e sostituiti quando sono visibilmente contaminati. I<br />
guanti si sfilano rovesciandoli e vanno gettati negli appositi contenitori.<br />
Gli studenti che presentano dermatiti o altre lesioni sulle mani, devono indossare guanti protettivi in<br />
tutte le fasi <strong>di</strong> lavoro.<br />
I guanti vanno tolti, quando si usino strumenti <strong>di</strong> qualsiasi natura (telefono, tastiera, strumenti<br />
scientifici, maniglie, ecc.). I guanti usati non vanno riutilizzati.<br />
Lavare le mani routinariamente, imme<strong>di</strong>atamente dopo la manipolazione <strong>di</strong> materiali contaminati e,<br />
in ogni caso, dopo la fine delle attività, anche quando sono stati indossati i guanti. Lavare sempre le mani<br />
prima <strong>di</strong> lasciare il laboratorio.<br />
In laboratorio è vietato mangiare, bere, fumare, portare oggetti alla bocca ed applicare cosmetici.<br />
Non pipettare mai con la bocca, ma utilizzare le apposite propipette.<br />
Non appoggiare recipienti contenenti liqui<strong>di</strong> biologici vicino al bordo del banco <strong>di</strong> lavoro.<br />
Tutto il materiale biologico d'origine umana (sangue, ecc.) deve essere considerato come<br />
potenzialmente infetto e pertanto trattato con le necessarie precauzioni.<br />
Segnalare imme<strong>di</strong>atamente al personale docente ogni spargimento <strong>di</strong> materiale biologico (ad es.<br />
schizzi <strong>di</strong> sangue) sul piano <strong>di</strong> lavoro, affinché si provveda alla decontaminazione con un germicida<br />
chimico appropriato (candeggina, ecc.).<br />
Decontaminare e pulire sempre, al termine del loro utilizzo, le apparecchiature scientifiche e, al<br />
termine della attività, i piani <strong>di</strong> lavoro.<br />
Seguire scrupolosamente le in<strong>di</strong>cazioni <strong>di</strong> sicurezza riportate nei protocolli <strong>di</strong> esperimento.<br />
Raccogliere tutti i liqui<strong>di</strong> biologici (sangue, terreni <strong>di</strong> coltura venuti a contatto con le cellule, cellule,<br />
ecc.) in speciali contenitori per rifiuti, che verranno successivamente eliminati previo trattamento con<br />
candeggina al 15%.<br />
Mettere il materiale <strong>di</strong>sposable (pipette, fiasche ecc.) venuto a contatto con materiale biologico in un<br />
sacco apposito, che verrà smaltito me<strong>di</strong>ante incenerimento.<br />
Stante i costi elevati dello smaltimento, ridurre il più possibile l’uso del materiale <strong>di</strong>sposable.<br />
Segnalare imme<strong>di</strong>atamente al personale docente qualsiasi incidente o la mancanza <strong>di</strong> materiale <strong>di</strong><br />
protezione<br />
A cura <strong>di</strong>:<br />
• Prof.ssa Giovanna Viale, Dipartimento <strong>di</strong> Biologia e Genetica per le Scienze Me<strong>di</strong>che, Università <strong>degli</strong> <strong>Stu<strong>di</strong></strong><br />
<strong>di</strong> <strong>Milano</strong>;<br />
• Prof.ssa Calciolari Tiziana, Liceo Scientifico Einstein, <strong>Milano</strong><br />
• Prof.ssa Capoccia Elena, Liceo Scientifico Donatelli Pascal, <strong>Milano</strong><br />
• Prof.ssa Clerici Valeria, Liceo Classico Legnani, Saronno<br />
• Prof.ssa Defen<strong>di</strong> Erina, Liceo Classico Beccaria, <strong>Milano</strong><br />
• Prof.ssa Dotelli Annarosa, Liceo Scientifico, Novello Codogno<br />
• Prof.ssa Grasso Maria, Liceo Scientifico Einstein, <strong>Milano</strong><br />
• Prof.ssa Mazza<strong>di</strong> Franca Liceo Scientifico, Novello Codogno<br />
• Prof.ssa Modelli Alessandra, Liceo Classico Beccaria, <strong>Milano</strong><br />
• Prof.ssa Parisi Elisabetta, Liceo Scientifico Severi, <strong>Milano</strong><br />
• Prof. ssa Pisauro Lucia, Liceo Virgilio, <strong>Milano</strong><br />
• Prof.ssa Porta Marina, Liceo Scientifico Banfi, Vimercate<br />
• Prof.ssa Vanzulli Lucina, Liceo Classico Legnani, Saronno<br />
Si ringrazia la Eppendorf Italia<br />
16