Química I - Rede e-Tec Brasil - Ministério da Educação
Química I - Rede e-Tec Brasil - Ministério da Educação
Química I - Rede e-Tec Brasil - Ministério da Educação
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
As ligações iônicas ocorrem, em regra geral, entre os elementos que tendem a<br />
perder elétrons e que possuem 1, 2 ou 3 elétrons na última cama<strong>da</strong> (metais) e<br />
os elementos que tendem a ganhar elétrons e que possuem 5, 6 ou 7 elétrons<br />
na última cama<strong>da</strong> (ametais).<br />
4.4.1 Notação ou fórmula de Lewis<br />
Essa fórmula representa os elementos através dos elétrons do último nível<br />
(elétrons de valência), indicando-os por pontos ou cruzetas.<br />
4.4.2 Estrutura cristalina dos compostos iônicos<br />
A fórmula NaCl é usa<strong>da</strong> para representar o cloreto de sódio e indica a pro-<br />
porção com que os íons participam do retículo cristalino (1:1), pois não existe<br />
uma partícula única de NaCl, já que íons positivos tendem a atrair para o seu<br />
redor íons negativos, e vice-versa.<br />
Na prática, a ligação iônica não envolve apenas dois átomos, mas sim uma<br />
quanti<strong>da</strong>de enorme de átomos.<br />
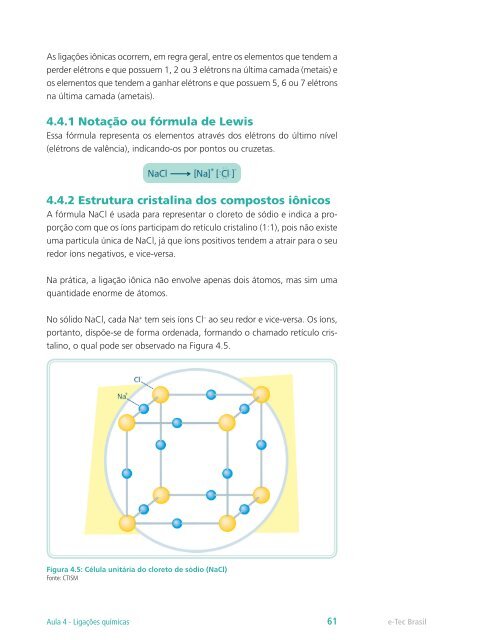
No sólido NaCl, ca<strong>da</strong> Na + tem seis íons Cl – ao seu redor e vice-versa. Os íons,<br />
portanto, dispõe-se de forma ordena<strong>da</strong>, formando o chamado retículo cristalino,<br />
o qual pode ser observado na Figura 4.5.<br />
Figura 4.5: Célula unitária do cloreto de sódio (NaCl)<br />
Fonte: CTISM<br />
Aula 4 - Ligações químicas 61<br />
e-<strong>Tec</strong> <strong>Brasil</strong>