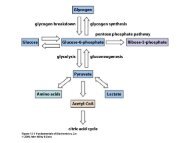
apostila de exercÃcios
apostila de exercÃcios
apostila de exercÃcios
- No tags were found...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
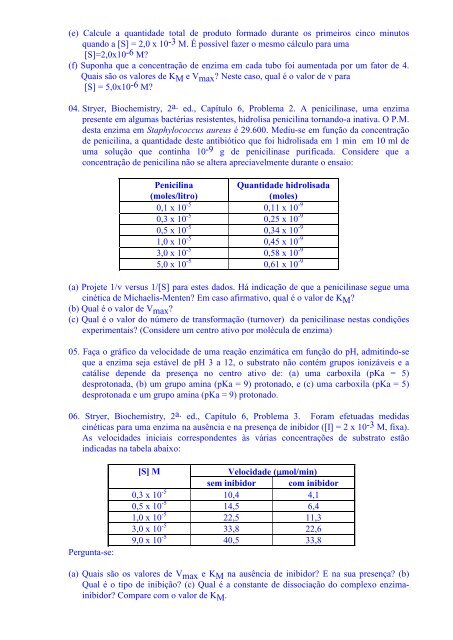
(e) Calcule a quantida<strong>de</strong> total <strong>de</strong> produto formado durante os primeiros cinco minutosquando a [S] = 2,0 x 10 -3 M. É possível fazer o mesmo cálculo para uma[S]=2,0x10 -6 M?(f) Suponha que a concentração <strong>de</strong> enzima em cada tubo foi aumentada por um fator <strong>de</strong> 4.Quais são os valores <strong>de</strong> K M e V max ? Neste caso, qual é o valor <strong>de</strong> v para[S] = 5,0x10 -6 M?04. Stryer, Biochemistry, 2 a. ed., Capítulo 6, Problema 2. A penicilinase, uma enzimapresente em algumas bactérias resistentes, hidrolisa penicilina tornando-a inativa. O P.M.<strong>de</strong>sta enzima em Staphylococcus aureus é 29.600. Mediu-se em função da concentração<strong>de</strong> penicilina, a quantida<strong>de</strong> <strong>de</strong>ste antibiótico que foi hidrolisada em 1 min em 10 ml <strong>de</strong>uma solução que continha 10 -9 g <strong>de</strong> penicilinase purificada. Consi<strong>de</strong>re que aconcentração <strong>de</strong> penicilina não se altera apreciavelmente durante o ensaio:Penicilina(moles/litro)Quantida<strong>de</strong> hidrolisada(moles)0,1 x 10 -5 0,11 x 10 -90,3 x 10 -5 0,25 x 10 -90,5 x 10 -5 0,34 x 10 -91,0 x 10 -5 0,45 x 10 -93,0 x 10 -5 0,58 x 10 -95,0 x 10 -5 0,61 x 10 -9(a) Projete 1/v versus 1/[S] para estes dados. Há indicação <strong>de</strong> que a penicilinase segue umacinética <strong>de</strong> Michaelis-Menten? Em caso afirmativo, qual é o valor <strong>de</strong> K M ?(b) Qual é o valor <strong>de</strong> V max ?(c) Qual é o valor do número <strong>de</strong> transformação (turnover) da penicilinase nestas condiçõesexperimentais? (Consi<strong>de</strong>re um centro ativo por molécula <strong>de</strong> enzima)05. Faça o gráfico da velocida<strong>de</strong> <strong>de</strong> uma reação enzimática em função do pH, admitindo-seque a enzima seja estável <strong>de</strong> pH 3 a 12, o substrato não contém grupos ionizáveis e acatálise <strong>de</strong>pen<strong>de</strong> da presença no centro ativo <strong>de</strong>: (a) uma carboxila (pKa = 5)<strong>de</strong>sprotonada, (b) um grupo amina (pKa = 9) protonado, e (c) uma carboxila (pKa = 5)<strong>de</strong>sprotonada e um grupo amina (pKa = 9) protonado.06. Stryer, Biochemistry, 2 a. ed., Capítulo 6, Problema 3. Foram efetuadas medidascinéticas para uma enzima na ausência e na presença <strong>de</strong> inibidor ([I] = 2 x 10 -3 M, fixa).As velocida<strong>de</strong>s iniciais correspon<strong>de</strong>ntes às várias concentrações <strong>de</strong> substrato estãoindicadas na tabela abaixo:Pergunta-se:[S] MVelocida<strong>de</strong> (µmol/min)sem inibidor com inibidor0,3 x 10 -5 10,4 4,10,5 x 10 -5 14,5 6,41,0 x 10 -5 22,5 11,33,0 x 10 -5 33,8 22,69,0 x 10 -5 40,5 33,8(a) Quais são os valores <strong>de</strong> V max e K M na ausência <strong>de</strong> inibidor? E na sua presença? (b)Qual é o tipo <strong>de</strong> inibição? (c) Qual é a constante <strong>de</strong> dissociação do complexo enzimainibidor?Compare com o valor <strong>de</strong> K M .





![PE]+ + N. Fragmentação por clivagem sigma](https://img.yumpu.com/50134385/1/180x260/pe-n-fragmentaaao-por-clivagem-sigma.jpg?quality=85)