You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Dział 7<br />
SOLE<br />
I I<br />
CuNO 3<br />
azotan(V) miedzi(I)<br />
II I<br />
Cu(NO 3<br />
) 2<br />
azotan(V) miedzi(II)<br />
I II<br />
K 2<br />
CO 3<br />
węglan potasu<br />
III III<br />
AlPO 4<br />
fosforan(V) glinu<br />
III II<br />
Fe 2<br />
(CO 3<br />
) 3<br />
węglan żelaza(III)<br />
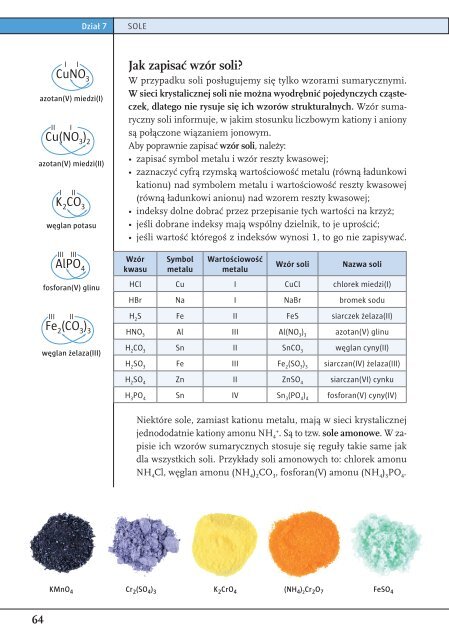
Jak zapisać wzór soli?<br />
W przypadku soli posługujemy się tylko wzorami sumarycznymi.<br />
W sieci krystalicznej soli nie można wyodrębnić pojedynczych cząsteczek,<br />
dlatego nie rysuje się ich wzorów strukturalnych. Wzór sumaryczny<br />
soli informuje, w jakim stosunku liczbowym kationy i aniony<br />
są połączone wiązaniem jonowym.<br />
Aby poprawnie zapisać wzór soli, należy:<br />
• zapisać symbol metalu i wzór reszty kwasowej;<br />
• zaznaczyć cyfrą rzymską wartościowość metalu (równą ładunkowi<br />
kationu) nad symbolem metalu i wartościowość reszty kwasowej<br />
(równą ładunkowi anionu) nad wzorem reszty kwasowej;<br />
• indeksy dolne dobrać przez przepisanie tych wartości na krzyż;<br />
• jeśli dobrane indeksy mają wspólny dzielnik, to je uprościć;<br />
• jeśli wartość któregoś z indeksów wynosi 1, to go nie zapisywać.<br />
Wzór<br />
kwasu<br />
Symbol<br />
metalu<br />
Wartościowość<br />
metalu<br />
Wzór soli<br />
Nazwa soli<br />
HCl Cu I CuCl chlorek miedzi(I)<br />
HBr Na I NaBr bromek sodu<br />
H 2<br />
S Fe II FeS siarczek żelaza(II)<br />
HNO 3<br />
Al III Al(NO 3<br />
) 3<br />
azotan(V) glinu<br />
H 2<br />
CO 3<br />
Sn II SnCO 3<br />
węglan cyny(II)<br />
H 2<br />
SO 3<br />
Fe III Fe 2<br />
(SO 3<br />
) 3<br />
siarczan(IV) żelaza(III)<br />
H 2<br />
SO 4<br />
Zn II ZnSO 4<br />
siarczan(VI) cynku<br />
H 3<br />
PO 4<br />
Sn IV Sn 3<br />
(PO 4<br />
) 4<br />
fosforan(V) cyny(IV)<br />
Niektóre sole, zamiast kationu metalu, mają w sieci krystalicznej<br />
jednododatnie kationy amonu NH 4+<br />
. Są to tzw. sole amonowe. W zapisie<br />
ich wzorów sumarycznych sto suje się reguły takie same jak<br />
dla wszystkich soli. Przykłady soli amonowych to: chlorek amonu<br />
NH 4<br />
Cl, węglan amonu (NH 4<br />
) 2<br />
CO 3<br />
, fosforan(V) amonu (NH 4<br />
) 3<br />
PO 4<br />
.<br />
KMnO 4 Cr 2 (SO 4 ) 3 K 2 CrO 4 (NH 4 ) 2<br />
Cr 2 O 7 FeSO 4<br />
64