Wichtige charakteristische Gruppen nach ihrer Priorität ... - Pharmazie
Wichtige charakteristische Gruppen nach ihrer Priorität ... - Pharmazie
Wichtige charakteristische Gruppen nach ihrer Priorität ... - Pharmazie
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
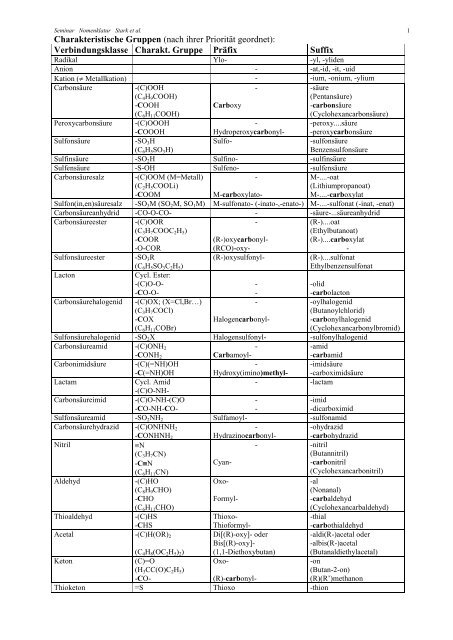
Seminar Nomenklatur Stark et al. 1<br />
Charakteristische <strong>Gruppen</strong> (<strong>nach</strong> <strong>ihrer</strong> Priorität geordnet):<br />
Verbindungsklasse Charakt. Gruppe Präfix Suffix<br />
Radikal Ylo- -yl, -yliden<br />
Anion - -at,-id, -it, -uid<br />
Kation ( Metallkation) - -ium, -onium, -ylium<br />
Carbonsäure<br />
-(C)OOH<br />
-<br />
-säure<br />
(C 4 H 9 COOH)<br />
(Pentansäure)<br />
-COOH<br />
(C 6 H 11 COOH)<br />
Carboxy<br />
-carbonsäure<br />
(Cyclohexancarbonsäure)<br />
Peroxycarbonsäure -(C)OOOH<br />
-COOOH<br />
-<br />
Hydroperoxycarbonyl-<br />
-peroxy....säure<br />
-peroxycarbonsäure<br />
Sulfonsäure<br />
-SO 3 H<br />
(C 6 H 5 SO 3 H)<br />
Sulfo-<br />
-sulfonsäure<br />
Benzensulfonsäure<br />
Sulfinsäure -SO 2 H Sulfino- -sulfinsäure<br />
Sulfensäure -S-OH Sulfeno- -sulfensäure<br />
Carbonsäuresalz -(C)OOM (M=Metall)<br />
(C 2 H 5 COOLi)<br />
-COOM<br />
-<br />
M-carboxylato-<br />
M-....-oat<br />
(Lithiumpropanoat)<br />
M-....-carboxylat<br />
Sulfon(in,en)säuresalz -SO 3 M (SO 2 M, SO 1 M) M-sulfonato- (-inato-,-enato-) M-....-sulfonat (-inat, -enat)<br />
Carbonsäureanhydrid -CO-O-CO- - -säure-...säureanhydrid<br />
Carbonsäureester -(C)OOR<br />
(C 3 H 7 COOC 2 H 5 )<br />
-COOR<br />
-O-COR<br />
-<br />
(R-)oxycarbonyl-<br />
(RCO)-oxy-<br />
(R-)....oat<br />
(Ethylbutanoat)<br />
(R-)....carboxylat<br />
-<br />
Sulfonsäureester<br />
-SO 3 R<br />
(C 6 H 5 SO 3 C 2 H 5 )<br />
Cycl. Ester:<br />
-(C)O-O-<br />
-CO-O-<br />
(R-)oxysulfonyl-<br />
(R-)....sulfonat<br />
Ethylbenzensulfonat<br />
Lacton<br />
-<br />
-olid<br />
-<br />
-carbolacton<br />
Carbonsäurehalogenid -(C)OX; (X=Cl,Br…)<br />
-<br />
-oylhalogenid<br />
(C 3 H 7 COCl)<br />
(Butanoylchlorid)<br />
-COX<br />
Halogencarbonyl-<br />
-carbonylhalogenid<br />
(C 6 H 11 COBr)<br />
(Cyclohexancarbonylbromid)<br />
Sulfonsäurehalogenid -SO 2 X Halogensulfonyl- -sulfonylhalogenid<br />
Carbonsäureamid -(C)ONH 2<br />
-<br />
-amid<br />
-CONH 2<br />
Carbamoyl-<br />
-carbamid<br />
Carbonimidsäure -(C)(=NH)OH<br />
-<br />
-imidsäure<br />
-C(=NH)OH<br />
Hydroxy(imino)methyl- -carboximidsäure<br />
Lactam<br />
Cycl. Amid<br />
- -lactam<br />
-(C)O-NH-<br />
Carbonsäureimid -(C)O-NH-(C)O<br />
-<br />
-imid<br />
-CO-NH-CO-<br />
-<br />
-dicarboximid<br />
Sulfonsäureamid -SO 2 NH 2 Sulfamoyl- -sulfonamid<br />
Carbonsäurehydrazid -(C)ONHNH 2<br />
-<br />
-ohydrazid<br />
-CONHNH 2<br />
Hydrazinocarbonyl- -carbohydrazid<br />
Nitril<br />
N<br />
-<br />
-nitril<br />
(C 3 H 7 CN)<br />
(Butannitril)<br />
-CN<br />
Cyan-<br />
-carbonitril<br />
(C 6 H 11 CN)<br />
(Cyclohexancarbonitril)<br />
Aldehyd<br />
-(C)HO<br />
(C 8 H 9 CHO)<br />
-CHO<br />
(C 6 H 11 CHO)<br />
Oxo-<br />
Formyl-<br />
-al<br />
(Nonanal)<br />
-carbaldehyd<br />
(Cyclohexancarbaldehyd)<br />
Thioaldehyd<br />
-(C)HS<br />
-CHS<br />
Thioxo-<br />
Thioformyl-<br />
-thial<br />
-carbothialdehyd<br />
Acetal -(C)H(OR) 2<br />
(C 4 H 8 (OC 2 H 5 ) 2 )<br />
Di[(R)-oxy]- oder<br />
Bis[(R)-oxy]-<br />
(1,1-Diethoxybutan)<br />
-aldi(R-)acetal oder<br />
-albis(R-)acetal<br />
(Butanaldiethylacetal)<br />
Keton<br />
(C)=O<br />
(H 3 CC(O)C 2 H 5 )<br />
-CO-<br />
Oxo-<br />
(R)-carbonyl-<br />
-on<br />
(Butan-2-on)<br />
(R)(R’)methanon<br />
Thioketon =S Thioxo -thion
Seminar Nomenklatur Stark et al. 2<br />
Charakteristische <strong>Gruppen</strong> (<strong>nach</strong> <strong>ihrer</strong> Priorität geordnet)- Fortsetzung:<br />
Verbindungsklasse Charakt. Gruppe Präfix Suffix<br />
Ketal >(C)(OR) 2<br />
Di[(R)-oxy]- oder<br />
Bis[(R)-oxy]-<br />
-ondi(R-)ketal oder<br />
onbis(R-)ketal<br />
(Butan-2-on-dimethylketal)<br />
(H 3 CC(OCH 3 ) 2 C 2 H 5 )<br />
Oxim =N-OH Hydroxyimino- -aloxim (von Aldehyd)<br />
-onoxim (von Keton)<br />
-(carb)aldehydoxim<br />
Hydrazon =N-NH 2 Hydrazono- -alhydrazon (von Aldehyd)<br />
-onhydrazon (von Keton)<br />
-(carb)aldehydhydrazon<br />
Alkohol, Phenol<br />
-OH<br />
(C 2 H 5 OH)<br />
Hydroxy-<br />
-ol<br />
(Ethanol)<br />
Thiol -SH Sulfanyl- -thiol<br />
Alkoholat, Phenolat -OM (M=Metall)<br />
(C 2 H 5 ONa)<br />
M-oxido<br />
Thiolat -SM (M=Metall) M-sulfido -M-....-thiolat<br />
Amin -NH 2 Amino- -amin<br />
Imin =NH Imino- -imin<br />
-M-...-olat<br />
(Natriumethanolat)<br />
Charakt. <strong>Gruppen</strong>, die nur als Präfixe benannt werden (im Namen alphabetisch angeordnet):<br />
-F Fluor-<br />
-NHOH Hydroxyamino-<br />
-Cl Chlor-<br />
-NHNH 2 Hydrazino-<br />
-ClO Chlorosyl-<br />
-OOH Hydroperoxy-<br />
-ClO 2 Chloryl-<br />
-OR Alkyloxy-<br />
-ClO 3 Perchloryl-<br />
-SR Alkylsulfanyl-<br />
-Br Brom-<br />
-OOR Alkylperoxy-<br />
-I Iod-<br />
-NCO Isocyanato-<br />
-IO Iodosyl-<br />
-NCS Isothiocyanato-<br />
=N 2 Diazo-<br />
-OCN Cyanato-<br />
-N 3 Azido-<br />
-SCN Thiocyanato-<br />
-NO Nitroso-<br />
-ONC Fulminato-<br />
-NO 2 Nitro-<br />
-NC Isocyan-<br />
Einfache Zahlsilben (Kohlenwasserstoffe):<br />
1 hen- 10 deca- 100 hecta-<br />
2 do- 20 (i)cosa- 200 dicta-<br />
3 tri- 30 triaconta- 300 tricta-<br />
4 tetra- 40 tetraconta- 400 tetracta-<br />
5 penta- 50 pentaconta- … …-cta-<br />
6 hexa- 60 hexaconta- 1000 kilia-<br />
7 hepta- 70 heptaconta- 2000 dilia-<br />
8 octa- 80 octaconta- 3000 trilia-<br />
9 nona- 90 nonaconta- ... …-lia-<br />
Ausnahmen: 1 = Mono- (numerisch); 11 = Undeca-;<br />
2 = Di- (alleinstehend).<br />
Ringnamen im Hantzsch-Widman-System:<br />
Ringgröße ungesättigt gesättigt<br />
3 -iren -iran<br />
4 -et -etan<br />
5 -ol -olan<br />
6 (O, S, Se etc.) a -in -an<br />
6 (N, Si etc.) a -in -inan<br />
7 -epin -epan<br />
8 -ocin -ocan<br />
9 -onin -onan<br />
10 -ecin -ecan<br />
a 6-Ringe werden verschieden benannt, je <strong>nach</strong>dem,<br />
zu welcher Gruppe das rangniedrigste Heteroatom<br />
gehört (cave: Pyran, Pyridin).<br />
a-Nomenklatur (in abfallender Priorität):<br />
-O- oxa; -O + = oxonia; -S- thia; -S + = thionia;<br />
-Se- selena; -N= aza; =N + = azonia.<br />
Freeware (IsisDraw + AutoNom; engl.):<br />
http://www.mdli.com/download
Seminar Nomenklatur Stark et al. 3<br />
2<br />
2a 1<br />
1<br />
1a<br />
4 4a<br />
3<br />
2a<br />
2<br />
Anellierte Kohlenwasserstoffe<br />
(in der Reihenfolge aufsteigender Priorität)<br />
5<br />
6 6a<br />
4<br />
3a<br />
1<br />
3<br />
2<br />
6<br />
5<br />
7<br />
4<br />
7a<br />
3a<br />
1<br />
3<br />
2<br />
7<br />
6<br />
8<br />
5<br />
8a<br />
4a<br />
1<br />
4<br />
2<br />
3<br />
6<br />
7<br />
5<br />
8<br />
4<br />
8a<br />
3a<br />
1<br />
3<br />
2<br />
1.Trialen 2.Tetralen 3.Pentalen 4.Inden 5.Naphtalen 6.Azulen<br />
8<br />
9<br />
7<br />
10<br />
10a<br />
1<br />
5a<br />
6 5<br />
2<br />
4<br />
3<br />
8 8a<br />
7<br />
6<br />
5a<br />
1<br />
5<br />
2<br />
3a<br />
4<br />
3<br />
8b 1<br />
7 7a<br />
6<br />
5<br />
4a<br />
8<br />
4<br />
8a<br />
3a<br />
2<br />
3<br />
7<br />
6<br />
(1H-Inden)<br />
8<br />
5<br />
1<br />
8a 8b<br />
4b 4a<br />
4<br />
2<br />
3<br />
(bzw. Naphtalin)<br />
8a<br />
8<br />
7<br />
1 2<br />
6<br />
2a<br />
1<br />
2a 1 3<br />
7.Heptalen 8.as-Indacen 9.s-Indacen 10.Biphenylen 11.Acenaphtylen 12.Fluoren<br />
1<br />
9a<br />
9<br />
2<br />
3a 1<br />
3<br />
3a<br />
4<br />
(asymmetrisch) (symmetrisch) (9H-Fluoren)<br />
6<br />
4<br />
5 4a<br />
4b<br />
3<br />
2<br />
1<br />
10a<br />
7<br />
8 9<br />
8a<br />
9a<br />
1<br />
2<br />
9<br />
1 3<br />
10 3a<br />
10a 10b 3a 1 4<br />
5<br />
2<br />
5a<br />
5<br />
9<br />
4<br />
1<br />
2<br />
10<br />
10a 10b 3a 1<br />
3<br />
7<br />
6<br />
3a<br />
4<br />
8<br />
5<br />
8a<br />
4b<br />
9<br />
9a<br />
4a<br />
4<br />
2<br />
3<br />
8<br />
5<br />
6a<br />
7 6<br />
7<br />
8a<br />
9<br />
10<br />
6<br />
10a<br />
5<br />
10<br />
4a<br />
3<br />
4<br />
13.Phenalen 14.Phenanthren * 15.Anthracen *<br />
(1H-Phenalen)<br />
1 2<br />
10 10b 2a<br />
10a<br />
9<br />
2a 1 3<br />
8<br />
4<br />
6a 5a<br />
7 6 5<br />
2<br />
1 3<br />
12 12b<br />
11<br />
4<br />
12a 4a<br />
4b<br />
10<br />
8b<br />
5<br />
9 8a<br />
8 6<br />
7<br />
10 1<br />
10a<br />
9<br />
2<br />
8a<br />
3a 1 3<br />
8<br />
5a 1 3a<br />
7<br />
6<br />
4<br />
5a<br />
5<br />
8<br />
6b 6a<br />
7<br />
6<br />
8<br />
5a<br />
5<br />
6a<br />
7 6<br />
16.Fluoranthen 17.Acephenanthrylen<br />
10 10b<br />
9<br />
10a<br />
8<br />
6a<br />
7<br />
1<br />
2<br />
12<br />
12a 1<br />
11<br />
2<br />
6<br />
4a<br />
3<br />
4b 4<br />
5<br />
11 12 12b<br />
10 11a<br />
12a 4a<br />
9 5<br />
7a 6a<br />
8 7 6<br />
18.Aceanthrylen 19.Triphenylen 20.Pyren 21.Chrysen 22.Tetraphen<br />
3<br />
4<br />
9<br />
8<br />
1<br />
10 11 12 1<br />
10a 11a 12a 2<br />
7<br />
6a<br />
6<br />
5a<br />
5<br />
4a<br />
4<br />
3<br />
10<br />
9<br />
11<br />
11a<br />
12 12a<br />
8<br />
7a<br />
7<br />
1<br />
2<br />
3<br />
3a<br />
3a 1 4<br />
6a<br />
6<br />
5<br />
11<br />
10<br />
12<br />
9<br />
12a 6b<br />
8a<br />
13<br />
12b<br />
8<br />
14<br />
7<br />
6a<br />
14b<br />
14a<br />
6<br />
2<br />
3<br />
4<br />
4a<br />
5<br />
11<br />
12<br />
10<br />
9a<br />
9<br />
1<br />
2<br />
12a 3a 1<br />
6b 1 6a<br />
23.Tetracen 24.Pleiaden 25.Picen 26.Perylen<br />
(früher Naphtacen)<br />
2 3<br />
8<br />
12b<br />
6b<br />
7<br />
6<br />
3<br />
3a<br />
4<br />
5<br />
11<br />
10<br />
2<br />
1 3<br />
14a<br />
4<br />
14<br />
4a<br />
12 13 13b<br />
12a 5<br />
8a<br />
13a 7a<br />
5a<br />
6<br />
9 8 7<br />
1<br />
4<br />
16 16b 4a 5<br />
15<br />
4b<br />
6<br />
16a<br />
12b 8a<br />
14<br />
7<br />
13 12a 8b 8<br />
12<br />
9<br />
11<br />
10<br />
13<br />
12a<br />
12<br />
11<br />
10a<br />
10<br />
14<br />
2<br />
16 1<br />
16c<br />
8a<br />
9<br />
3<br />
4<br />
4a<br />
16e<br />
5<br />
6<br />
6a<br />
7<br />
8<br />
2<br />
1 3<br />
14<br />
3a 4<br />
13 14a 14b<br />
3a 1<br />
10b<br />
12<br />
7b 7a<br />
11 10a 7c 1<br />
7c<br />
7<br />
10 8<br />
27.Pentaphen 28.Tetraphenylen 29.Hexahelicen * 30.Rubicen<br />
9<br />
5<br />
6<br />
11a<br />
11<br />
10<br />
12<br />
9a<br />
8<br />
2<br />
6a 1 6a<br />
4<br />
11<br />
10a<br />
4a<br />
7<br />
1 3<br />
18a<br />
4<br />
18<br />
4a<br />
13 1<br />
16 17<br />
13a 5<br />
2<br />
15<br />
5a<br />
2a<br />
5b<br />
2a 1<br />
14<br />
3<br />
6<br />
13 12<br />
7<br />
6a<br />
6<br />
5<br />
10<br />
9<br />
8<br />
11<br />
10<br />
12<br />
9<br />
15 16 15a<br />
16a<br />
1<br />
13a 13a 1 4b 1 4a<br />
3<br />
14<br />
2<br />
1<br />
13<br />
4b<br />
4<br />
12b 5a 1 5<br />
8a<br />
12a<br />
8<br />
7a<br />
7a 1<br />
7<br />
5a<br />
6<br />
13<br />
13a<br />
13a 1 13a 2<br />
31.Coronen 32.Trinapthylen 33.Pyranthren 34.Ovalen<br />
11<br />
10<br />
12<br />
9<br />
8<br />
6a 2<br />
14<br />
7<br />
6a 1<br />
14a<br />
6a<br />
6<br />
2a 1<br />
4a1<br />
2<br />
2a<br />
4a<br />
5<br />
3<br />
4<br />
___________________<br />
*Ausnahme von der systematischen Bezifferung
Seminar Nomenklatur Stark et al. 4<br />
Trivialnamen für Heterocyclen<br />
I. Monocyclen: (in Klammern: mit freier Valenz, d.h. wenn der Cyclus selbst ein Substituent ist)<br />
O<br />
S<br />
H<br />
N<br />
H<br />
N<br />
H<br />
N 1<br />
N 2<br />
H<br />
N<br />
N<br />
H<br />
H<br />
N 1<br />
H<br />
N<br />
3<br />
N<br />
N<br />
Furan Thiophen Pyrrol Pyrrolidin Pyrazol oder Pyrazolidin Imidazol oder Imidazolidin<br />
(Furyl-) (Thienyl-) 1H-Pyrazol 1H-Imidazol<br />
O S N N<br />
H<br />
2H-Pyran 4H-Thiopyran Pyridin Piperidin Pyridazin Pyrimidin Pyridazin Piperazin<br />
(Pyridyl-) (Piperidyl-)<br />
N<br />
N<br />
N<br />
N<br />
N<br />
N<br />
H<br />
H<br />
N<br />
N H<br />
1<br />
O<br />
4N H<br />
Morpholin<br />
II. Anellierte Heterocyclen: (Ist eine Anellierungsstelle ein Heteroatom, wird dieses normal weiternummeriert!)<br />
8<br />
7<br />
10<br />
9<br />
1<br />
9a N 10a<br />
5a N 4a<br />
6<br />
4<br />
5<br />
2<br />
3<br />
9<br />
8<br />
10<br />
N<br />
7<br />
6a<br />
1<br />
10b<br />
10a<br />
N<br />
6<br />
2<br />
4a<br />
5<br />
3<br />
4<br />
H 1<br />
N<br />
9<br />
8<br />
9a<br />
7<br />
2<br />
3<br />
N<br />
3a<br />
3a 1 4<br />
6a<br />
6<br />
5<br />
7<br />
6<br />
8 9<br />
8a<br />
5<br />
9a<br />
10a 4a N<br />
10<br />
1.Phenazin 2.1,10-Phenanthrolin 3.Perimidin 4.Acridin* 5.Phenanthridin<br />
(1H-Perimidin)<br />
7<br />
6<br />
5<br />
4b<br />
H<br />
8 9<br />
8a N 9a<br />
4a<br />
1<br />
4<br />
2<br />
3<br />
7<br />
6<br />
8<br />
N N 1 8a<br />
2<br />
N<br />
5<br />
4a<br />
4<br />
N<br />
3<br />
7<br />
6<br />
6.Carbazol* 7.Pteridin 8.Cinnolin 9.Chinazolin 10.Chinoxalin<br />
(9H-Carbazol)<br />
8<br />
N<br />
5<br />
N 1 2<br />
4<br />
3<br />
8 1<br />
N 1<br />
N2<br />
N 3<br />
4<br />
5<br />
4<br />
8<br />
5<br />
11. 1,5-Naphtyridin 12.Phtalazin 13.Chinolin 14.Isochinolin 15.2H-Chinolizin<br />
8<br />
5<br />
N 1 N 2<br />
4<br />
3<br />
8<br />
5<br />
8<br />
5<br />
N 1 2<br />
4<br />
1<br />
4<br />
N<br />
3<br />
2 N<br />
3<br />
1<br />
4<br />
2<br />
3<br />
9<br />
8<br />
8<br />
5<br />
9<br />
6<br />
10<br />
7<br />
9a<br />
6a<br />
N<br />
5<br />
1<br />
10b<br />
10a<br />
N<br />
6<br />
2<br />
N<br />
N 1 2<br />
4<br />
1<br />
4<br />
3<br />
4<br />
4a<br />
3<br />
2<br />
3<br />
5<br />
1N<br />
2<br />
6 7<br />
5 N<br />
N<br />
3<br />
4<br />
H<br />
8<br />
N 9<br />
6<br />
5<br />
H<br />
7 1 7a<br />
N<br />
4<br />
3a<br />
N<br />
N<br />
3<br />
2<br />
16.Purin* 17.Indazol 18.Indol 19.Isoindol 20.Indolizin<br />
(7H-Purin) (1H-Indazol) (1H-Indol) (2H-Isoindol)<br />
6<br />
5<br />
7<br />
4<br />
7a<br />
3a<br />
H<br />
1<br />
2<br />
3<br />
6<br />
5<br />
7<br />
4<br />
7a<br />
3a<br />
1<br />
2<br />
N H<br />
3<br />
7<br />
6<br />
8<br />
5<br />
8a<br />
N<br />
4<br />
1<br />
3<br />
2<br />
6<br />
5<br />
7<br />
7a<br />
N<br />
4<br />
1<br />
2<br />
3<br />
7<br />
6<br />
8 9<br />
5<br />
O<br />
10<br />
1<br />
4<br />
2<br />
3<br />
21.1H-Pyrrolizin 22.Xanthen* 23.2H-Chromen 24.Isochromen Phenothiazin<br />
(9H-Xanthen) (1H-Isochromen) (ohne Rangnummer)<br />
III. Heterocyclen, die nicht als Komponenten in der Anellierungsnomenklatur verwendet<br />
werden dürfen:<br />
8<br />
5<br />
O 1 4<br />
8<br />
5<br />
1<br />
O 2<br />
4<br />
3<br />
6<br />
5<br />
7<br />
4<br />
H<br />
N 1<br />
7a<br />
3a<br />
2<br />
3<br />
6<br />
5<br />
8<br />
5<br />
7<br />
4<br />
7a<br />
3a<br />
O 1 4<br />
3<br />
1<br />
N<br />
2<br />
H<br />
7<br />
6<br />
8<br />
5<br />
1<br />
O 2<br />
4<br />
H<br />
8 9<br />
8a N 9a<br />
Chroman Isochroman Indolin Isoindolin 9H--Carbolin<br />
(-Carbolin)<br />
___________________<br />
* Ausnahme von der systematischen Bezifferung<br />
5<br />
4b<br />
4a<br />
3<br />
1<br />
4<br />
N 2<br />
3<br />
8<br />
7<br />
9 10<br />
9a<br />
6<br />
5a<br />
H N<br />
1<br />
S<br />
5<br />
10a<br />
4a<br />
4<br />
2<br />
3
Seminar Nomenklatur Stark et al. 5<br />
<strong>Wichtige</strong> gebräuchliche Trivialnamen diverser Strukturklassen*:<br />
O<br />
O<br />
H<br />
O<br />
Toluen o-, m-, p-Xylen Styren Benzaldehyd Acetophenon [Butyrophenon]<br />
C H 3<br />
O<br />
H<br />
O<br />
H 3<br />
C N H<br />
CH 2 Cl 2 CHI 3<br />
Acetaldehyd Acetonitril Acrolein Acrylnitril Methylenchlorid Iodoform<br />
H<br />
O<br />
OH<br />
O<br />
OH<br />
Ameisensäure Propionsäure Buttersäure Oxalsäure Malonsäure<br />
HO<br />
O<br />
O<br />
OH<br />
O<br />
OH<br />
OH<br />
O<br />
Bernsteinsäure Maleinsäure Fumarsäure Glutarsäure<br />
HO<br />
O<br />
O<br />
OH<br />
O<br />
N<br />
OH<br />
HO<br />
O<br />
HO<br />
O<br />
O<br />
OH<br />
H O<br />
O<br />
O<br />
OH<br />
O<br />
OH<br />
H 3<br />
C (CH 2<br />
) 14<br />
COOH C<br />
H 3<br />
(CH 2<br />
) 16<br />
COOH COOH COOH<br />
Palmitinsäure Stearinsäure Ölsäure [Linolsäure]<br />
O<br />
OH<br />
O<br />
OH<br />
O<br />
OH<br />
OH<br />
COOH<br />
COOH<br />
Benzoesäure Zimtsäure Salicylsäure Phthalsäure Weinsäure<br />
HO<br />
O<br />
OH<br />
C H 3<br />
OH<br />
O<br />
OH<br />
C H 3<br />
O<br />
O<br />
OH<br />
H 3<br />
C<br />
O<br />
O<br />
OH<br />
HO<br />
HO<br />
O<br />
O<br />
O<br />
OH<br />
OH<br />
O<br />
OH<br />
OH O<br />
Glykolsäure Milchsäure Brenztraubensäure Acetessigsäure Citronensäure<br />
O<br />
O<br />
N<br />
O<br />
H<br />
(-, -) -Butyrolacton (-, -) -Valerolactam (-, -) -Butyrolactim Cumarin<br />
HO<br />
OH<br />
HO<br />
OH<br />
OH<br />
OH<br />
OH<br />
Ethylenglykol Glycerol Brenzcatechin Resorcin Hydrochinon p-Benzochinon<br />
O<br />
O<br />
OH<br />
O<br />
Anthrachinon Benzoin Nicotinsäure Barbitursäure<br />
Die Namen in eckigen Klammern werden nicht mehr zur Verwendung empfohlen.<br />
N<br />
OH<br />
O<br />
OH<br />
OH<br />
HO<br />
N<br />
OH<br />
O<br />
HN<br />
OH<br />
O<br />
NH<br />
O<br />
O<br />
O<br />
OH<br />
OH<br />
O<br />
O
Seminar Nomenklatur Stark et al. 6<br />
L-Aminosäuren<br />
‣ 20 Aminosäuren<br />
‣ in der Regel S-konfiguriert<br />
[Ausnahmen: Glycin (achiral);<br />
Cystein, Methionin (R)]<br />
Cystein, Methionin)<br />
H<br />
H<br />
H<br />
N<br />
+<br />
H<br />
R<br />
O<br />
-<br />
O<br />
: nicht-essentielle Aminosäuren<br />
: semiessentielle Aminosäuren<br />
: essentielle Aminosäuren<br />
Neutrale aliphatische Aminosäuren:<br />
R=<br />
H 3 C<br />
CH 3<br />
H CH 3<br />
L-Leucin (Leu) L L-Isoleucin (Ile) I<br />
CH 3<br />
CH 3<br />
H 3 C<br />
CH 3<br />
Glycin (Gly) G L-Alanin (Ala) A L-Valin (Val) V<br />
O-/S-haltige aliphatische Aminosäuren:<br />
R=<br />
OH<br />
H 3 C<br />
OH<br />
(Disulfid)<br />
L-Serin (Ser) S L-Threonin (Thr) T L-Cystein (Cys) C L-Methionin (Met) M)<br />
SH<br />
S<br />
S<br />
Cystin<br />
(Cys-Cys)<br />
S<br />
CH 3<br />
R-konfiguriert<br />
Saure Aminosäuren und ihre Amide:<br />
R=<br />
O<br />
O<br />
OH<br />
NH 2<br />
O OH<br />
NH 2<br />
L-Asparaginsäure (Asp) D L-Asparagin (Asn) N L-Glutaminsäure (Glu) E L-Glutamin (Gln) Q<br />
O<br />
Basische aliphatische Aminosäuren:<br />
Aromatische Aminosäuren:<br />
R=<br />
NH<br />
R=<br />
NH NH 2<br />
NH 2<br />
L-Arginin (Arg) R L-Lysin (Lys) K L-Phenylalanin (Phe) F L-Tyrosin (Tyr) Y<br />
OH<br />
Heterocyclische Aminosäuren:<br />
R=<br />
N<br />
NH<br />
NH<br />
H<br />
N<br />
H<br />
O<br />
OH<br />
L-Histidin (His) H L-Tryptophan (Trp) W L-Prolin (Pro) P<br />
Proteinstrukturen<br />
Primärstruktur<br />
Aminosäure-Sequenz<br />
(Polypeptidkette =<br />
Polyamid)<br />
Sekundärstruktur<br />
-Helix (30 AS)<br />
Tertiärstruktur<br />
3D-Anordnung des<br />
Monomers (Gestalt)<br />
(globuläre/anisotrope<br />
Proteine)<br />
Quartärstruktur<br />
3D-Gesamtanordnung der<br />
Proteinuntereinheiten<br />
(Aggregat aus Homo- oder<br />
Heterooligomeren)<br />
(Nicht-kovalente Bindungen)<br />
-Faltblatt (10 AS)<br />
Umkehrschleife<br />
(reversed turn)
Seminar Nomenklatur Stark et al. 7<br />
Nukleinsäuren (DNA / RNA)<br />
4<br />
3<br />
N 5<br />
6<br />
2 N<br />
1<br />
Pyrimidin<br />
9H-Purin<br />
O<br />
NH2<br />
O<br />
CH3<br />
HN<br />
N<br />
HN<br />
O N<br />
O N<br />
O N<br />
H H H<br />
T-Thymin<br />
Thymidin<br />
A-Adenin<br />
Adenosin<br />
C-Cytosin<br />
Cytidin<br />
6 N<br />
5<br />
7<br />
O<br />
NH2<br />
1 N<br />
8<br />
N<br />
N<br />
HN<br />
2<br />
N 9<br />
4<br />
N<br />
N<br />
H<br />
3<br />
N<br />
N<br />
H2N N<br />
N<br />
Paarungen: T – A; C – G (DNA); T – A, U – G (RNA)<br />
H<br />
G-Guanin<br />
Guanosin<br />
H<br />
U-Uracil<br />
Uridin<br />
- O<br />
O<br />
P<br />
O -<br />
O<br />
HO<br />
O<br />
O<br />
N<br />
R<br />
NH2<br />
N<br />
R=OH (RNA)<br />
R=H (DNA)<br />
C<br />
Base<br />
Cytosin<br />
Nucleosid<br />
Cytidin<br />
Nucleotid<br />
Cytidin-phosphat<br />
Nucleotide/ <strong>Wichtige</strong> Signalmoleküle<br />
NH2<br />
NH2<br />
N<br />
N<br />
N<br />
N<br />
- O<br />
O<br />
P<br />
O -<br />
O<br />
O<br />
P<br />
O -<br />
O<br />
O<br />
P<br />
O -<br />
O<br />
N<br />
O<br />
N<br />
O<br />
O<br />
P<br />
N<br />
O<br />
N<br />
Adenosin-5`-triphosphat (ATP)<br />
HO<br />
OH<br />
O -<br />
O OH<br />
Adenosin-3´,5´-monophosphat (cAMP)<br />
O<br />
H3C<br />
H3C<br />
N<br />
N<br />
CH2<br />
O<br />
N<br />
NH<br />
O<br />
O<br />
O -<br />
P<br />
O<br />
O<br />
+<br />
N<br />
NH2<br />
H<br />
OH<br />
H<br />
H<br />
O<br />
O<br />
OH<br />
OH<br />
CH2<br />
O<br />
P O -<br />
O<br />
P O<br />
O -<br />
N<br />
NH2<br />
N<br />
O<br />
N<br />
N<br />
O<br />
O<br />
P<br />
O -<br />
O<br />
HO<br />
N<br />
NH2<br />
N<br />
O<br />
OH<br />
N<br />
N<br />
HO<br />
OH<br />
HO OH<br />
Flavin-Adenin-Dinukleotid (FAD) Nicotinsäureamid-Adenin-Dinukleotid (NAD + )
Seminar: Stereochemie – Handout (Definitionen stereochemischer Begriffe) Stark et al. (Angaben ohne Gewähr) 1<br />
Anomere. -Diastereomere von Zuckern oder<br />
Zuckerderivaten, die sich nur am sog. anomeren<br />
Zentrum unterscheiden (Bsp.: -bzw. -D-<br />
Glucose).<br />
Atropisomere. -Isolierbare Stereoisomere aufgrund<br />
gehinderter Rotation um Einfachbindungen.<br />
Axiale Chiralität. - Tritt auf,<br />
wenn in einem Molekül vier<br />
Liganden paarweise um eine<br />
Achse angeordnet sind, wobei<br />
jedes Paar aus zwei<br />
CH 3<br />
Br<br />
Br<br />
C H 3<br />
CHO<br />
OH<br />
H<br />
OH<br />
OH<br />
CH 2 OH<br />
-Glucose<br />
Chiralitätsachse<br />
c<br />
OH<br />
a<br />
D L<br />
CH 2 OH<br />
O<br />
OH OH<br />
OH<br />
OH<br />
CH 2 OH<br />
O<br />
OH OH<br />
verschiedenen Liganden<br />
bestehen und in verschiedenen Ebenen angeordnet sein muß (s.<br />
Atropisomere).<br />
CIP-Nomenklatur. – Eine <strong>nach</strong> Cahn, Ingold und Prelog festgelegte<br />
Nomenklatur zur eindeutigen Bestimmung der Konfiguration<br />
stereoisomerer Verbindungen. Im Falle eines<br />
Chiralitätszentrums werden die Liganden <strong>nach</strong><br />
abnehmender Priorität unter Kennzeichnung der<br />
Substituenten mit a-d geordnet (Sequenzregel) und<br />
das Molekül so betrachtet, dass der rangniedrigste<br />
Ligand vom Betrachter wegweist<br />
(Zuordnungsregel). Die Prioritätenfolge ergibt sich<br />
aus der Ordnungszahl der direkt an das Chiralitätszentrum<br />
gebundenen Atome bzw. bei gleicher Ordnungszahl aus den sich<br />
angrenzenden Atomen. Beschreibt die Substituentenabfolge von a<br />
<strong>nach</strong> d eine Drehung im Uhrzeigersinn, so liegt R-Konfiguration vor,<br />
bei einer Anordnung entgegen dem Uhrzeigersinn S-Konfiguration.<br />
OH<br />
b<br />
HO<br />
H<br />
HO<br />
HO<br />
d<br />
=> R-Konfiguration<br />
Circulardichroismus (CD). – Abhängigkeit der Differenz der<br />
Absorptionskoeffizienten zwischen links- und rechtscircular<br />
polarisiertem Licht einer chiralen Verbindung von der Wellenlänge.<br />
cis/trans-Isomere. – Doppelbindungs- und<br />
Ringsysteme sowie Komplexverbindungen, bei<br />
denen gleiche oder gleichartige <strong>Gruppen</strong> um eine<br />
Bezugsebene nebeneinander (cis) oder<br />
gegenüberliegend (trans) angeordnet sind.<br />
Cotton-Effekt. – Auftreten eines Absorptionsmaximums bei<br />
Aufnahme eines ORD-Spektrtums einer chiralen Verbindung (s.<br />
Optische Rotationsdispersion)<br />
Diastereomere. - Stereoisomere, die sich<br />
nicht wie Bild und Spiegelbild verhalten<br />
und sowohl chiral als auch achiral sein<br />
können. (Bsp.: D-Allose zu D-Idose).<br />
Drehspiegelachse (S n). – Führt die<br />
CH 2 OH CH 2 OH<br />
Kombination einer Drehung von 360/n um<br />
eine durch das Molekül gelegte Achse und<br />
einer<br />
Spiegelung<br />
D-Allose<br />
D-Idose<br />
aller Atome<br />
an einer zu<br />
dieser Achse<br />
senkrechten Ebene zu einer äquivalenten Anordnung, so liegt eine n-<br />
zählige Drehspiegelachse vor (Bsp.: (E)-1,2-Dichlorethen).<br />
C 2<br />
H<br />
Cl<br />
Enantiomere. -Stereoisomere, die sich wie<br />
Bild und Spiegelbild verhalten und sich nicht H<br />
zur Deckung bringen lassen. Sie besitzen die HO<br />
Eigenschaft, monochromatisches Licht um<br />
H<br />
H<br />
jeweils den gleichen Betrag zu drehen, jedoch<br />
in entgegengesetzte Richtungen.<br />
Enantiomerenüberschuss (enantiomer<br />
excess = ee). – Beschreibt den proz.<br />
Überschuss eines Enantiomers (E 1) in<br />
einem Gemisch, dessen übriger Teil das<br />
Racemat darstellt (E 1+E 2). Korreliert mit<br />
der Enantiomerenreinheit einer chiralen Verbindung.<br />
endo-/exo-. – Stereodeskriptoren zur<br />
Beschreibung der relativen Konfiguration<br />
bicyclischer Verbindungen. Endo- bzw. exostellig<br />
bedeuted zur höher bezifferten<br />
Nachbarbrücke abgewandt bzw. zugewandt.<br />
Cl<br />
H<br />
Drehung<br />
CHO<br />
H<br />
OH<br />
H<br />
H<br />
CH 2 OH<br />
-Glucose<br />
Epimere. –Diastereomere, die sich in der Konfiguration an nur<br />
einem Chiralitätszentrum unterscheiden.<br />
Cl<br />
H<br />
H<br />
H<br />
H<br />
H<br />
Cl<br />
Cl<br />
cis-1,2-Dichlorcyclohexan<br />
CHO<br />
OH<br />
OH<br />
OH<br />
OH<br />
H<br />
Spiegelung<br />
Cl<br />
% ee =<br />
H<br />
HO<br />
H<br />
HO<br />
CHO<br />
OH<br />
H<br />
OH<br />
H<br />
([E 1<br />
]-[E 2<br />
])<br />
x 100<br />
([E 1<br />
]+[E 2<br />
])<br />
anti<br />
6<br />
5<br />
H<br />
Cl<br />
4<br />
7<br />
1<br />
Cl<br />
H<br />
syn<br />
3<br />
<br />
exo<br />
S 2<br />
2<br />
endo<br />
Eutomer. –Bezeichnung für das pharmakologisch stärker wirksame<br />
Enantiomer bei unterschiedlichem Wirkprofil eines Enantiomeren-paares<br />
( Distomer). Der Quotient der Aktivitäten von Eutomer und Distomer<br />
wird als Eudismisches Verhältnis bezeichnet.<br />
E/Z-Isomere. –Stereoisomere, die<br />
sich ergeben durch eingeschränkte<br />
Rotation aufgrund von<br />
COOH<br />
HOOC HOOC COOH<br />
Doppelbindungen, Ringsystemen<br />
sowie bei Komplexverbindungen mit<br />
quadratisch-planarer Anordnung der Liganden, wobei die Festlegung der<br />
Stereodeskriptoren zur Bestimmung der relativen Konfiguration <strong>nach</strong> den<br />
Sequenzregeln von Cahn, Ingold und Prelog erfolgt (s. Fumarsäure (E)<br />
und Maleinsäure (Z)).<br />
E-Isomer Z-Isomer<br />
Fischer-Projektion. – Vertikale Ausrichtung der C-Hauptkette einer<br />
Verbindung mit dem höher oxidierten Ende <strong>nach</strong> oben (s. Enantiomere).<br />
Haworth-Projektion. – siehe Anomere<br />
Helicale Chiralität. – Sonderfall der axialen<br />
Chiralität. Beschreibt das Molekül bei Betrachtung von<br />
oben eine Linksdrehung, erhält es den Stereodeskriptor<br />
M (bei Rechtsdrehung P).<br />
Homochiralität. – Eine enantiomerenreine Verbindung<br />
ist aus homochiralen Molekülen zusammengesetzt. Die<br />
Verbindung selbst kann nicht als homochiral bezeichnet werden (<br />
Heterochiralität).<br />
Br<br />
c<br />
sc<br />
ac<br />
Chiralitätsebene<br />
a<br />
O<br />
b<br />
O<br />
H<br />
H<br />
M-Pentahelicen<br />
Inversion. – Konfigurationsumkehr einer chiralen Verbindung im<br />
Verlauf einer chemischen Reaktion. (Bsp.: S N2-Reaktion)<br />
Konfigurationsisomere. – Isolierbare Stereoisomere mit unterschiedlicher<br />
räumlicher Anordnung von Atomen bzw. Atomgruppen, die<br />
nur durch formalen Bindungsbruch ineinander überführbar sind (s.<br />
Diastereomere).<br />
Konformationsisomere (= Konformere). – Meist nicht isolierbare<br />
Stereoisomere mit unterschiedlicher räumlicher Anordnung von Atomen<br />
bzw. Atomgruppen, die aus der Rotation um Einfachbindungen<br />
hervorgehen und Energieminima aufweisen.<br />
Konstitutionsisomere. – Isomere, die sich bei gleicher Summenformel in<br />
der Art und Reihenfolge der Verknüpfung der Atome voneinander<br />
unterscheiden (Bsp.: Dimethylether zu Ethanol).<br />
meso-Verbindung. – Diastereomere mit einer geraden<br />
Anzahl von Chiralitätszentren, durch die eine<br />
intramolekulre Spiegelebene gelegt werden kann (immer<br />
achiral).<br />
H<br />
H<br />
COOH<br />
OH<br />
OH<br />
COOH<br />
meso-Weinsäure<br />
Mutarotation. – Zeitliche Änderung des Drehwertes einer optisch<br />
aktiven Substanz bis zur Gleichgewichtseinstellung aufgrund einer<br />
chemischen Reaktion wie z.B. Racemisierung oder<br />
Epimerisierung.<br />
Newman-Projektion. – Projektions-formel zur<br />
Verdeutlichung der exakten Konformation an zwei<br />
be<strong>nach</strong>barten Atomen einer Verbindung (Bsp.: (+)-<br />
sc-n-Butan).<br />
sp<br />
CH 3<br />
CH 3<br />
Optische Aktivität. – Eigenschaft einer Substanz,<br />
die Schwingungsebene linear polarisierten Lichts<br />
um einen bestimmten Winkel zu drehen. Notwendige und hinreichende<br />
Bedingung ist Chiralität.<br />
H<br />
ap<br />
H<br />
( )-sc-n-Butan<br />
Optische Rotationsdispersion (ORD). – Abhängigkeit des spezifischen<br />
Drehwerts einer chiralen Verbindung von der Wellenlänge. Bei Auftreten<br />
eines Absorptionsmaximums unterscheidet man zwischen ORD-Kurven<br />
mit positivem und negativem Cotton-Effekt. ORD-Kurven zweier<br />
Enantiomere sind dabei spiegelbildlich gleich.<br />
Pitzer-Spannung. – Drehspannung, die auftritt durch Abweichung der<br />
Torsionswinkel von der energetisch günstigsten gestaffelten<br />
Konformation einer Verbindung.<br />
Planare Chiralität. – Tritt auf bei<br />
planaren bzw. ebenen Molekülfragmenten,<br />
die mindestens einen<br />
Substituenten tragen, der aus der Ebene<br />
herausragt und aus sterischen Gründen<br />
nicht durch Rotation um<br />
Einfachbindungen die Seite der Ebene zu<br />
wechseln in der Lage ist.<br />
H 2<br />
C<br />
(CH 2 ) 6<br />
CH 2<br />
sc<br />
ac<br />
Leitatom<br />
Polarimetrie. – Messverfahren zur Bestimmung der optischen Aktivität<br />
einer chiralen Verbindung mit Hilfe eines Polarimeters (s. spez.<br />
Drehwert).<br />
R
Seminar: Stereochemie – Handout (Definitionen stereochemischer Begriffe) Stark et al. (Angaben ohne Gewähr) 2<br />
Prochiralität. – Liegt<br />
vor, wenn ein<br />
achirales Zentrum<br />
einer Verbindung<br />
durch einen einzigen<br />
Reaktionsschritt in<br />
ein Chiralitätszentrum<br />
umwandelbar ist.<br />
Dabei spricht man bei sp 3 -hybridisierten Zentralatomen von<br />
heterotopen Liganden (pro-R bzw. pro-S) und bei sp 2 -hybridisierten<br />
Zentralatomen von heterotopen Seiten (Re bzw. Si).<br />
Re<br />
b<br />
a<br />
O<br />
c<br />
Acetophenon<br />
(achiral)<br />
pro-R/pro-S. – Stereodeskriptoren zur<br />
Beschreibung heterotoper Liganden<br />
prochiraler Verbindungen (s.<br />
Prochiralität).<br />
H<br />
Si<br />
CH 3<br />
H<br />
LiAlH 4<br />
b<br />
F<br />
a Cl<br />
H H B<br />
A<br />
c<br />
Pseudochiralität. – Tritt auf bei<br />
Kohlenstoffatomen, die zwei konstitutionell<br />
unterschiedliche und zwei konstitutionell gleiche<br />
asymmetrische, aber entgegengesetzt konfigurierte<br />
<strong>Gruppen</strong> tragen und wird mit r bzw. s gekennzeichnet.<br />
H<br />
(ap)-n-Butan<br />
H<br />
HO<br />
COOH<br />
HO<br />
S<br />
H<br />
HO<br />
r<br />
H<br />
HO<br />
R<br />
H<br />
COOH<br />
CH 3<br />
CH H<br />
3<br />
H<br />
H<br />
a<br />
H<br />
(S)-1-Phenylethanol<br />
(chiral)<br />
( H A pro-R )<br />
(H B pro-S)<br />
Racemisches Gemisch ( = Konglomerat). – Vorliegen<br />
Ribarsäure<br />
zweier Enantiomerer im Gemisch, wobei jedoch (-)- und<br />
(+)- Enantiomere in getrennten Kristallen vorliegen. Da es sich um<br />
ein eutektisches Gemisch handelt, ist der Schmelzpunkt meist<br />
niedriger als bei den reinen Enantiomeren.<br />
Racemat. –Äquimolares Gemisch zweier Enantiomerer; zeigt keine<br />
optische Aktivität.<br />
Reeves-Schreibweise. – Beispiel: -D-Glucose<br />
Re/Si. – Stereodeskriptoren zur Beschreibung<br />
heterotoper Seiten prochiraler Verbindungen (s.<br />
Prochiralität).<br />
Retention. – Konfigurationserhalt einer chiralen Verbindung im<br />
Verlauf einer chemischen Reaktion. (Bsp.: S Ni-Reaktion).<br />
Sägebock-Schreibweise. – Perspektivische<br />
Darstellung einer Verbindung an zwei<br />
be<strong>nach</strong>barten Atomen zur Verdeutlichung<br />
<strong>ihrer</strong> Konformation (s. Konformationsisomere).<br />
H<br />
H O<br />
O<br />
CH 3<br />
e<br />
H<br />
(sp)-n-Butan<br />
s-cis/s-trans (= cisoid/transoid). – Stereodeskriptoren zur<br />
Beschreibung der cis/trans-Isomerie an<br />
Einfachbindungen mit partiellem<br />
Doppelbindungscharakter (bei konjugierten<br />
s-cis s-trans<br />
Doppelbindungssytemen, Bsp.: 1,3-Butadien)<br />
Sessel-Konformation. – Die energetisch<br />
günstigste Konformation des Cyclohexans<br />
bezeichnet man als Sessel-Konformation (a =<br />
axialer Substituent, e = äquatorialer Substituent).<br />
Spezifischer Drehwert. – Charakteristische<br />
Stoffkonstante, die sich <strong>nach</strong> folgender mathematischer Gleichung<br />
<strong>nach</strong> polarimetrischer Bestimmung des Drehwertes einer 1%-igen<br />
Lösung in einer 10 cm langen Küvette mit der Natrium D-Linie (289<br />
nm) als monochromatische Lichtquelle bei 20˚C berechnen lässt:<br />
l (c in g/l und l in dm)<br />
Stereoisomere. – Verbindungen gleicher Konstitution, aber<br />
verschiedener Anordnung der Atome im Raum.<br />
Stereoselektiv. – Reaktionen, bei denen ausschließlich oder<br />
bevorzugt ein Stereoisomer unter mehreren möglichen Stoffen<br />
gebildet oder umgesetzt wird.<br />
Stereospezifisch. – Reaktionen, bei denenvon zwei (oder mehreren)<br />
Stereoisomeren eines ausschließlich gebildet oder umgesetzt werden.<br />
(z.B. S N2-Reaktion)<br />
Symmetrieachse (C n). – Eine n-zählige Symmetrieachse liegt vor,<br />
wenn durch Drehung um 360/n um diese Achse eine identische<br />
Anordnung aller Atome des Moleküls resultiert (Bsp.: C 3-Achse<br />
beim CHCl 3-Molekül).<br />
Symmetrieebene (). – Eine durch das Molekül gelegte<br />
Symmetrieebene teilt das Molekül in zwei spiegelbildliche<br />
Hälften (Bsp.: H 2O-Molekül).<br />
Cl<br />
OH<br />
O<br />
OH<br />
OH<br />
H<br />
C 3<br />
Cl Cl<br />
vorkommen können. Symmetrieelemente 2. Art sind Symmetrieebenen<br />
(), Symmetriezentren (i) und Drehspiegelachsen (S n) und stellen<br />
Merkmale achiraler Moleküle dar.<br />
Symmetrieoperation. – Drehung, Spiegelung, Inversion,<br />
Drehspiegelung.<br />
Symmetriezentrum (i). – Ein Symmetriezentrum liegt vor, wenn jedes<br />
Atom eines Moleküls durch Spiegelung am Molekülzentrum mit einem<br />
korrespondierenden Atom zur Deckung gebracht werden kann (Bsp.:<br />
meso-Weinsäure in gestaffelter Konformation).<br />
syn-/anti-. – Stereodeskriptoren zur Beschreibung<br />
der relativen Konfiguration bicyclischer<br />
Verbindungen . Syn- bzw. anti-stellig bedeuted<br />
zum niedriger bzw. höher bezifferten Zweig des<br />
Hauptringes weisend (s. endo/exo).<br />
R<br />
HO COOH<br />
H<br />
+ i<br />
H<br />
HOOC OH<br />
S<br />
Tautomere. – Konstitutionsisomere, die sich lediglich in der Stellung<br />
eines oder mehrerer Protonen unterscheiden.<br />
Topizität. – Beschreibt die topographische Beziehung zwischen<br />
identischen <strong>Gruppen</strong> oder Atomen innerhalb eines Moleküls. Man<br />
unterscheidet homotope von heterotopen <strong>Gruppen</strong>, wobei letztere in<br />
stereotope (enantiotope und diastereotope) sowie konstitutope <strong>Gruppen</strong><br />
untergliedert werden können. Die Substitution<br />
homotoper <strong>Gruppen</strong> führt zu identischen Produkten,<br />
wohingegen die Substitution enantiotoper bzw.<br />
diastereotoper <strong>Gruppen</strong> zu Enantiomeren bzw.<br />
Diastereomeren führt (s. Prochiralität).<br />
Wannen-Konformation. – Energiereichere Konformation des<br />
Cyclohexans (auch Boot-Konformation genannt)(a = axialer Substituent,<br />
e = äquatorialer Substituent).<br />
Zentrale Chiralität. – Tritt auf bei vierbindigen Atomen mit<br />
tetraedischer sowie bei dreibindigen Atomen mit pyramidaler Struktur,<br />
wenn sie vier bzw. drei verschiedene Liganden und ein nichtbindendes<br />
Elektronenpaar aufweisen (s. CIP-Nomenklatur).<br />
a<br />
e<br />
Symmetrieelemente. – Unter Symmetrieelemente 1.<br />
Art fallen Drehachsen C n (n = 1,2,3...) , die als einziges<br />
Symmetrieelement auch in chiralen Verbindungen<br />
O<br />
H H
Seminar: Stereochemie – Handout (Stereochemie der Zucker) Stark et al. (Angaben ohne Gewähr)<br />
3<br />
Stereochemie der Zucker<br />
Fischer-Projektionsformeln von D-Ketosen<br />
Fischer-Projektionsformeln von D-Aldosen<br />
D-Ketotetrose<br />
D-Aldotriose<br />
D-Glycerinaldehyd<br />
D-Aldotetrosen<br />
D-Erythrulose<br />
D-Ketopentosen<br />
D-Erythrose<br />
D-Aldopentosen<br />
D-Xylulose<br />
D-Ribulose<br />
D-Ketohexosen<br />
D-Aldohexosen<br />
D-Tagatose D-Psicose D-Sorbose D-Fructose 1) H<br />
H<br />
HO<br />
HO<br />
HO<br />
H<br />
H<br />
CH 2OH<br />
O<br />
CH 2OH<br />
CH 2OH<br />
OH<br />
CH 2OH<br />
O<br />
H<br />
CH 2OH<br />
O<br />
H<br />
H<br />
CH 2OH<br />
OH<br />
OH<br />
H<br />
H<br />
H<br />
CH 2OH<br />
O<br />
CH 2OH<br />
OH<br />
OH<br />
OH<br />
H<br />
H<br />
CH 2OH<br />
O<br />
CH 2OH<br />
OH<br />
OH<br />
H<br />
HO<br />
H<br />
CH 2OH<br />
O<br />
OH<br />
H<br />
CH 2OH<br />
OH<br />
HO<br />
H<br />
H<br />
CH 2OH<br />
O<br />
H<br />
CH 2OH<br />
OH<br />
OH<br />
H<br />
H<br />
H<br />
CHO<br />
CH 2OH<br />
OH<br />
OH<br />
OH<br />
H<br />
H<br />
HO<br />
H<br />
H<br />
CHO<br />
CH 2OH<br />
CHO<br />
OH<br />
OH<br />
H<br />
CH 2OH<br />
OH<br />
OH<br />
H<br />
CHO<br />
CH 2OH<br />
OH<br />
HO<br />
H<br />
CHO<br />
H<br />
CH 2OH<br />
OH<br />
D-Threose<br />
H<br />
HO<br />
H<br />
CHO<br />
OH<br />
H<br />
CH 2OH<br />
D-Ribose D-Arabinose D-Xylose D-Lyxose<br />
HO<br />
HO<br />
CHO<br />
H<br />
H<br />
H<br />
HO<br />
CHO<br />
OH<br />
H<br />
HO<br />
CHO<br />
OH<br />
OH<br />
H<br />
HO<br />
HO<br />
H<br />
HO<br />
HO<br />
CHO<br />
H<br />
H<br />
CH 2OH<br />
CHO<br />
H<br />
H<br />
OH<br />
Fructose Halbacetalschluß (Ketohexose)<br />
CH 2OH<br />
HO<br />
HO H<br />
O<br />
H OH<br />
H<br />
CH 2OH<br />
CH 2OH<br />
HO<br />
OH<br />
O<br />
HO<br />
OH<br />
OH<br />
-Fructofuranose<br />
HO<br />
OH<br />
O HO<br />
OH<br />
OH<br />
-Fructofuranose<br />
H OH<br />
H OH<br />
H OH<br />
H OH<br />
CH 2OH<br />
CH 2OH<br />
HO H<br />
H OH<br />
CH 2OH<br />
HO H<br />
H OH<br />
CH 2OH<br />
D-Mannose 1) D-Glucose (ta-tü-ta-ta) 1) D-Galactose D-Talose 3)<br />
CHO<br />
HO H<br />
H OH<br />
H OH<br />
H OH<br />
CH 2OH<br />
CHO<br />
H OH<br />
H OH<br />
H OH<br />
H OH<br />
CH 2OH<br />
CHO<br />
CHO<br />
HO H<br />
H OH<br />
H OH<br />
H OH<br />
HO H<br />
HO H<br />
H OH<br />
H OH<br />
CH 2OH<br />
CH 2OH<br />
D-Altrose 2) D-Allose 2) D-Idose D-Gulose 3)<br />
Bsp.: 1) 3)<br />
bilden dasselbe Osazon mit Phenylhydrazin D-Talose und D-Gulose sind<br />
2)<br />
Diastereomere D-Altrose und D-Allose sind Epimere (Diastereomere)<br />
HO<br />
C<br />
HO C<br />
H C<br />
H C<br />
H 2C<br />
H<br />
OH<br />
OH<br />
O<br />
O OH<br />
OH<br />
OH<br />
OH<br />
OH<br />
-Fructopyranose<br />
OH<br />
O<br />
OH<br />
OH<br />
OH<br />
OH<br />
-Fructopyranose<br />
D-Glucose: cyclisches Halbacetals (Aldohexose)<br />
Fischer-Projektionsformel (senkrecht gezeichnete Bindungen zeigen <strong>nach</strong> hinten,<br />
in der Fischer-Projektionsformel rechtsliegende Substituenten zeigen in der<br />
Haworth-Formel <strong>nach</strong> unten, die links liegenden zeigen <strong>nach</strong> oben)<br />
CHO<br />
R<br />
H<br />
OH<br />
D-Galactopyranose in Haworth und Reeves-Formel<br />
Haworth-Schreibweise<br />
CH 2OH<br />
CH 2OH<br />
OH O OH<br />
OH O<br />
OH<br />
OH<br />
OH<br />
OH<br />
OH<br />
S<br />
R<br />
R<br />
HO<br />
H<br />
H<br />
H<br />
CH 2OH<br />
OH<br />
OH<br />
HO<br />
HO<br />
H<br />
H<br />
H<br />
OH<br />
H<br />
OH<br />
H<br />
O<br />
CH 2OH<br />
OH<br />
OH<br />
OH<br />
CH 2 OH<br />
D-(+)-Glucose<br />
„Substituentenvertauschung“<br />
absolute Konfiguration am C5 am C4<br />
OH<br />
O<br />
H<br />
H<br />
HO<br />
HO<br />
H<br />
CHO<br />
OH<br />
H<br />
H<br />
OH<br />
HO<br />
H<br />
HO<br />
H<br />
HOH 2C<br />
H C<br />
C<br />
C<br />
C<br />
C<br />
OH<br />
H<br />
OH<br />
OH<br />
O<br />
OH<br />
CH 2 OH<br />
O<br />
OH<br />
OH<br />
OH<br />
OH<br />
CH 2 OH<br />
OH<br />
OH<br />
OH<br />
O<br />
H<br />
CH 2OH<br />
-Glucopyranose<br />
OH<br />
OH<br />
H<br />
O<br />
H<br />
OH<br />
H<br />
OH<br />
H<br />
-Galactopyranose<br />
C1 zu C5 cis<br />
Reeves-Schreibweise<br />
OH<br />
OH<br />
OH<br />
H<br />
OH<br />
H<br />
H<br />
O<br />
H<br />
OH<br />
OH<br />
-Galactopyranose<br />
trans<br />
H<br />
HO C<br />
H C OH<br />
HO C H<br />
H C<br />
HOH 2C CHOH<br />
Fischer<br />
O<br />
HO<br />
CH 2 OH<br />
OH<br />
O<br />
OH<br />
OH<br />
- Glucofuranose<br />
(weniger stabil)<br />
Haworth<br />
CH 2 OH<br />
OH<br />
HO<br />
OH<br />
OH<br />
H<br />
O
Seminar: Stereochemie – Handout (Stereochemie der Zucker) Stark et al. (Angaben ohne Gewähr)<br />
4<br />
Mutarotation der D-Glucopyranose<br />
-D-Glucopyranose Reeves-Schreibweise<br />
CH 2 OH<br />
R<br />
O<br />
R<br />
OH<br />
S<br />
OH<br />
OH<br />
R<br />
S<br />
OH<br />
H 3 O +<br />
OH<br />
CH 2 OH<br />
OH<br />
OH<br />
OH<br />
O<br />
H<br />
H +<br />
H 3 O +<br />
CH 2 OH<br />
R<br />
O OH<br />
R<br />
OH<br />
R<br />
HO<br />
R<br />
S<br />
OH<br />
-Glucopyranose<br />
-Glucopyranose<br />
wässriges Gleichgewicht:<br />
36 % 64%<br />
OH<br />
4<br />
O<br />
OH<br />
1<br />
OH<br />
OH<br />
OH<br />
stabile, all-equatorial<br />
substituierte<br />
4 C 1-Konformation<br />
HO<br />
OH<br />
OH<br />
1<br />
O<br />
4<br />
OH<br />
OH<br />
nicht existente,all-axial<br />
substituierte<br />
1 C 4-Konformation<br />
Disaccharide<br />
Reduzierende:<br />
HO<br />
R<br />
A<br />
O<br />
OH<br />
HO<br />
R<br />
O<br />
B<br />
OH<br />
HO<br />
R<br />
A<br />
O<br />
O<br />
R<br />
B<br />
O<br />
OH<br />
R R R R<br />
R<br />
R<br />
R<br />
R<br />
Halbacetal alkohol. OH Acetal Halbacetal<br />
(- oder -Glycosid)<br />
Nicht reduzierende:<br />
OH<br />
OH<br />
HO<br />
R<br />
A<br />
O<br />
O<br />
O<br />
B<br />
R<br />
OH<br />
HO<br />
O<br />
O<br />
OH<br />
OH<br />
O<br />
OH<br />
OH<br />
HO<br />
O<br />
O<br />
OH OH<br />
O<br />
OH<br />
OH<br />
R<br />
R<br />
R<br />
R<br />
Acetal (- oder -Glycosid)<br />
HO<br />
O<br />
O<br />
OH<br />
HO<br />
O OH<br />
OH<br />
OH HO<br />
HO<br />
-Glykosid<br />
Trehalose (in Insekten, Mikroorganismen)<br />
-D-Glucopyranosyl--D-glucopyranosid<br />
-Glc(1 1) -Glc<br />
OH<br />
HO<br />
-Glykosid, Saccharose (Rohrz.,<br />
<strong>nach</strong> Hydrolyse Invertzucker)<br />
-D-Glucopyranosyl--Dfructofuranosid,-Glc(1<br />
2) -Fru<br />
OH<br />
OH<br />
OH<br />
O<br />
OH<br />
HO<br />
O<br />
OH<br />
O<br />
OH<br />
-Glycosid<br />
Lactose (Milchzucker)<br />
4-O-(-D-Galactopyranosyl)-Dglucopyranose<br />
-Gal(1 4)Glc, gestreckt<br />
OH<br />
OH<br />
HO<br />
-Glykosid, Maltose<br />
(Malzzucker, in Stärke, Glycogen)<br />
[4-O-(-D-Glucopyranosyl)-Dglucopyranose<br />
-Glc(1 4)Glc, gewinkelt<br />
OH<br />
OH<br />
OH<br />
O<br />
OH<br />
HO<br />
O<br />
OH<br />
-Glycosid<br />
Cellobiose (in Cellulose)<br />
4-O-(-D-Glucopyranosyl)-<br />
D-glucopyranose<br />
-Glc(1 4)Glc, gestreckt<br />
O<br />
OH<br />
OH<br />
<strong>Wichtige</strong> Polysaccharide<br />
Stärke (Ausschnitt) aus Amylose (20%) und Amylopektin (80%) Cellulose (Ausschnitt) :<br />
Amylose: unverzweigte Amylopektin: 1 6-glucosidisch verzweigte -1,4-glycosidisch verknüpfte<br />
-(1 4)-Glucosid-Ketten: -(1 4)-Glucosid-Ketten: Glucopyranose (Cellubiose)<br />
n<br />
OH<br />
OH<br />
OH<br />
OH<br />
OH<br />
*<br />
OH<br />
O<br />
OH<br />
O<br />
O<br />
HO<br />
*<br />
O<br />
OH<br />
O<br />
OH<br />
O<br />
OH<br />
OH<br />
O<br />
OH<br />
O<br />
OH<br />
OH<br />
O<br />
OH<br />
O<br />
*<br />
n<br />
*<br />
O<br />
OH<br />
OH<br />
O OH<br />
O<br />
OH<br />
OH<br />
O OH O<br />
OH<br />
OH<br />
O<br />
O<br />
OH<br />
OH<br />
O<br />
OH<br />
O<br />
OH<br />
O<br />
O<br />
OH<br />
O<br />
*<br />
n<br />
OH<br />
OH<br />
OH<br />
O<br />
O<br />
*<br />
O