Tema2.MaterialesCERAMICOS.Enlace.ATOMICO.2008.ppt
Tema2.MaterialesCERAMICOS.Enlace.ATOMICO.2008.ppt
Tema2.MaterialesCERAMICOS.Enlace.ATOMICO.2008.ppt
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
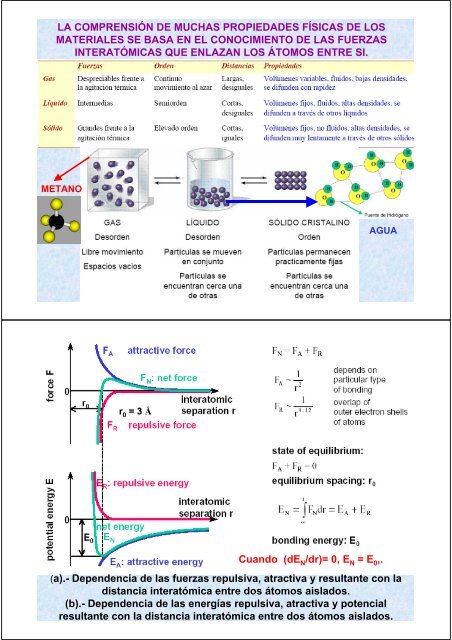
LA COMPRENSIÓN DE MUCHAS PROPIEDADES FÍSICAS DE LOS<br />
MATERIALES SE BASA EN EL CONOCIMIENTO DE LAS FUERZAS<br />
INTERATÓMICAS QUE ENLAZAN LOS ÁTOMOS ENTRE SI.<br />
METANO<br />
AGUA<br />
r 0<br />
= 3 Å<br />
Cuando (dE N /dr)= 0, E N = E 0 ,.<br />
(a).- Dependencia de las fuerzas repulsiva, atractiva y resultante con la<br />
distancia interatómica entre dos átomos aislados.<br />
(b).- Dependencia de las energías repulsiva, atractiva y potencial<br />
resultante con la distancia interatómica entre dos átomos aislados.
Fuerzas<br />
resultante en<br />
función de la<br />
distancia<br />
interatómica<br />
para un enlace<br />
débil y fuerte.<br />
EL MÓDULO DE YOUNG, E, SE PUEDE CORRELACIONAR<br />
CON LA CURVA FUERZA-DISTANCIA. UN ENLACE FUERTE<br />
RESULTA EN UN MÓDULO ALTO, QUE SE TRADUCE EN<br />
UNA PENDIENTE ELEVADA DE LA CURVA ANTERIOR EN<br />
SU PUNTO DE INTERSECCIÓN CON EL EJE OR, ES DECIR:<br />
E<br />
⎛<br />
∝ ⎜<br />
⎝<br />
dF ⎞<br />
⎟<br />
dr ⎠ =<br />
r ro
1.- ¿POR QUÉ ALGUNOS ÁTOMOS SE ENGANCHAN PARA FORMAR<br />
MOLÉCULAS, MIENTRAS QUE OTROS NO LO HACEN?. POR EJEMPLO,<br />
DOS ÁTOMOS DE HIDRÓGENO SE COMBINAN DANDO H 2 , PERO EL<br />
HELIO NO SE COMBINA DANDO UNA MOLÉCULA DEL TIPO He 2<br />
ESTABLE.<br />
2.- ¿POR QUÉ EN LAS MOLÉCULAS SE ENCUENTRAN SOLAMENTE<br />
DETERMINADAS COMBINACIONES DE ÁTOMOS? ES DECIR, ¿POR QUÉ<br />
SE ENCUENTRA H 2 , Y NO H 3 ?<br />
3.- ¿POR QUÉ TOMAN LAS MOLÉCULAS UNA FORMA DETERMINADA? .<br />
POR EJEMPLO, LOS ÁTOMOS DE OXÍGENO Y CARBONO TOMAN LA<br />
DISPOSICIÓN LINEAL EN EL CO 2 , MIENTRAS QUE LOS DE OXÍGENO E<br />
HIDRÓGENO EN EL H 2 O TOMAN UNA DISPOSICIÓN TRIGONAL.<br />
Tabla 2.1 .- TIPOS DE ENLACES PRIMARIO<br />
IÓNICO<br />
COVALENTE<br />
METÁLICO<br />
TIPO DE<br />
ELEMENTO<br />
METAL<br />
NO METAL<br />
NO METAL<br />
NO METAL<br />
METAL<br />
METAL<br />
ELECTRONES<br />
M cede e-<br />
N capta e-<br />
M y N<br />
Comparten e-<br />
M cede e-<br />
Nube de e-<br />
FORMACIÓN DE<br />
IÓNES<br />
M ----catión<br />
N---- anión<br />
NO<br />
M---- catión<br />
RESULTADO<br />
CRISTAL<br />
Fuerza<br />
Electrostática.<br />
MOLÉCULA<br />
CRISTAL<br />
Los elementos He, Ne, Ar, Kr, Xe y Rn tienen la capa de electrones más<br />
externa completa y asi son muy estables y no forman enlaces con<br />
facilidad con otros elementos. Por su parte, los elementos que no tienen<br />
la capa de electrones más externa completa no son estables e<br />
interaccionan, de manera controlada, con otros átomos de tal modo que<br />
los electrones son compartidos o intercambiados entre dichos átomos<br />
CON EL FIN DE LOGRAR CAPAS DE ELECTRONES MÁS EXTERNAS<br />
ESTABLES.
ENLACE IONICO<br />
EL ENLACE IÓNICO ES EL MÁS FÁCIL DE DESCRIBIR Y DE VISUALIZAR Y<br />
SIEMPRE EXISTE EN COMPUESTOS FORMADOS POR<br />
ELEMENTOS METÁLICOS Y NO METÁLICOS (UNIÓN METAL – NO<br />
METAL), O SEA, ENTRE ELEMENTOS SITUADOS EN LOS EXTREMOS<br />
HORIZONTALES DE LA TABLA PERIÓDICA, ES DECIR, ESTE ENLACE SE<br />
FORMA CUANDO<br />
LA DIFERENCIA DE ELECTRONEGATIVIDAD ENTRE LOS DOS<br />
ELEMENTOS ES MUY GRANDE.<br />
EL ELEMENTO MÁS ELECTRONEGATIVO SE LLEVA AL ELECTRÓN (ATOMO<br />
ACEPTOR) Y EL MENOS ELECTRONEGATIVO LO PIERDE (ATOMO DONOR).<br />
PARA QUE SE FORME ENLACE IÓNICO LA DIFERENCIA DE<br />
ELECTRONEGATIVIDADES DEBE SER IGUAL O MAYOR QUE 1.7 – 1.8 .<br />
LOS ÁTOMOS DEL ELEMENTO METÁLICO DAN FÁCILMENTE SUS ELECTRONES<br />
DE VALENCIA A ÁTOMOS DE UN NO METAL, QUE ES, A SU VEZ, UN BUEN<br />
ACEPTOR DE ELECTRONES.<br />
EN ESTE PROCESO TODOS LOS ÁTOMOS ADQUIEREN LA<br />
CONFIGURACIÓN ESTABLE DEL GAS INERTE, PARA ELLO SE HAN DE<br />
IONIZAR, CARGÁNDOSE ELÉCTRICAMENTE.<br />
Electronegatividades de los elementos
F<br />
a<br />
() r =<br />
ZZe<br />
1 2<br />
4πε<br />
r<br />
0<br />
2<br />
2
r<br />
C<br />
A<br />
r<br />
Na+<br />
0.99<br />
= = =<br />
r 1.81<br />
Cl−<br />
Número de<br />
coordinación = 6,<br />
OCTAEDRICA<br />
0.547<br />
LOS COMPUESTOS IÓNICOS NO FORMAN MOLÉCULAS AISLADAS, POR<br />
LO QUE SUS FÓRMULAS SON SIEMPRE FÓRMULAS EMPÍRICAS.<br />
LAS SUSTANCIAS IÓNICAS SÓLIDAS FORMAN ESTRUCTURAS<br />
CRISTALINAS O REDES CRISTALINAS TRIDIMENSIONALES<br />
COMPACTAS, CON UN ORDENAMIENTO EN EL QUE SE ALTERNAN<br />
IONES POSITIVOS Y NEGATIVOS EN LAS TRES DIMENSIONES DEL<br />
ESPACIO CON UN NUMERO DE COORDINACIÓN MÁXIMO.<br />
SE LLAMA ÍNDICE DE COORDINACIÓN DE UN ION EN LA RED, AL<br />
NÚMERO DE IONES DE SIGNO CONTRARIO QUE LO RODEAN A LA<br />
MISMA DISTANCIA.<br />
EL TAMAÑO DE LOS IONES (RELACIÓN ENTRE EL RADIO<br />
DEL CATIÓN Y EL DEL ANIÓN) Y SUS CARGAS<br />
DETERMINARÁN LOS DISTINTOS TIPOS DE<br />
ORDENAMIENTO.
HAY DOS CARACTERÍSTICAS DE LOS IONES QUE DETERMINAN LA<br />
ESTRUCTURA CRISTALINA DE LOS COMPUESTOS ENLAZADOS<br />
IONICAMENTE:<br />
1.- EL VALOR DE LA CARGA ELÉCTRICA DE LOS IONES<br />
COMPONENTES. NÚMERO DE ÁTOMOS DE CADA<br />
ELEMENTO NECESARIOS PARA MANTENER LA<br />
NEUTRALIDAD ELÉCTRICA<br />
2.- LOS TAMAÑOS RELATIVOS DE LOS CATIONES Y<br />
ANIONES. LOS RADIOS IÓNICOS PUEDEN VARIAR<br />
LIGERAMENTE DEPENDIENDO DEL NÚMERO Y TIPO DE<br />
LOS IONES CON CARGA OPUESTA QUE LOS RODEAN.<br />
Configuraciones estables e inestables de la coordinación<br />
entre aniones y cationes.<br />
CADA CATIÓN PREFIERE TENER A SU ALREDEDOR<br />
TANTOS ANIONES VECINOS MAS PRÓXIMOS COMO SEA<br />
POSIBLE.<br />
LOS ANIONES TAMBIÉN DESEAN UN NÚMERO MÁXIMO DE<br />
CATIONES COMO VECINOS MÁS PRÓXIMOS.
COORDINACIÓN ADOPTADA POR LOS CATIONES EN FUNCIÓN DE<br />
LA RELACIÓN DE RADIOS<br />
Números y geometrías de<br />
coordinación para varios<br />
cocientes entre los radios<br />
del catión y del anión.
ESTRUCTURAS CRISTALINAS IÓNICASI<br />
NICAS.<br />
Los iones monovalentes del Grupo IA (Li, Na, K, Rb, Cs,<br />
Fr) y del Grupo VIIA ( F, Cl, Br, I ) forman compuestos que<br />
son altamente iónicos, pero tienen una resistencia<br />
relativamente baja, puntos de fusión bajos y poca dureza.<br />
Sin embargo, los compuestos iónicos formados a partir de<br />
iones de mayor carga, como por ejemplo el Mg 2+ , Al 3+ y Zr 4+ ,<br />
poseen un enlace fuerte y, por consiguiente, tienen una<br />
resistencia alta, puntos de fusión altos y gran dureza<br />
PROPIEDADES DE LOS SÓLIDOS IÓNICOS.<br />
1.- Hay un elemento donor de electrones y otro aceptor, para lograr la<br />
neutralidad eléctrica.<br />
2.- Tienen estructura cristalina y son sólidos, pues el enlace es fuerte. La<br />
magnitud del enlace iónico es igual en todas las direcciones alrededor de<br />
un ión y se denomina no direccional. El enlace esta asociado con las<br />
capas electrónicas s, las cuales tienen una distribución de probabilidad<br />
esférica.<br />
Para que un material iónico sea estable es necesario que todos los iones<br />
positivos tengan como vecinos más próximos, en un esquema<br />
tridimensional, iones cargados negativamente, y viceversa. La estructura<br />
está determinada por el tamaño de los átomos o iones y de su carga, con<br />
una tendencia a formar las estructuras más compactas permitidas<br />
3.- <strong>Enlace</strong> fuerte. Las energías de enlace suelen valer de 600 a 1500<br />
kJ/mol (de 3 a 8 eV x átomo) y esta elevada cuantía se refleja en las altas<br />
temperaturas de fusión. La resistencia del enlace aumenta cuando lo<br />
hace la carga de los iones. Así, muchos óxidos compuestos de iones con<br />
carga múltiple son duros y funden a altas temperatura (Al2O3, ZrO2,<br />
Y2O3), pues la atracción electrostática será mayor.
PROPIEDADES DE LOS SÓLIDOS IÓNICOS.<br />
4.- Conductividad eléctrica: Los compuestos con enlace iónico en estado<br />
sólido no conducen la corriente eléctrica debido a que los iones están<br />
demasiado juntos. Al fundir estas sales los iones se separan y pueden<br />
moverse dentro de un campo eléctrico y por lo tanto conducen la<br />
corriente eléctrica en solución (Conductividad ionica a alta temperatura)<br />
5.- Térmicamente son aislantes (Son malos conductores del calor)<br />
6.- Solubilidad: Son solubles en disolventes polares debido a que sus<br />
iones se separan por atracciones electrostáticas entre las cargas de los<br />
iones y las cargas parciales del disolvente polar formándose lo que se<br />
llama "esfera de solvatación" que recibe el nombre de esfera de<br />
hidratación cuando el disolvente es el agua. Na+(aq) Cl-(aq)<br />
Por este estudio se puede llegar a la conclusión de que, debido a las<br />
grandes fuerzas de cristal, los cristales iónicos deben ser relativamente<br />
insolubles. Esto es así en el caso de los disolventes no polares, tales<br />
como el benceno; pero los compuestos iónicos son solubles, en grados<br />
diversos, en disolventes polares como el etanol, y pueden ser<br />
extremadamente solubles en los líquidos muy polares, como el agua.<br />
PROPIEDADES DE LOS SÓLIDOS IÓNICOS.<br />
7.- Puntos de fusión y puntos de ebullición: Son valores altos debido a<br />
que la energía de atracción en el cristal es alta y habrá que suministrar<br />
por ejemplo energía calorífica suficiente para vencer estas fuerzas de<br />
atracción.<br />
8.- Son materiales transparentes a la radiación visible.<br />
9.- Absorben la radiación infrarroja<br />
10.- Otras propiedades debidas al enlace iónico son la dureza provocada<br />
por lo compacto del cristal y son quebradizos (fragilidad debido a su<br />
sistema cristalino).
ENLACE COVALENTE.<br />
EN 1916, LEWIS PROPUSO QUE LA FORMACIÓN DE UN ENLACE<br />
COVALENTE SE PRODUCE POR LA COMPARTICIÓN DE DOS<br />
ELECTRONES ENTRE ÁTOMOS VECINOS Y NINGUNO DE LOS<br />
ÁTOMOS:<br />
- TIENE SUFICIENTEMENTE POCA ENERGÍA EN SU CAPA DE<br />
VALENCIA COMO PARA PERDER SUS ELECTRONES<br />
- ES SUFICIENTEMENTE ATRACTIVO PARA QUITARLE AL OTRO SUS<br />
ELECTRONES<br />
POR TANTO, TENDRÁN QUE COMPARTIR SUS ELECTRONES. EL<br />
CASO MÁS TÍPICO ES EL DE DOS ÁTOMOS DEL MISMO ELEMENTO<br />
ENLACE COVALENTE.<br />
DEPENDIENDO DE SU CAPA DE VALENCIA DOS ÁTOMOS PUEDEN<br />
FORMAR UN ENLACE SIMPLE, COMPARTIENDO UN SOLO PAR<br />
DE ELECTRONES (ENLACE COVALENTE SENCILLO), O<br />
ENLACES MÚLTIPLES (DOBLE, TRIPLE, ETC.),<br />
COMPARTIENDO DOS O MÁS PARES.<br />
EL NÚMERO DE PARES ELECTRÓNICOS COMPARTIDOS SE<br />
LLAMA ORDEN O MULTIPLICIDAD DE ENLACE.<br />
..<br />
..<br />
H<br />
H:O:H C::C H:C:::C:H<br />
Single<br />
Bonds<br />
H<br />
:<br />
:<br />
:<br />
:<br />
Double<br />
Bond<br />
H<br />
H<br />
Triple<br />
Bond<br />
H H<br />
H-O-H C=C H-C≡C-H<br />
H H
ENLACE COVALENTE.<br />
EN EL ENLACE COVALENTE LOS ELECTRONES COMPARTIDOS PERTENECEN<br />
POR IGUAL A LOS DOS ÁTOMOS QUE FORMAN EL ENLACE. ESTA<br />
CIRCUNSTANCIA PERMITE CONTABILIZAR A LOS ELECTRONES DE ENLACE<br />
TANTO EN UN ÁTOMO COMO EN EL OTRO, POR LO QUE CONTRIBUYEN A<br />
COMPLETAR LOS ELECTRONES DE LA CAPA DE VALENCIA HASTA<br />
ALCANZAR EL OCTETO, LO QUE DA GRAN ESTABILIDAD A CADA ÁTOMO EN<br />
LA MOLÉCULA.<br />
CADA PAR DE ELECTRONES COMUNES A DOS ÁTOMOS SE LLAMA DOBLETE<br />
ELECTRÓNICO, ESTE TIPO DE ENLACE SE ENCUENTRA EN TODAS LAS<br />
MOLÉCULAS CONSTITUIDAS POR ELEMENTOS NO METÁLICOS O<br />
COMBINACIONES BINARIAS QUE ESTOS ELEMENTOS FORMAN ENTRE SÍ,<br />
TALES COMO: HIDRUROS GASEOSOS Y EN LA MAYORÍA DE COMPUESTOS DE<br />
CARBONO.<br />
LOS ORBITALES DE LAS CAPAS DE VALENCIA DE AMBOS ÁTOMOS SE<br />
COMBINAN PARA FORMAR UNO SOLO QUE CONTIENE A LOS 2<br />
ELECTRONES.<br />
EL ENLACE COVALENTE OCURRE ENTRE NO METALES PORQUE LA<br />
DIFERENCIA DE ELECTRONEGATIVIDADES ENTRE LOS ÁTOMOS ES CERO O<br />
MUY PEQUEÑA.<br />
ENLACE COVALENTE.<br />
Muchas moléculas de elementos no metálicos (H 2 , Cl 2 , F 2 ,<br />
etc.), así como muchas moléculas que contienen átomos<br />
diferentes (CH 4 , H 2 O, HNO 3 , HF, etc.) tienen enlaces<br />
covalentes. Además, este tipo de enlace aparece en sólidos<br />
elementales, tales, como diamante (carbono), silicio,<br />
germanio, y en compuestos sólidos formados por elementos<br />
localizados a la derecha de la tabla periódica, tales como<br />
arseniuro de galio (GaAs), antimoniuro de iridio (IrSb) y<br />
carburo de silicio (SiC).<br />
Los enlaces covalentes pueden ser muy fuertes, como en el<br />
caso del diamante, que es un material muy duro y tiene una<br />
temperatura de fusión muy elevada, Tf > 3550°C (6400°F),<br />
pero también pueden ser muy débiles, como es el caso de los<br />
enlaces del bismuto, que funde a 270 °C (518°F).
ENLACE COVALENTE.<br />
El numero de enlaces covalentes posibles para un átomo<br />
particular de-pende del numero de electrones de valencia.<br />
Para N' electrones de valencia, un átomo puede enlazarse<br />
covalentemente, como máximo, con 8 - N' átomos.<br />
Por ejemplo, para el cloro N'= 7, y, por tanto, 8 - N'= 1, esto<br />
significa que un átomo de cloro puede enlazarse con un solo<br />
átomo, como en la molécula de Cl 2 .<br />
Análogamente, para el carbono N'= 4, por lo que 8 - N'= 4<br />
y así cada átomo de carbono tiene cuatro electrones para<br />
compartir.<br />
TEORÍA DE REPULSIÓN DE ELECTRONES DE VALENCIA (TREPEV)<br />
LA TEORÍA DE REPULSIÓN DE ELECTRONES DE VALENCIA (TREPEV),<br />
QUE SE BASA EN EL MODELO DE LEWIS QUE ESTABLECE QUE EN UN<br />
ÁTOMO LOS ELECTRONES FORMAN PARES QUE ESTAN<br />
COMPARTIDOS CON OTRO ÁTOMO O SOLITARIOS, ESTABLECE QUE:<br />
LOS PARES DE ELECTRONES SE REPELEN ENTRE SI, TANTO SI ESTAN<br />
EN ENLACES QUIMICOS (PARES ENLAZADOS) COMO SI NO ESTÁN<br />
COMPARTIDOS (PARES SOLITARIOS).<br />
LOS PARES DE ELECTRONES DE LA CAPA DE VALENCIA SE<br />
ENCUENTRAN<br />
ORDENADOS EN TORNO AL ÁTOMO CENTRAL<br />
DEL COMPUESTO CON ORIENTACIONES DE TAL MANERA QUE EXISTE<br />
LA MÁXIMA SEPARACIÓN ENTRE ELLOS Y POR CONSIGUIENTE LA<br />
MÍNIMA REPULSIÓN. LA POSICIÓN MÁS ESTABLE DE ESTOS PARES<br />
DE ELECTRONES DETERMINA LA GEOMETRÍA DE LA MOLÉCULA.
DISTRIBUCIÓN DE ELECTRONES ALREDEDOR DE UN ÁTOMO CENTRAL<br />
DISTRIBUCIÓN DE ELECTRONES ALREDEDOR DE UN ÁTOMO CENTRAL
DISTRIBUCIÓN DE LOS ÁTOMOS EN EL ESPACIO<br />
(GEOMETRÍA MOLECULAR).<br />
DISTRIBUCIÓN DE LOS ÁTOMOS EN EL ESPACIO<br />
(GEOMETRÍA MOLECULAR).
DISTRIBUCIÓN DE LOS ÁTOMOS EN EL ESPACIO<br />
(GEOMETRÍA MOLECULAR).
PARA CONSTRUIR UNA MOLÉCULA A PARTIR DE LA TEORÍA DE REPULSIÓN<br />
DE ELECTRONES DE VALENCIA SE PROCEDE DEL MODO SIGUIENTE:<br />
1. SE ESCRIBE LA ESTRUCTURA DE LEWIS PARA LA ESPECIE<br />
2.- SE DETERMINA EL NÚMERO DE GRUPOS DE ELECTRONES QUE HAY<br />
ALREDEDOR DEL ÁTOMO CENTRAL ESTABLECIENDO SI SON<br />
GRUPOS ENLAZANTES O PARES SOLITARIOS<br />
3.- SE ESTABLECE LA GEOMETRÍA DE GRUPOS DE ELECTRONES ALREDEDOR<br />
DEL ÁTOMO CENTRAL<br />
4.- SE DETERMINE LA GEOMETRÍA MOLECULAR DE LAS POSICIONES<br />
ALREDEDOR DEL ÁTOMO CENTRAL OCUPADAS POR OTROS NÚCLEOS<br />
ATÓMICOS<br />
Teoría de los orbitales moleculares (OM).<br />
Los enlaces se forman a partir de la interacción de orbitales atómicos para formar<br />
orbitales moleculares, los cuales pueden ser enlazantes o antienlazantes. Un<br />
orbital molecular enlazante tiene menos energía y mayor estabilidad que los<br />
orbitales atómicos que lo formaron. Un orbital molecular antienlazante tiene más<br />
energía y menor estabilidad que los orbitales atómicos que lo formaron.
ENLACE COVALENTE.<br />
Es la combinación de dos o más orbitales diferentes. Estas combinaciones<br />
forman orbitales híbridos. La formación de estos orbitales permite justificar los<br />
enlaces que presentan las moléculas. Los tipos de orbitales híbridos se dan en<br />
la tabla 3.2.2.3.1, en la que puede verse su composición y orientación.<br />
ENLACE COVALENTE.
.<br />
Geometría y<br />
formación de<br />
los orbitales<br />
sp 3
Geometría y<br />
formación de<br />
los orbitales<br />
sp 2
ENLACE COVALENTE.<br />
Promotion<br />
Note the single left over<br />
Unhybridized p orbital on B<br />
Region of overlap<br />
<strong>Enlace</strong> del trifluoruro de boro.<br />
ENLACE COVALENTE.
ENLACE COVALENTE.<br />
.<br />
Geometría y formación de los orbitales<br />
Teoría de orbitales moleculares (OM)<br />
Según la teoría de orbitales moleculares (OM), los enlaces<br />
covalentes de las moléculas se forman por solapamiento de<br />
orbitales atómicos, de manera que los nuevos orbitales<br />
moleculares pertenecen a la molécula entera y no a un<br />
átomo sólo.<br />
La geometría de una molécula depende de cada uno de los<br />
orbitales atómicos que participan en el solapamiento.
ENLACE COVALENTE / CARBONO<br />
ENLACE COVALENTE.<br />
EN EL DIAMANTE SE TIENE UNA ESTRUCTURA EN LA CUAL CADA ATOMO DE<br />
CARBONO SE UNE COVALENTEMENTE A OTROS 4 ÁTOMOS DE CARBONO EN<br />
UNA ORIENTACIÓN TETRAEDRICA<br />
EL CARBONO CENTRAL TIENE SUS 6 ELECTRONES INICIALES<br />
MÁS UN ELECTRÓN QUE COMPARTE CON CADA UNO DE LOS 4 CARBONOS<br />
ADYACENTES, DANDO COMO RESULTADO UN TOTAL DE 10 ELECTRONES.<br />
ESTO ES EQUIVALENTE A QUE SE LLENE SU CAPA MÁS EXTERNA Y SU<br />
ESTRUCTURA ELECTRÓNICA ES 1s 2 2s 2 2p 6 , QUE ES LA DEL NEÓN,<br />
PRESENTANDO UNAS CONDICIONES MUY ESTABLES.<br />
CADA UNO DE LOS 4 ATOMOS DE CARBONO EXTERNOS DEL TETRAEDRO<br />
ESTA ENLAZADO DIRECCIONALMENTE A TRES ÁTOMOS DE CARBONO<br />
ADICIONALES LO QUE DA LUGAR A UNA ESTRUCTURA TETRAEDRICA<br />
PERIODICA CON TODOS LOS ÁTOMOS DE LA ESTRUCTURA (EXCEPTO LA<br />
CAPA MÁS EXTERNA FINAL EN LA SUPERFICIE DEL CRISTAL) COMPARTIENDO<br />
4 ELECTRONES LOGRANDO CON ELLO LA ESTRUCTURA ELECTRONICA<br />
ESTABLE DEL NEÓN.
ENLACE COVALENTE.<br />
ESTRUCTURA<br />
DEL DIAMANTE
ENLACE COVALENTE<br />
LAS CERÁMICAS COVALENTES, TIPICAMENTE, SON DURAS Y FUERTES Y<br />
TIENEN UNA TEMPERATURA DE FUSIÓN ELEVADA. SIN EMBARGO, ESO NO<br />
SON RASGOS INHERENTES AL ENLACE COVALENTE. ASÍ, LA MAYORÍA DE<br />
LOS MATERIALES ORGANICOS TIENEN ENLACES COVALENTES Y NO<br />
POSEEN UNA DUREZA ALTA NI UNA TEMPERATURA DE FUSIÓN ELEVADA.<br />
EL FACTOR QUE DECIDE ES LA RESISTENCIA DEL ENLACE Y<br />
LA NATURALEZA DE LA ESTRUCTURA.<br />
EL METANO, CH 4 , FORMA UNA UNIDAD<br />
ESTRUCTURAL TETRAEDRICA COMO EL<br />
DIAMANTE, PERO LOS ELECTRONES DE<br />
VALENCIA TANTO DEL ÁTOMO CARBONO<br />
COMO DE LOS 4 ÁTOMOS DE HIDROGENO<br />
SE SATISFACEN CON LA FORMACIÓN DE UN<br />
TETRAEDRO SIMPLE Y NO RESULTA<br />
UNA ESTRUCTURA PERIODICA.<br />
EL METANO ES UN GAS EN LAS<br />
CONDICIONES AMBIENTALES NORMALES.<br />
ENLACE COVALENTE<br />
CIERTOS ELEMENTOS COMO EL N, EL O o EL MISMO CARBONO<br />
PUEDEN COMPARTIR DOS PARES DE ELECTRONES, FORMANDO UNA<br />
UNIÓN COVALENTE DOBLE.<br />
AL COMBINARSE EL CARBONO CON OTROS DOS ÁTOMOS PARA<br />
SATISFACER SU DEMANDA DE CUATRO ELECTRONES, ESTE SE<br />
RODEARÁ DE TRES ÁTOMOS, SIENDO LA GEOMETRÍA MÁS ADECUADA<br />
LA TRIANGULAR, CON TRES ORBITALES ORIENTADOS HACIA LOS<br />
VÉRTICES DEL MISMO EN ÁNGULOS DE 120°. ESTOS TRES ORBITALES<br />
RESULTAN DE LA “HIBRIDIZACIÓN” DE UN ORBITAL s CON DOS<br />
ORBITALES p Y SE DENOMINAN, POR LO TANTO, ORBITALES sp 2 .<br />
EN CADA UNO DE DICHOS 3 ORBITALES TENDREMOS UN ELECTRÓN<br />
DEL CARBONO, MANTENIÉNDOSE EL CUARTO ELECTRÓN EN SU<br />
ORBITAL P ORIGINAL, CON GEOMETRÍA PERPENDICULAR AL PLANO<br />
DE LA MOLÉCULA.
ENLACE COVALENTE
ENLACE COVALENTE<br />
Propiedades de los compuestos iónicos y covalentes<br />
COMPUESTOS IÓNICOS<br />
1.Son sólidos con puntos de fusión altos<br />
(PF > 400 ºC).<br />
COMPUESTOS COVALENTES<br />
1. Son gases, líquidos o sólidos con<br />
puntos de fusión bajos (PF< 300 ºC).<br />
2. Muchos son solubles en disolventes<br />
polares como el agua.<br />
3. La mayoría es insoluble en disolventes<br />
no polares como por ejemplo el hexano<br />
(C 6<br />
H 14<br />
)<br />
4. Los compuestos fundidos conducen<br />
bien la electricidad. (Contienen<br />
partículas móviles con carga, los iones).<br />
5. Las soluciones acuosas conducen bien<br />
la electricidad (porque contienen iones)<br />
2. Muchos son insolubles en disolventes<br />
polares.<br />
3. La mayoría es insoluble en disolventes<br />
no polares<br />
4. Los compuestos líquidos o fundidos no<br />
conducen la electricidad.<br />
5. Las soluciones acuosas suelen ser<br />
malas conductoras de la electricidad<br />
ENLACE COVALENTE
ENLACE COVALENTE<br />
CARÁCTER IÓNICO DE LOS ENLACES COVALENTES Y EL CARÁCTER<br />
COVALENTE DE LOS ENLACES IÓNICOS.<br />
LA MAYOR PARTE DE LOS ENLACES NO SON NI PURAMENTE IÓNICOS NI<br />
PURAMENTE COVALENTES.<br />
EL ENLACE IÓNICO ESTA ASOCIADO CON LAS CAPAS ELECTRONICAS ,<br />
LAS CUALES TIENEN UNA DISTRIBUCIÓN DE PROBABILIDAD ESFERICA Y<br />
SERÍA NO DIRECCIONAL SI FUERA IÓNICO PURO. SIN EMBARGO, HAY<br />
UNA TENDENCIA A QUE AUMENTE LA CONCENTRACIÓN DE ELECTRONES<br />
ENTRE LOS CENTROS DE LOS ÁTOMOS, LO CUAL PROPORCIONA UN<br />
CIERTO GRADO DE CARÁCTER NO IONICO.<br />
LA IONICIDAD DE UN ENLACE COVALENTE LO RELACIONAMOS<br />
CON EL CONCEPTO DE ELECTRONEGATIVIDAD, MIENTRAS QUE<br />
EL CARÁCTER COVALENTE DE UN ENLACE IÓNICO NOS LLEVA AL<br />
CONCEPTO DE POLARIZACIÓN.<br />
Electronegatividad (EN).<br />
Los enlaces de moléculas homodiatomicas como el H 2 son covalentes puros. En<br />
una molécula heterodiatomica como el HF, el par de enlace esta más localizado<br />
sobre el fluor, produciendo una carga parcial positiva sobre el hidrogeno, y una<br />
negativa sobre el fluor. Un enlace de este tipo se llama polar, ya que presenta un<br />
momento dipolar eléctrico.<br />
La capacidad de cada átomo de atraer los electrones del enlace covalente<br />
determina la distribución de cargas y se llama electronegatividad.<br />
La electronegatividad se define “como la tendencia relativa de los<br />
distintos átomos a atraer hacia sí el par de electrones que comparte con<br />
otro en un enlace covalente”. Se trata realmente de un índice por lo que<br />
no tiene unidades.<br />
Dicha tendencia debe estar relacionada con el potencial de ionización (energía<br />
que hay que comunicar a un átomo aislado en su configuración electrónica<br />
fundamental para arrancarle un electrón y convertirlo en un catión) y la<br />
electroafinidad (energía desprendida al capturar un electrón un átomo aislado en<br />
su configuración electrónica fundamental.) de la siguiente forma: a medida que<br />
aumentan ambas magnitudes el átomo querrá tomar electrones y será bastante<br />
difícil que los pierda.
Gráfica que relaciona el carácter ionico de un enlace con la diferencia de<br />
electronegatividad de los dos átomos enlazados, según una formula propuesta por<br />
Pauling. El carácter iónico aumenta con la diferencia entre las electronegatividades<br />
⎡ −0.25( X −X<br />
) 2 ⎤<br />
Caracter iónico = 100 ⎢1<br />
−e<br />
A B ⎥<br />
⎢<br />
⎥<br />
⎢⎣<br />
⎥⎦
ENLACES SECUNDARIOS, FÍSICOS O DE VAN DER WAALS.<br />
Aparte de los enlaces químicos o primarios de tipo iónico o covalente<br />
y que constituyen el enlace atómico de la mayoría de los materiales<br />
cerámicos, existe un segundo tipo de enlaces denominados físicos o<br />
secundarios, que son más débiles en comparación con los primarios<br />
o químicos, pero que tienen importantes efectos sobre las<br />
propiedades de algunos materiales cerámicos. Estos enlaces de tipo<br />
secundario o enlaces de Van der Waals se suelen agrupar juntos bajo<br />
el nombre de fuerzas de Van der Waals.<br />
Las energías de enlace características son del orden de 10 kJ/mol (0.1<br />
eV/átomo). En realidad, existen enlaces secundarios entre todos los<br />
átomos de las moléculas, pero su presencia puede pasar<br />
desapercibida si concurre alguno de los tres tipos de enlaces<br />
primarios. Este tipo de enlace, el secundario o físico, es evidente en<br />
los gases inertes, que tienen configuración electrónica estable, y,<br />
además, entre moléculas cuyos átomos estén unidos covalentemente.<br />
Tipos de fuerzas intermoleculares.<br />
ION-DIPOLO<br />
FUERZAS<br />
INTERMOLECULARES<br />
FUERZAS<br />
DE<br />
VAN DER<br />
WAALS<br />
FUERZAS DE<br />
DISPERSION<br />
DE LONDON<br />
DIPOLO-DIPOLO<br />
ION-DIPOLO INDUCIDO<br />
DIPOLO-DIPOLO INDUCIDO<br />
DIPOLO INDUCIDO-DIPOLO<br />
INDUCIDO<br />
PUENTE DE HIDROGENO<br />
Todas estas fuerzas intermoleculares resultan de la atracción<br />
mutua de cargas opuestas o la repulsión mutua de cargas iguales.
INTENSIDAD DE LAS FUERZAS INTERMOLECULARES E INTRAMOLECULARES.<br />
El valor de la fuerza de las interacciones es inversamente proporcional<br />
a alguna potencia de r y, por tanto, dependen en gran medida de la<br />
distancia entre moléculas que interaccionan.
LAS FUERZAS DE ENLACE SECUNDARIO SURGEN DE LOS<br />
DIPOLOS ATÓMICOS O MOLECULARES.<br />
EN ESENCIA, UN DIPOLO APARECE SI HAY ALGUNA SEPARACIÓN<br />
ENTRE LAS REGIONES POSITIVA Y NEGATIVA DE UN ÁTOMO O<br />
MOLÉCULA. CIERTAS PARTÍCULAS Y MOLÉCULAS NO PRESENTAN<br />
MOMENTO DIPOLAR INTRÍNSECO PERO SON SUSCEPTIBLES DE<br />
POLARIZARSE (DESPLAZAMIENTO DE CARGAS) POR EFECTO DE<br />
UN CAMPO ELÉCTRICO, EN CUYO CASO DECIMOS QUE SE TRATA<br />
DE UN DIPOLO INDUCIDO.<br />
CUANDO EL CAMPO ELÉCTRICO QUE POLARIZA A LA MOLÉCULA<br />
TIENE SU ORIGEN EN LA PRESENCIA DE UNA CARGA ELÉCTRICA<br />
PRÓXIMA APARECERÁ UNA INTERACCIÓN ELECTROSTÁTICA<br />
ENTRE LA CARGA Y EL DIPOLO INDUCIDO.<br />
La magnitud de ese dipolo<br />
viene definida por lo que se<br />
conoce como momento<br />
dipolar, y es el producto de la<br />
carga fraccional presente<br />
sobre cada átomo por la<br />
distancia que las separa.<br />
Representación del fenómeno de la inducción de un momento dipolar.
Formación de dipolos instantáneos en moléculas polarizables<br />
En la situación A de la figura anterior se consideran dos moléculas<br />
polarizables sin momento dipolar intrínseco muy próximas entre sí. La<br />
carga electrónica y nuclear fluctuan y en un instante dado un<br />
desplazamiento de carga asimétrico produce un dipolo instantáneo en<br />
una de las moléculas (situación B). Este dipolo instantáneo induce un<br />
dipolo en la otra molécula vecina apareciendo una fuerza atractiva entre<br />
ambos dipolos instantáneos (situción C).<br />
El enlace es el resultado de la atracción entre el extremo positivo de un<br />
dipolo y la región negativa del vecino, como indica la figura.<br />
Interacciones dipolares ocurren entre dipolos inducidos y dipolos<br />
permanentes (que poseen las moléculas polares). El enlace por puentes<br />
de hidrógeno, es un tipo especial de enlace secundario, aparece entre<br />
moléculas que tienen átomos de hidrógeno en su constitución.
FUERZAS IÓN-DIPOLO<br />
En un dipolo un lado de la molécula tiene un exceso neto de<br />
electrones y una carga parcial negativa (δ-) mientras que el<br />
otro lado es deficiente de electrones y tiene una carga parcial<br />
positiva (δ+). Se forma por la diferencia de electronegatividad<br />
entre dos átomos de una molécula polar.<br />
La interacción depende de la carga y del tamaño del ión<br />
como así también del momento dipolar y del tamaño de la<br />
molécula.<br />
FUERZAS DIPOLO-DIPOLO.<br />
Las fuerzas dipolo–dipolo se presentan en moléculas polares como<br />
resultado de las interacciones eléctricas entre dipolos de moléculas<br />
vecinas. Las fuerzas pueden ser de atracción o repulsión dependiendo de<br />
la orientación de las moléculas.<br />
La fortaleza de la interacción<br />
dipolo-dipolo depende del<br />
tamaño de los momentos<br />
dipolares envueltos.<br />
Mientras más polar sea una<br />
sustancia, mayor será la<br />
fortaleza de las<br />
interacciones dipolo-dipolo.
FUERZAS DE DISPERSIÓN DE LONDON.<br />
Todos los átomos y moléculas polares y no-polares experimentan<br />
estas fuerzas de dispersión London que resultan del movimiento de<br />
los electrones. Se forman de dipolos instantáneos en un átomo que<br />
puede afectar la distribución electrónica en átomos vecinos e<br />
inducir dipolos temporales en esos átomos vecinos. Como<br />
resultado se desarrollan fuerzas de atracción débiles.<br />
SU MAGNITUD DEPENDE DE LA FACILIDAD CON LA CUAL LA NUBE<br />
ELECTRÓNICA DE UNA MOLÉCULA PUEDE SER DISTORSIONADA POR<br />
UN CAMPO ELÉCTRICO CERCANO, PROPIEDAD CONOCIDA COMO<br />
POLARIZABILIDAD. MOLÉCULAS PEQUEÑAS O ÁTOMOS LIVIANOS<br />
TIENDEN A SER MENOS POLARIZABLES Y TIENEN FUERZAS DE<br />
DISPERSIÓN PEQUEÑAS PORQUE TIENEN POCOS ELECTRONES A<br />
DIFERENCIA DE UNA MOLÉCULA GRANDE O ÁTOMO PESADO QUE<br />
POSEA MUCHOS ELECTRONES QUE SERÁN MÁS POLARIZABLES Y<br />
SUS FUERZAS DE DISPERSIÓN SERÁN MAYORES.<br />
ENLACE IÓN-DIPOLO INDUCIDO.<br />
La fuerza de enlace ión-dipolo inducido se presenta entre un ión y un<br />
dipolo inducido que resulta del movimiento de los electrones
ENLACE DIPOLO INDUCIDO-DIPOLO (MOLÉCULA POLAR)<br />
Las fuerzas dipolo–dipolo inducido se dan entre una<br />
molécula polar y otra no polar. La molécula polar<br />
induce un dipolo en la no polar.<br />
En algunas moléculas existen dipolos permanentes<br />
como consecuencia de la distribución asimétrica de<br />
las regiones cargadas positiva y negativamente, son<br />
las denominadas moléculas polares. La figura es la<br />
representación esquemática de una molécula de<br />
fluoruro de hidrógeno, en la cual el momento dipolar<br />
permanente se origina a partir de las cargas positiva<br />
y negativa asociada a los extremos del hidrógeno y<br />
del flúor en la molécula de HF (La parte de la<br />
molécula donde se encuentra el flúor será negativa<br />
mientras la del hidrógeno será positiva).<br />
Las moléculas polares pueden inducir dipolos en las<br />
moléculas apolares próximas, y el enlace es la<br />
resultante de las fuerzas de atracción entre dos<br />
moléculas. Además, la magnitud de este enlace<br />
aumenta con los dipolos inducidos fluctuantes.<br />
ENLACE DIPOLO INDUCIDO-DIPOLO INDUCIDO.<br />
En una molécula que normalmente es simétrica eléctricamente<br />
(Figura a) se puede crear un dipolo inducido por la distribución<br />
espacial de los electrones respecto a los núcleos cargados<br />
positivamente, como se muestra en la figura b.<br />
Todos los átomos están vibrando<br />
constantemente y pueden causar<br />
distorsiones instantáneas en la<br />
simetría eléctrica de los átomos y<br />
moléculas, creando pequeños dipolos<br />
eléctricos, como se muestra en la<br />
figura b. A su vez, los dipolos suelen<br />
desplazar la distribución electrónica<br />
de átomos o moléculas próximas y<br />
generar otro dipolo que luego se<br />
enlaza débilmente al primero. Estas<br />
fuerzas atractivas que se originan<br />
entre gran número de átomos o<br />
moléculas son temporales y su<br />
magnitud fluctúa con el tiempo.<br />
(a).- Atomo electricamente simétrico.<br />
(b).- Dipolo atómico inducido.
ENLACE DE PUENTE DE HIDROGENO.<br />
El tipo de enlace secundario más fuerte y que merece<br />
especial atención es el enlace por puente de hidrógeno, que<br />
es un caso particular del enlace de molécula polar covalente<br />
como el agua o el amoníaco, que poseen átomos de<br />
hidrógeno unidos a elementos muy electronegativos como el<br />
flúor, oxígeno o nitrógeno (Es una interacción<br />
primordialmente de tipo dipolo–dipolo especialmente fuerte).<br />
Representación esquemática de una molécula polar de fluoruro de<br />
hidrógeno <strong>Enlace</strong> con dipolos permanentes<br />
Representación esquemática del enlace de puente de hidrógeno en el AGUA
LAS FUERZAS DE VAN DER WAALS SON MUY IMPORTANTES EN<br />
ESTRUCTURAS EN CAPAS, COMO LAS ARCILLAS, GRAFITO Y NITRURO DE<br />
BORO HEXAGONAL. DICHAS CERAMICAS TIENEN FUERTES ENLACES<br />
PRIMARIOS EN LAS CAPAS, PERO DEPENDEN DE LAS FUERZAS DE VAN DER<br />
WAALS QUE MANTIENEN ENLAZADAS LAS CAPAS ENTRE SI, LO QUE DA<br />
COMO RESULTADO EL QUE POSEAN ANISOTROPIA EN LA PROPIEDADES.<br />
EN LOS MINERALES ARCILLOSOS DICHA CARACTERÍSTICA HACE POSIBLE LA<br />
PLASTICIDAD CON LA ADICIÓN DE AGUA Y FUE LA BASE DEL TEMPRANO<br />
EMPLEO DE LA ARCILLA COMO MATERIA PRIMA CERÁMICA. DE HECHO, ERA<br />
LA BASE DE CASI TODA LA TECNOLOGÍA DE FABRICACIÓN DE CERÁMICAS<br />
ANTES DEL SIGLO VEINTE Y ES TODAVÍA UN FACTOR IMPORTANTE EN LA<br />
FABRICACIÓN DE PORCELANA, CERAMICA BLANCA, LADRILLOS, BALDOSAS<br />
Y MUCHOS OTROS PRODUCTOS.<br />
EL FÁCIL DESLIZAMIENTO ENTRE CAPAS EN EL GRAFITO Y EN EL NITRURO DE<br />
BORO HEXAGONAL HA DADO LUGAR A MUCHAS DE LAS APLICACIONES DE<br />
ESOS MATERIALES. PUEDE SER MECANIZADOS CON INSTRUMENTOS DE<br />
CORTE CONVENCIONALES Y PROPORCIONAR SUPERFICIES AUTO-<br />
LUBRICANTES DE BAJA FRICCIÓN PARA UNA AMPLIA VARIEDAD DE SELLOS.<br />
TAMBIÉN SON USADOS COMO LUBRICANTES SÓLIDOS COMO<br />
RECUBRIMIENTOS SUPERFICIALES DE CAPAS LIMITES.<br />
LOS ENLACES DÉBILES ENTRE LAS CAPAS DE LA MICA Y EL FÁCIL<br />
DESLIZAMIENTO ENTRE ELLAS HAN CONDUCIDO A NUEVOS USOS PARA<br />
ESOS MATERIALES. PEQUEÑOS CRISTALES DE MICA SINTÉTICOS SON<br />
DISPERSADOS EN EL VIDRIO PARA FORMAR UN COMPUESTO NO POROSO<br />
QUE TIENE EXCELENTES PROPIEDADES DE RESISTENCIA ELÉCTRICA. LA<br />
PRESENCIA DE LA MICA PERMITE EL MECANIZADO DEL COMPUESTO CON<br />
TOLERANCIAS AJUSTADAS SIN QUE SE PRODUZCAN FRACTURAS,<br />
UTILIZANDO ECONOMICAS MÁQUINAS HERRAMIENTAS CONVENCIONALES.<br />
AUNQUE LAS FUERZAS DE VANDER WAALS SON DÉBILES, SON ADECUADAS<br />
PARA CAUSAR LA ADSORCIÓN DE MOLÉCULAS EN LA SUPERFICIE DE UNA<br />
PARTÍCULA. PARA LAS PARTÍCULAS DE DIMENSIONES COLOIDALES (100<br />
ANGSTROMS A 3 MICRAS), LOS IONES ADSORBIDOS PROPORCIONAN<br />
BASTANTE CARGA EN LA SUPERFICIE DE UNA PARTÍCULA PARA ATRAER A<br />
LAS PARTÍCULAS DE CARGA OPUESTA Y REPELER A LAS DE LA MISMA<br />
CARGA. ESTO TIENE UN IMPORTANTE EFECTO SOBRE EL REOLOGÍA (<br />
CARACTERÍSTICAS DE FLUJO DE PARTÍCULAS SUSPENDIDAS EN UN FLUIDO)<br />
DE SUSPENSIONES DE PARTÍCULAS USADAS EN EL COLADO Y MEZCLAS<br />
USADAS EN LA EXTRUSIÓN, EL MOLDEO POR INYECCIÓN Y OTRAS TÉCNICAS<br />
DE CONFORMADO PLÁSTICO.
FORMAS POLIMORFICAS. TRANSFORMACIONES POLIMORFICAS.<br />
Dentro de los materiales cerámicos y refractarios existen materiales, que<br />
pueden presentar diferentes formas alotrópicas (Elementos) o<br />
polimórficas (Compuestos), lo cual en muchos casos influye de una<br />
manera decisiva en las aplicaciones de dichos materiales. Un ejemplo lo<br />
constituye la circona (Oxido de circonio, ZrO 2 ). A temperatura ambiente,<br />
la estructura cristalina estable es la forma polimórfica monoclínica, la<br />
cual se transforma en la tetragonal cuando al ir aumentando la<br />
temperatura esta llega a, aproximadamente, 1100 ºC.<br />
La transformación:<br />
ZrO ( Monoclinico) ⇔ ZrO ( Tetragonal)<br />
2 2<br />
Δ V =−(3 −5) %<br />
FORMAS POLIMORFICAS. TRANSFORMACIONES POLIMORFICAS.
FORMAS POLIMORFICAS. TRANSFORMACIONES POLIMORFICAS.<br />
FORMAS POLIMORFICAS. TRANSFORMACIONES POLIMORFICAS.
Transfomaciones por<br />
desplazamiento o<br />
militares y<br />
transformaciones por<br />
reordenación o<br />
difusionales.<br />
FORMAS POLIMORFICAS. TRANSFORMACIONES POLIMORFICAS.<br />
Transformaciones polimórficas y variedades de la sílice.