Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
7.7. Sel Elektrokimia dan Potensial Elektroda<br />
Seperti kita sudah singgung dalam bahasan sebelumnya<br />
bahwa reaksi kimia dapat melepaskan energi maupun<br />
membutuhkan energi. Berdasarkan sifat listrik maka<br />
energi yang dihasilkan reaksi kimia dapat diukur dalam<br />
bentuk energi potensial (E) dengan satuan Volt.<br />
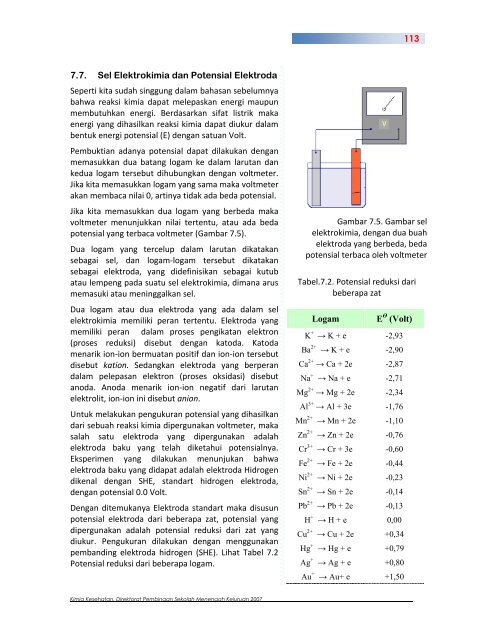
Pembuktian adanya potensial dapat dilakukan dengan<br />
memasukkan dua batang logam ke dalam larutan dan<br />
kedua logam tersebut dihubungkan dengan voltmeter.<br />
Jika kita memasukkan logam yang sama maka voltmeter<br />
akan membaca nilai 0, artinya tidak ada beda potensial.<br />
Jika kita memasukkan dua logam yang berbeda maka<br />
voltmeter menunjukkan nilai tertentu, atau ada beda<br />
potensial yang terbaca voltmeter (Gambar 7.5).<br />
Dua logam yang tercelup dalam larutan dikatakan<br />
sebagai sel, dan logam‐logam tersebut dikatakan<br />
sebagai elektroda, yang didefinisikan sebagai kutub<br />
atau lempeng pada suatu sel elektrokimia, dimana arus<br />
memasuki atau meninggalkan sel.<br />
Dua logam atau dua elektroda yang ada dalam sel<br />
elektrokimia memiliki peran tertentu. Elektroda yang<br />
memiliki peran dalam proses pengikatan elektron<br />
(proses reduksi) disebut dengan katoda. Katoda<br />
menarik ion‐ion bermuatan positif dan ion‐ion tersebut<br />
disebut kation. Sedangkan elektroda yang berperan<br />
dalam pelepasan elektron (proses oksidasi) disebut<br />
anoda. Anoda menarik ion‐ion negatif dari larutan<br />
elektrolit, ion‐ion ini disebut anion.<br />
Untuk melakukan pengukuran potensial yang dihasilkan<br />
dari sebuah reaksi kimia dipergunakan voltmeter, maka<br />
salah satu elektroda yang dipergunakan adalah<br />
elektroda baku yang telah diketahui potensialnya.<br />
Eksperimen yang dilakukan menunjukan bahwa<br />
elektroda baku yang didapat adalah elektroda Hidrogen<br />
dikenal dengan SHE, standart hidrogen elektroda,<br />
dengan potensial 0.0 Volt.<br />
Dengan ditemukanya Elektroda standart maka disusun<br />
potensial elektroda dari beberapa zat, potensial yang<br />
dipergunakan adalah potensial reduksi dari zat yang<br />
diukur. Pengukuran dilakukan dengan menggunakan<br />
pembanding elektroda hidrogen (SHE). Lihat Tabel 7.2<br />
Potensial reduksi dari beberapa logam.<br />
Kimia Kesehatan, Direktorat Pembinaan Sekolah Menengah Kejuruan 2007<br />
113<br />
Gambar 7.5. Gambar sel<br />
elektrokimia, dengan dua buah<br />
elektroda yang berbeda, beda<br />
potensial terbaca oleh voltmeter<br />
Tabel.7.2. Potensial reduksi dari<br />
beberapa zat<br />
Logam E Ө (Volt)<br />
K + → K + e -2,93<br />
Ba 2+ → K + e -2,90<br />
Ca 2+ → Ca + 2e -2,87<br />
Na + → Na + e -2,71<br />
Mg 2+ → Mg + 2e -2,34<br />
Al 3+ → Al + 3e -1,76<br />
Mn 2+ → Mn + 2e -1,10<br />
Zn 2+ → Zn + 2e -0,76<br />
Cr 3+ → Cr + 3e -0,60<br />
Fe 2+ → Fe + 2e -0,44<br />
Ni 2+ → Ni + 2e -0,23<br />
Sn 2+ → Sn + 2e -0,14<br />
Pb 2+ → Pb + 2e -0,13<br />
H + → H + e 0,00<br />
Cu 2+ → Cu + 2e +0,34<br />
Hg + → Hg + e +0,79<br />
Ag + → Ag + e +0,80<br />
Au + → Au+ e +1,50