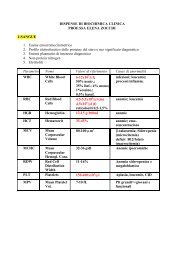
degli argomenti - ClinicaVirtuale.altervista.org
degli argomenti - ClinicaVirtuale.altervista.org
degli argomenti - ClinicaVirtuale.altervista.org
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Il vantaggio sta nel fatto che ora possiamo misurare e far reagire quantità macroscopiche e<br />
facilmente misurabili di materia (4 g di idrogeno e 32 g di ossigeno).<br />
1.8 Il legame chimico<br />
La vita di una cellula dipende in larga misura dalla sua capacità di immagazzinare ed utilizzare<br />
energia. L'unico modo che la cellula possiede per immagazzinare energia è quella di fissarla<br />
all'interno dei legami chimici che tengono uniti gli atomi nelle molecole.<br />
E' infatti attraverso una continua rottura e ricostruzione dei legami chimici e quindi attraverso<br />
un lavoro ininterrotto di demolizione e di riassemblaggio di molecole (metabolismo cellulare)<br />
che la cellula fa circolare l'energia al suo interno.<br />
Una delle caratteristiche importanti di ogni legame chimico è dunque proprio il suo contenuto<br />
energetico, comunemente (anche se impropriamente) detto forza di legame.<br />
Durante una reazione chimica vengono rotti alcuni legami dei reagenti, mentre si formano altri<br />
legami necessari per la sintesi dei prodotti di reazione.<br />
Una reazione avviene con liberazione di energia (reazione esoergonica) se i legami che si<br />
spezzano sono più energetici dei legami che si formano. In tal caso possiamo affermare che i<br />
reagenti sono più energetici dei prodotti di reazione.<br />
Energia<br />
A + B (reagenti)<br />
12<br />
E (energia liberata)<br />
C + D (prodotti)<br />
tempo<br />
Se al contrario una reazione avviene con assorbimento di energia (reazione endoergonica) e<br />
i legami che si spezzano sono meno energetici dei legami che si formano, allora possiamo<br />
affermare che i reagenti sono meno energetici dei prodotti di reazione.<br />
Energia<br />
A + B (reagenti)<br />
C + D (prodotti)<br />
E (energia assorbita)<br />
tempo<br />
Le variazioni energetiche (E) associate alla rottura ed alla formazione dei legami chimici si<br />
misurano normalmente in chilocalorie su mole (kcal/mol) o chilojoule su mole (kj/mol)<br />
Ricordiamo che una caloria è la quantità di calore necessaria per far aumentare la temperatura<br />
di 1 g di acqua, portandola da 14,5°C a 15,5°C e che 1 cal = 4,186 J<br />
Un esempio di reazione esoergonica è la combustione del metano in presenza di ossigeno.<br />
CH4 + 2O2 CO2 + 2H2O + 212,8 kcal<br />
Ogni mole di metano (16 g) che brucia libera dunque 212,8 Kcal<br />
Un esempio di reazione endoergonica è la scissione dell'acqua in idrogeno ed ossigeno<br />
2H2O + 136,6 Kcal 2H2 + O2