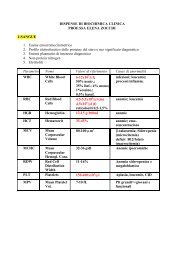
degli argomenti - ClinicaVirtuale.altervista.org
degli argomenti - ClinicaVirtuale.altervista.org
degli argomenti - ClinicaVirtuale.altervista.org
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
2 La chimica della vita<br />
Da un punto di vista chimico ciò che distingue un essere vivente dalla materia inanimata non è<br />
il tipo di elementi chimici di cui è costituito, ma la complessità con cui tali elementi si legano<br />
per dare origine alle enorme varietà delle sostanze <strong>org</strong>aniche.<br />
Il Carbonio che costituisce il diamante, la grafite e le rocce calcaree è assolutamente identico al<br />
carbonio che forma l'emoglobina del sangue o il glucosio, ma in tali molecole biologiche esso si<br />
lega a formare strutture incomparabilmente più complesse.<br />
Gli esseri viventi richiedono in definitiva composti chimici altamente <strong>org</strong>anizzati, ordinati e<br />
spesso caratterizzati da un elevato contenuto energetico.<br />
Le molecole biologiche sono composte peraltro da un numero relativamente esiguo di elementi<br />
chimici. Dei 92 elementi esistenti in natura gli esseri viventi ne utilizzano in pratica una<br />
trentina e quasi tutti a basso peso atomico (i primi elementi della tabella periodica).<br />
Tra questi alcuni sono presenti in tracce, altri vengono utilizzati in maniera massiccia, basti<br />
pensare che il 99% di un essere vivente è formato da 6 elementi chimici: il Carbonio (C),<br />
l'Idrogeno (H), l'Ossigeno (O), l'Azoto (N), il Fosforo (P) e lo Zolfo (S). [sigla CHONPS].<br />
2.1 Il carbonio<br />
Un posto centrale nella chimica della vita spetta al Carbonio. Il motivo principale è che il<br />
Carbonio, oltre ad essere un elemento particolarmente diffuso in natura, possiede 4 elettroni<br />
superficiali che può condividere con altri elementi chimici (ed anche con altri atomi di<br />
Carbonio) per formare quattro legami covalenti stabili.<br />
Il fatto più interessante è però la capacità del carbonio di legarsi con altri atomi di carbonio per<br />
formare lunghe catene, variamente ramificate o addirittura chiuse a formare anelli (in realtà<br />
poligoni), mantenendo nel contempo legami liberi che vengono saturati da altri elementi<br />
chimici (essenzialmente H, O, N). In tal modo le combinazioni possibili risultano virtualmente<br />
infinite.<br />
In molti casi le macromolecole <strong>org</strong>aniche raggiungono complessità e varietà ancor maggiori<br />
attraverso il processo di polimerizzazione.<br />
Un polimero è un composto formato dalla successione di molte molecole uguali (monomeri)<br />
o di pochi tipi diversi. Uno stesso monomero può agganciarsi in modi diversi formando polimeri<br />
aventi differenti caratteristiche (il glucosio, ad esempio, forma sia la cellulosa che l'amido).<br />
Il Carbonio va quindi a costituire una specie di impalcatura, rappresenta lo scheletro di tutte le<br />
sostanze <strong>org</strong>aniche, al punto che la chimica <strong>org</strong>anica è conosciuta anche come chimica del<br />
carbonio.<br />
L'unica sostanza con caratteristiche chimiche molto simili è il Silicio, l'elemento con il quale si<br />
costruiscono i chips dei computer. Forse in qualche altro mondo potrebbe esistere una vita<br />
basata sulla chimica del Silicio.<br />
Quando il Carbonio si lega con se stesso produce molecole dalla geometria variabile che<br />
dipende dagli angoli di legame.<br />
Si possono a tal proposito distinguere tre casi:<br />
2.1.1 carbonio tetraedrico<br />
il Carbonio forma 4 legami covalenti semplici (carbonio tetraedrico)<br />
in questo caso i quattro legami sono tra loro equidistanti e formano l'uno con l'altro angoli di<br />
legame di circa 109°. Possiamo immaginare l'atomo di Carbonio al centro di un tetraedro con i<br />
quattro legami che puntano verso i vertici.<br />
22