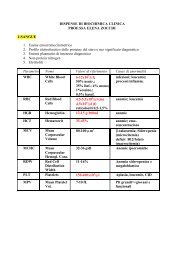
degli argomenti - ClinicaVirtuale.altervista.org
degli argomenti - ClinicaVirtuale.altervista.org
degli argomenti - ClinicaVirtuale.altervista.org
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Gli ioni negativi o anioni sono atomi che hanno acquistato uno o più elettroni.<br />
Se dunque noi avviciniamo del Cloro gassoso Cl2 e del Sodio metallico Na, assisteremo ad una<br />
violenta reazione esoergonica. Il Sodio, che presenta una elevata tendenza a liberarsi del suo<br />
elettrone, lo cede al Cloro che presenta da parte sua una grande tendenza ad acquistarlo.<br />
Ma lo ione Sodio Na + e lo ione Cloro Cl - non rimangono a questo punto separati. Presentando<br />
due cariche di segno opposto essi si attirano formando una molecola, complessivamente<br />
neutra, la cui formula bruta è NaCl, il Cloruro di Sodio.<br />
Si è dunque formato un legame chimico di tipo elettrostatico tra ioni aventi carica opposta: il<br />
legame ionico. I composti che presentano questo tipo di legame si dicono composti ionici.<br />
Dire che entrambi gli atomi raggiungono in tal modo una configurazione più stabile significa<br />
affermare che diminuiscono il loro contenuto energetico. L'energia si libera in genere sotto<br />
forma di calore di reazione.<br />
2Na + Cl2 2 NaCl + 196,53 kcal<br />
In realtà non esiste una singola molecola di Cloruro di Sodio, come abitualmente e<br />
convenzionalmente si scrive. Infatti l'attrazione tra cariche di segno opposto, come sono cationi<br />
e anioni, non si sviluppa solo in un'unica direzione, ma agisce uniformemente in tutte le<br />
direzioni (con simmetria sferica). Uno ione Na + risulta infatti circondato da 6 ioni Cl - e<br />
viceversa., formando uno sconfinato reticolato cubico, in cui ioni di carica opposta si alternano<br />
ordinatamente nelle tre direzioni dello spazio. Tale disposizione ordinata è detta cristallina,<br />
poichè genera macroscopicamente un cristallo che conserva la geometria della sottostante<br />
struttura atomica.<br />
Nei composti ionici quindi la formula bruta non descrive una struttura molecolare autonoma,<br />
ma indica il rapporto numerico esistente nel cristallo tra ioni positivi e negativi. Nel caso del<br />
Cloruro di Sodio, ad esempio, la formula bruta NaCl ci informa che il rapporto numerico tra ioni<br />
Na + e Cl - all'interno del reticolo è di 1:1.<br />
Se la reazione fosse avvenuta tra il Calcio ed il Cloro, il Calcio avrebbe ceduto due elettroni a 2<br />
atomi di Cloro, ciascuno dei quali avrebbe acquistato un elettrone.<br />
In tal caso affinchè il reticolato ionico sia nel complesso neutro è necessario che per ciascun<br />
ione Ca 2+ siano presenti 2 ioni Cl - .<br />
La formula CaCl2 indica dunque che nel reticolo cristallino del Cloruro di Calcio il rapporto tra<br />
ioni Calcio e ioni Cloro è 2:1.<br />
Le sostanze ioniche, poste in acqua si dissociano negli ioni costituenti.<br />
In acqua quindi le sostanze ioniche non sono presenti come molecole, ma come ioni.<br />
In tutte le soluzioni acquose che costituiscono gli esseri viventi e nelle cellule in particolare, si<br />
trovano ioni di interesse biologico quali appunto: K + , Na + , Ca 2+ , Mg 2+ , Cl - etc.<br />
1.8.2 Legame covalente<br />
In generale gli ultimi elementi di ciascun periodo hanno tutti una grande tendenza ad<br />
acquistare elettroni, mentre i primi elementi di ciascun periodo presentano una forte tendenza<br />
14