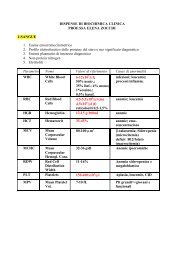
degli argomenti - ClinicaVirtuale.altervista.org
degli argomenti - ClinicaVirtuale.altervista.org
degli argomenti - ClinicaVirtuale.altervista.org
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
La struttura globulare viene poi ulteriormente stabilizzata da legami interni alla molecola. Tra<br />
questi tipi di interazioni, le più frequenti sono:<br />
L'effetto idrofobico, che induce le sostanze non polari a minimizzare i loro contatti con<br />
l’acqua, è la causa principale della stabilità della struttura nativa della proteina.<br />
Formazione di legami ionici tra residui amminoacidici carichi positivamente (lisina,<br />
istidina, arginina) e residui carichi negativamente (ac. aspartico, ac. glutammico). Circa<br />
il 75% dei residui elettricamente carichi nelle proteine appartengono a coppie ioniche e<br />
sono localizzati prevalentemente sulla superficie della proteina con formazione di coppie<br />
ioniche<br />
Formazione di “ponti salini” dati da un catione metallico coordinato da due o più ioni<br />
carbossilati<br />
Legami ad idrogeno<br />
Ponti disolfuro<br />
Particolarmente diffusi sono i ponti disolfuro (-S-S-) che si formano tra due gruppi solfidrilici<br />
-SH (il gruppo solfidrile è presente solo nell'amminoacido cisteina).<br />
In tal modo una proteina globulare risulta particolarmente irregolare, presentando una<br />
superficie ricca di incavi, anfrattuosità e sp<strong>org</strong>enze. Ogni proteina globulare presenta delle<br />
irregolarità caratteristiche (sito attivo o sito di riconoscimento) che utilizza in modo<br />
peculiare per riconoscere una specifica sostanza chimica (substrato) ed effettuare su di essa<br />
azioni biologiche specifiche. Il riconoscimento è altamente selettivo ed avviene secondo un<br />
modello chiave-serratura.<br />
44