Mekanismer for brun- og hvidmuld svampes nedbrydning af tr - Nature
Mekanismer for brun- og hvidmuld svampes nedbrydning af tr - Nature
Mekanismer for brun- og hvidmuld svampes nedbrydning af tr - Nature
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
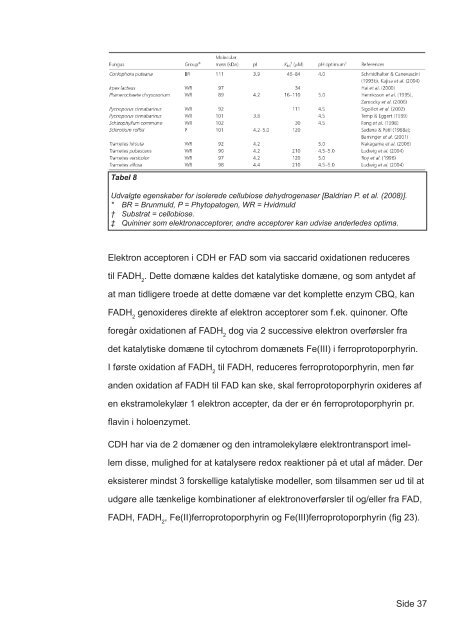
Tabel 8<br />
Udvalgte egenskaber <s<strong>tr</strong>ong>for</s<strong>tr</strong>ong> isolerede cellubiose dehydr<s<strong>tr</strong>ong>og</s<strong>tr</strong>ong>enaser [Baldrian P. et al. (2008)].<br />
* BR = Brunmuld, P = Phytopat<s<strong>tr</strong>ong>og</s<strong>tr</strong>ong>en, WR = Hvidmuld<br />
† Subs<strong>tr</strong>at = cellobiose.<br />
‡ Quininer som elek<strong>tr</strong>onacceptorer, andre acceptorer kan udvise anderledes optima.<br />
Elek<strong>tr</strong>on acceptoren i CDH er FAD som via saccarid oxidationen reduceres<br />
til FADH 2 . Dette domæne kaldes det katalytiske domæne, <s<strong>tr</strong>ong>og</s<strong>tr</strong>ong> som antydet <s<strong>tr</strong>ong>af</s<strong>tr</strong>ong><br />
at man tidligere <strong>tr</strong>oede at dette domæne var det komplette enzym CBQ, kan<br />
FADH 2 genoxideres direkte <s<strong>tr</strong>ong>af</s<strong>tr</strong>ong> elek<strong>tr</strong>on acceptorer som f.ek. quinoner. Ofte<br />
<s<strong>tr</strong>ong>for</s<strong>tr</strong>ong>egår oxidationen <s<strong>tr</strong>ong>af</s<strong>tr</strong>ong> FADH 2 d<s<strong>tr</strong>ong>og</s<strong>tr</strong>ong> via 2 successive elek<strong>tr</strong>on overførsler fra<br />
det katalytiske domæne til cytochrom domænets Fe(III) i ferroprotoporphyrin.<br />
I første oxidation <s<strong>tr</strong>ong>af</s<strong>tr</strong>ong> FADH 2 til FADH, reduceres ferroprotoporphyrin, men før<br />
anden oxidation <s<strong>tr</strong>ong>af</s<strong>tr</strong>ong> FADH til FAD kan ske, skal ferroprotoporphyrin oxideres <s<strong>tr</strong>ong>af</s<strong>tr</strong>ong><br />
en eks<strong>tr</strong>amolekylær 1 elek<strong>tr</strong>on accepter, da der er én ferroprotoporphyrin pr.<br />
flavin i holoenzymet.<br />
CDH har via de 2 domæner <s<strong>tr</strong>ong>og</s<strong>tr</strong>ong> den in<strong>tr</strong>amolekylære elek<strong>tr</strong>on<strong>tr</strong>ansport imel-<br />
lem disse, mulighed <s<strong>tr</strong>ong>for</s<strong>tr</strong>ong> at katalysere redox reaktioner på et utal <s<strong>tr</strong>ong>af</s<strong>tr</strong>ong> måder. Der<br />
eksisterer mindst 3 <s<strong>tr</strong>ong>for</s<strong>tr</strong>ong>skellige katalytiske modeller, som tilsammen ser ud til at<br />
udgøre alle tænkelige kombinationer <s<strong>tr</strong>ong>af</s<strong>tr</strong>ong> elek<strong>tr</strong>onoverførsler til <s<strong>tr</strong>ong>og</s<strong>tr</strong>ong>/eller fra FAD,<br />
FADH, FADH 2 , Fe(II)ferroprotoporphyrin <s<strong>tr</strong>ong>og</s<strong>tr</strong>ong> Fe(III)ferroprotoporphyrin (fig 23).<br />
Side 37