Wirkstoffe Effekte
Wirkstoffe Effekte
Wirkstoffe Effekte
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Pädagogische Hochschule Chemie 7sm<br />
St. Gallen<br />
<strong>Wirkstoffe</strong><br />
<strong>Effekte</strong><br />
"Modelle zu benutzen ist so eine eigene Kunst; soundso viel ist davon zu<br />
erlernen. Weder die Absicht, die Vorlage genau zu treffen, noch die<br />
Absicht, sie schnell zu verlassen, ist das Richtige."<br />
Prof. Dr. Peter Bützer<br />
Altstätten, , August 2008<br />
(Berthold Brecht in "Mutter Courage und ihre Kinder")<br />
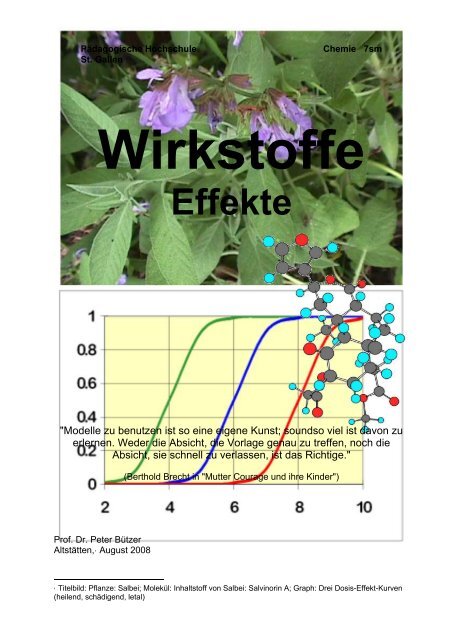
, Titelbild: Pflanze: Salbei; Molekül: Inhaltstoff von Salbei: Salvinorin A; Graph: Drei Dosis-Effekt-Kurven<br />
(heilend, schädigend, letal)
Inhalt<br />
2<br />
1 Nutzen oder Schaden?............................................................................................4<br />
1.1 <strong>Wirkstoffe</strong>, Gifte und Pharmaka ........................................................................4<br />
1.2 Wirkungen eine chemische Eigenschaft............................................................5<br />
1.3 Die 3 V der Anwendung von <strong>Wirkstoffe</strong>n...........................................................6<br />
1.4 Definition eines Pharmakons.............................................................................7<br />
2 Gifte..........................................................................................................................8<br />
2.1 Die biologische Wirkung..................................................................................13<br />
2.2 Faktoren, welche die Wirkung wesentlich beeinflussen können......................15<br />
3 Geruch, eine molekulare Wirkung ..........................................................................17<br />
3.1.1 Geruchsempfindung<br />
Chemie Bützer<br />
, ................................................................................18<br />
3.1.2 Geruchsindentifikation..............................................................................19<br />
3.1.3 Geruchsintensität .....................................................................................20<br />
3.1.4 Geruchsschwellen....................................................................................21<br />
4 Resorption von Substanzen ...................................................................................23<br />
Passive Diffusion .......................................................................................................23<br />
Erleichterte Diffusion..................................................................................................23<br />
Aktiver Transport........................................................................................................24<br />
Pinocytose, Phagocytose, Persorption.......................................................................24<br />
4.1 Diffusion ..........................................................................................................25<br />
4.1.1 Inhalation..................................................................................................27<br />
4.1.2 Orale Resorption ......................................................................................27<br />
4.1.3 Dermale Resorption .................................................................................28<br />
4.1.4 Parenterale Resorption ............................................................................28<br />
4.2 Dissoziation.....................................................................................................28<br />
5 Elimination..............................................................................................................34<br />
5.1 Biotransformation ............................................................................................34<br />
5.2 Exkretion .........................................................................................................35<br />
5.3 Geschwindigkeit von Gleichgewichtseinstellungen (Kinetik) ...........................36<br />
5.4 Occupationsmodell..........................................................................................39<br />
5.4.1 Annahmen für das Modell: .......................................................................40<br />
5.4.2 Grenzen des Modells ...............................................................................41<br />
5.4.3 Übertragung auf Populationen .................................................................44<br />
5.4.4 Bedeutung für die Wirkungsbeurteilung ...................................................46<br />
5.4.5 Experimentelle Auswertung von <strong>Effekte</strong>n.................................................50<br />
5.4.6 Praktische Anwendung und Auswertung..................................................52<br />
5.4.7 Das Occupationsmodell mit Antagonisten................................................62<br />
5.5 Hormesis .........................................................................................................64<br />
5.6 Gefährlichste <strong>Effekte</strong>.......................................................................................65<br />
5.7 Stereochemie der <strong>Effekte</strong>................................................................................66<br />
5.8 Resistenzbildung bei Antibiotika......................................................................69<br />
6 Haber'sche Regel, ct-Produkt und Dosis................................................................70<br />
6.1 Modellvoraussetzungen ..................................................................................70<br />
6.2 Grenzwerte......................................................................................................74<br />
6.3 Kohlenmonoxid................................................................................................78<br />
6.4 Beurteilung von Stoffgemischen......................................................................84<br />
6.5 Schwefelwasserstoff........................................................................................86<br />
6.6 Die krebserzeugende Substanz Benzol ..........................................................88<br />
6.7 Konzentrationsberechnungen in der Umweltchemie .......................................89<br />
6.7.1 Problemstellung Ozon, O3........................................................................89<br />
6.8 Dioxin und ADI-Wert........................................................................................91
Chemie Bützer<br />
3<br />
7 Carcinogene Wirkungen .........................................................................................94<br />
7.1 Beispiele für die Giftung im Körper..................................................................97<br />
7.2 Tumorbildung ..................................................................................................98<br />
7.3 Das lineare Modell...........................................................................................99<br />
8 Chemikaliengesetz ...............................................................................................102<br />
8.1 Sicherheitsdatenblatt.....................................................................................102<br />
9 Die Wirkung von Strahlen.....................................................................................107<br />
9.1 Kernaussagen zur Radioaktivität...................................................................107<br />
9.2 Auswirkungen auf den Menschen .................................................................108<br />
9.2.1 Ortsdosisleistung....................................................................................109<br />
9.2.2 Interne Bestrahlung................................................................................110<br />
9.2.3 Molekulare <strong>Effekte</strong> .................................................................................111<br />
9.3 Das Krebsrisiko .............................................................................................112<br />
10 Überblick...........................................................................................................113<br />
11 Glossar .............................................................................................................114<br />
12 Risiko-, Sicherheits-, Entsorgungs-Sätze..........................................................126<br />
12.1 R-Sätze .........................................................................................................126<br />
12.2 S-Sätze .........................................................................................................129<br />
12.3 E-Sätze .........................................................................................................131<br />
13 Anhang: Sicherheitsdatenblatt: Nicotin .............................................................132
1 Nutzen oder Schaden?<br />
sola dosis facet venenum<br />
Allein die Dosis macht, dass etwas<br />
ein Gift ist (Paracelsus 1)<br />
(1537/38, in „7 Defensiones“)<br />
Kleine Dosen können Medikamente sein,<br />
grosse Gift (Colchizin, Digitalis, Aspirin –<br />
eigentlich alle Medikamente).<br />
"Verordnung den Gift- Verkauf angehend:<br />
Gegeben den 25. Augstmonats 1772, erneuert<br />
den 13. März 1789" (Kanton Bern).<br />
"3°) Unter dem Ausdruck Gift verstehen Wir,<br />
sowohl alles Fleigen- und Mäusegift, als alle<br />
andre Gattungen von Giften, sowohl aus dem<br />
Pflanzen- als Mineralreich, von welcher Art und<br />
Namen sie immer seyn mögen; und soll solches<br />
von niemanden anders, als gegen Vorweisung und Auslieferung hienachbemeldter massen<br />
ausgefertigter Giftscheine, verkauft oder abgeliefert werden."<br />
1.1 <strong>Wirkstoffe</strong>, Gifte und Pharmaka<br />
<strong>Wirkstoffe</strong>, Gifte und Pharmaka sind charakterisiert mit:<br />
- Art der Wirkung<br />
- Ausmass der Wirkung<br />
- Dauer der Wirkung<br />
Da bleiben Fragen: (Wirkungsmechanismus)<br />
� Wie wirkt eine Substanz?<br />
� Warum wirkt eine Substanz?<br />
4<br />
Abbildung 1: Philippus Aureolus<br />
Theophrastus Bombast von<br />
Hohenheim, (1493-1541). Genannt<br />
Paracelsus<br />
Beispiel Ricin:<br />
Der Samen der Ricinusstaude enthält unter anderem ein Protein, das schon in einer<br />
Dosis von ca. 100 μg tödlich wirkt. Das Protein ist im Ricinusöl nicht löslich und bleibt<br />
somit in den Pressrückständen zurück. Die Pflanze schützt ihren Samen mit diesem<br />
Gift, denn bei der Keimung im Boden wird das Gift rasch abgebaut.<br />
Es stellen sich zwei Fragen:<br />
1. Wie wirkt dieses Protein? � Gefährlichkeit,<br />
2. Bei welcher Dosis treten welche Schädigungen auf? � Risiko<br />
1 Paracelsus, Philippus Aureolus, eigentlich Philippus Aureolus Theophrastus Bombast von Hohenheim,<br />
(1493-1541), schweizerischer Arzt und Chemiker. Paracelsus griff die medizinischen<br />
Glaubenssätze seiner Zeit an und behauptete, Krankheiten würden durch körperfremde<br />
Substanzen verursacht und liessen sich durch chemische Substanzen bekämpfen. Geboren in<br />
Einsiedeln.<br />
Chemie Bützer
Resorption<br />
Verteilung<br />
Speicherung<br />
Elimination<br />
Abbildung 2: Der molekulare Weg zum Effekt<br />
5<br />
Dosis<br />
Serumspiegel<br />
pharmakodynamischer<br />
Effekt<br />
1.2 Wirkungen eine chemische Eigenschaft<br />
Biotransformation<br />
Viele Wirkungen lassen sich „neutralisieren“, denn sie sind direkt mit chemischen<br />
Eigenschaften verknüpft.<br />
Tabelle 1: Entgifungen, Beispiele<br />
Beispiele:<br />
Entgiftung durch Verdünnen<br />
HCl - Konz. >25% ≥10-25 % >10<br />
Gefahrensymbol C Xi frei<br />
H2O2-Konz. Gas 10% 2.1-9.9% 1-2% 5000<br />
Neutralisation<br />
NaOH + HCl � NaCl<br />
Gefahrensymbol C C frei<br />
MAK (ppm) 2 5 frei (Staub?)<br />
LD(50) mg/kg 70 2-4 (iv.)<br />
14 (oral)<br />
5400<br />
Entgiftung durch Oxidation<br />
Oxidation<br />
(Verbrennung)<br />
KCN + H2O2 � KCNO + H2O<br />
LD(50)(mg/kg) < 5 5-50 (10%) 500-5000 frei<br />
Entgiftung durch Oxidation<br />
Oxidation<br />
(Verbrennung)<br />
4 HCN + 5 O2 � 4 CO2 + 2 N2 + 2 H2O<br />
MAK (ppm) 5 6.0*10 5<br />
5000 frei<br />
Giftung in der Umwelt: Ozonbildung<br />
3 O2 � 2 O3<br />
MAK (ppm) frei 0,1<br />
Chemie Bützer
1.3 Die 3 V der Anwendung von <strong>Wirkstoffe</strong>n<br />
vermeiden<br />
• möglichst wenig gefährliche Substanzen (� ersetzen)<br />
• nie mischen<br />
• nur in Originalflaschen lassen<br />
• Beschriftung immer gut sichtbar halten<br />
• nicht in die Kanalisation entsorgen<br />
• nicht verbrennen<br />
vermindern<br />
• möglichst wenig verwenden<br />
• sorgfältig anwenden<br />
• richtig aufbewahren<br />
verbessern<br />
• bessere Verfahren, gefahrlosere Reaktionen<br />
6<br />
Die Gefahrenklassierung gibt Aufschluss darüber, wie gefährlich die verwendeten Stoffe<br />
eingestuft werden.<br />
Brennspiritus (Ethanol)<br />
• feuergefährlich (eigentlich:<br />
leichtentzündlich)<br />
Spiritus: Ethanol, CH3CH2OH,<br />
landläufig Alkohol<br />
Schnellentkalker<br />
• Amidosulfonsäure<br />
• ätzend,<br />
• nicht einnehmen,<br />
• Haut- und Augenkontakt vermeiden<br />
Amidosulfonsäure (Amidoschwefelsäure,<br />
Sulfaminsäure): H2N–SO2–OH<br />
Abbildung 3: Beispiele von Stoffen im Haushalt, die Hinweise auf deren Gefährlichkeit haben<br />
Chemie Bützer
1.4 Definition eines Pharmakons<br />
2 Lüllmann H., Mohr K., Ziegler A., Taschenbuch der Pharmakologie, Georg Thieme Verlag<br />
Stuttgart/New York, 1994, 279<br />
3 Enck P., Deutsche Medizinische Wochenschrift 130: 1934 (2005), Abstract<br />
4 Zubieta J.K, Journal of Neuroscience 25(34) (2005), zitiert in wissenschaft-online 26.08.2005<br />
5 Petrovic P., Neuron 46: 957-969 (2005) , zitiert in wissenschaft-online 15.06.2005<br />
Chemie Bützer<br />
7<br />
Man bezeichnet einen Stoff (Element, chemische Verbindung) als Pharmaka,<br />
wenn er:<br />
1. in einem bestimmten biologischen System (Mensch, Tier, Organ, Zelle)<br />
2. bei Zufuhr in bestimmten Dosen, auf bestimmten Wegen und in bestimmten<br />
Zeitabständen,<br />
3. zur Prophylaxe, Diagnose oder Therapie geeignet ist.<br />
Notwendige Bedingungen für die Eignung sind:<br />
1. Die erwünschte prophylaktische, diagnostische oder therapeutische Wirkung<br />
muss als biologische Wirkung erwiesen sein.<br />
2. Die unerwünschten zusätzlichen Wirkungen dürfen den Einsatz des Stoffes für<br />
prophylaktische, diagnostische oder therapeutische Zwecke nicht ausschliessen.<br />
Eine biologische Wirkung eines Pharmakons oder eines Giftes ist:<br />
1. Eine Änderung des Ausgangszustandes des biologischen Systems,<br />
2. ursächlich bedingt durch Art, Dosis und Applikationsform des Stoffes;<br />
3. qualitativ und quantitativ definierbar (und daher reproduzierbar).<br />
Daraus folgt, dass Wirkungen durch psychologische <strong>Effekte</strong>, die durchaus<br />
dosisunabhängig (z.B. Placebo) auftreten können, werden nach dieser Definition nicht<br />
als biologische Wirkung von Pharmaka oder Giften angesehen werden.<br />
Placebowirkungen sind immer wieder überraschend.<br />
Placebogaben rufen nicht nur günstige, sondern auch ungünstige psychische und<br />
physische <strong>Effekte</strong> hervor. Nach Placebogaben beobachtete man in zahlreichen<br />
Untersuchungen Nebenwirkungen, die wohl nicht bedenklich waren, welche aber nach<br />
der Einnahme von wirksamen Pharmaka häufig als störend beschrieben werden. In<br />
einer Beobachtungsreihe kam es in 10% bis 25% der Fälle zu trockenem Mund,<br />
Nausea, Schweregefühl, Schwierigkeiten sich zu konzentrieren, Schläfrigkeit,<br />
Kopfschmerzen und sogar in 50% zu Dösigkeit 2 . Die Häufigkeit der Nebenwirkungen ist<br />
abhängig davon, ob die Patienten überhaupt nach Nebenwirkungen befragt wurden und<br />
wie diese Befragung erfolgte. Die Wirkung von Placebos wird sogar vom Geschlecht<br />
der Ärzte und Patienten mitbestimmt! 3<br />
Unter diesem Gesichtspunkt sind homöopathische Mittel zu befürworten, da sie keine<br />
Haupt- und Nebenwirkungen besitzen und in stark suggestiver Weise verordnet und mit<br />
besonderen Erwartungen entgegengenommen werden – bei genügend kleinen Dosen<br />
werden keine direkten biochemischen Wirkungen, aber auch keine entsprechenden<br />
Nebenwirkungen erwartet.<br />
Mit Positronen-Emissions-Tomografie (PET) ist der Nachweis gelungen, dass Placebos<br />
im Gehirn die Ausschüttung von körpereigenen Schmerzmitteln, den Endorphinen,<br />
anregen. Damit ist ein Zusammenhang zwischen Placebo-Effekt und biochemischen<br />
Prozessen wissenschaftlich bestätigt 4 . Ebenfalls gelang es zu zeigen, dass Placebos<br />
die Hirnaktivität zur Vermeidung unangenehmer Gefühle steigern können 5 - wobei die<br />
entsprechende Erwartungshaltung Positronen-Emissions-Tomografen (PET) von<br />
besonders hoher Bedeutung war.
Eine Auswertung von vielen Studien hat bestätigt, dass homöopathische Mittel nicht<br />
mehr Wirkung zeigen als Placebos 6 .<br />
Eine quantitative Abschätzung:<br />
8<br />
Ein Mol eines Wirkstoffs enthält N A =6.022•10 23 Moleküle. Das sind bei einer Dosis von<br />
m=1 mg und einer Molmasse von M=200 g/mol N = n•N A =m/M•N A =<br />
0.001/200•6.022•10 23 = 3•10 18 Moleküle. Der Mensch enthält etwa 3•10 13 Zellen 7 .<br />
Somit kommen bei gleichmässiger Verteilung auf eine Zelle 10 5 Wirkstoffmoleküle.<br />
Diese einfache Abschätzung weist darauf hin, dass strukturspezifische <strong>Wirkstoffe</strong><br />
bevorzugt in spezifischen Zellen reagieren.<br />
2 Gifte<br />
Definition von Gift<br />
Als Gifte gelten unbelebte Stoffe und daraus hergestellte Erzeugnisse die, vom Körper<br />
aufgenommen oder mit ihm in Berührung gebracht, schon in verhältnismässig geringen<br />
Mengen durch chemische oder chemisch- physikalische Wirkung das Leben oder die<br />
Gesundheit von Menschen und Tieren gefährden können und deren Handhabung daher<br />
besondere Vorsicht verlangt.<br />
Tabelle 2: Beispiele von natürlichen toxischen Inhaltsstoffen in Lebensmitteln<br />
Inhaltsstoff Vorkommen<br />
Wirkung<br />
Amygdalin (Glucosid) bittere Mandeln bildet Blausäure<br />
60 Bittermandeln tödlich (Erwachsene)<br />
5-10 tödl. Kind od. 10 Tropfen<br />
Bittermandelöl<br />
Glucobrassicin Kohlarten bildet Rhodanid (SCN<br />
(Glucosid)<br />
- ) und andere<br />
kropfbildenden Substanzen<br />
Solanin Kartoffeln Kratzen im Hals, Bauchschmerzen,<br />
Durchfälle (tox. Dosis ca. 25 mg)<br />
Oxalsäure Rhabarber, Spinat Gastroenteritis, Nierensteine<br />
Myristicin Muskatnuss Halluzinationen, Dellirium<br />
Tyramin, Histamin Käse, Wein Kopfschmerzen, Bluthochdruck<br />
(biogene Amine)<br />
Saxitoxin Muscheln, Austern,<br />
die sich von<br />
bestimmten Algen<br />
ernähren<br />
Siehe auch: Toxikologie der Nahrungsmittel 8<br />
starkes Nervengift, verursacht<br />
Lähmungen<br />
6 Eggert M. et al., The Lancet 366: 726-732 (2005), zitiert in wissenschaft-online 26.08.2005<br />
7 Korolkovas A., Grundlagen der molekularen Pharmakologie, Georg Thieme Verlag Stuttgart, 1974, 275<br />
8 Lindner E., Toxikologie der Nahrungsmittel, Georg Thieme Verlag, Stuttgart, 1979<br />
Chemie Bützer
Tabelle 3: Ein harmloser Tee?<br />
Heilkraut<br />
Chemie Bützer<br />
9<br />
Heilwirkung als Tee Schadwirkung bei Dauergebrauch<br />
Pfefferminze Magen- und<br />
Darmstörungen,<br />
Gallenbeschwerden<br />
Kamille Entzündungen vor allem im<br />
Magen- Darmbereich<br />
Verdauungsenzyme werden in ihrer<br />
Wirkung vermindert<br />
Störung des biologischen Gleichgewichts,<br />
z.T. nervöse Herzstörungen<br />
Thymian Husten Störung der Schilddrüsenfunktion<br />
Trotz diesen Giften als Inhaltsstoffe, können wir diese Nahrungsmitteln essen, aber:<br />
• "Allzu viel ist ungesund",<br />
• "Zuwenig und zu viel - ist beides Narrenspiel" und<br />
• Die Wissenschaft kann nie die Nichtexistenz einer Vergiftung nachweisen.<br />
Die erwünschte pharmakologische Wirkung mit der Dosierung im sogenannten<br />
„therapeutischen Fesnter“ und die unerwünschte toxische Wirkung stehen oft im<br />
Verhältnis eines stetigen Übergangs.<br />
Baumwolle als Gefährdung?<br />
Gifte können sich auch bei so genannten Naturprodukten zeigen. Die Byssinose<br />
(griechisch Byssos Baumwolle, Flachs) ist eine charakteristische, chronische<br />
Berufskrankheit der Atemorgane bei Baumwoll-, Hanf- und FlachsarbeiterInnen. Bei<br />
HanfarbeiterInnen heisst sie auch Cannabinose, bei FlachsarbeiterInnen Linose. Die<br />
Byssinose kommt in den Produktionsländern sehr häufig vor. Eine ägyptische Umfrage<br />
beziffert den Anteil der in der Baumwollernte beschäftigten Personen, welche die<br />
Symptome einer Byssinose angeben, auf 38%. In Westeuropa hängt die Häufigkeit<br />
beim Umgang mit Baumwolle von der Baumwollsorte ab. Die Durchschnittszahlen<br />
schwanken nach Angaben der SUVA zwischen 20% und 40%. Die schlechtesten<br />
Qualitäten sind mit den grössten Erkrankungsziffern, bis 60%, verbunden. Die<br />
Symptome zeigen sich beim Menschen bei einer Exposition von ca. 10 Jahren, nach<br />
einer Einwirkungszeit von 20 Minuten als beengendes Gefühl auf der Brust, Abnahme<br />
des maximalen Expirationsvolumens und einer Ungleichheit der Lungenbelüftung.<br />
Montags, am Ende des Vormittags oder am Nachmittag stellt sich das beengende<br />
Gefühl auf der Brust ein, daher der Name "Montagsdyspnoe". Die Beschwerden<br />
kommen immer nach den Ferien und nach jedem Arbeitsunterbruch. Gibt der Patient im<br />
fortgeschrittenen Stadium die Arbeit mit der Baumwollstaubbelastung auf, verschwinden<br />
die Anfälle von Atemnot, eine Ventilationsstörung (obstruktives Syndrom) bleibt aber<br />
bestehen. In England wurden seit ca. 30 Jahren mehrere tausend Renten wegen<br />
respiratorischer Invalidität durch Byssinose ausgerichtet, und pro Jahr kommen 200 bis<br />
300 neue Fälle dazu. Untersuchungen in Lancashire zeigen, dass die kardio-<br />
respiratorische Mortalität bei Arbeitern der Textilindustrie doppelt so gross ist, wie<br />
beider übrigen Bevölkerung. Spanische Vergleichsuntersuchungen haben bei<br />
Flachsarbeitern eine kürzere Lebenserwartung als bei der übrigen Bevölkerung<br />
gefunden.<br />
Je höher die Dosis, desto stärker die Wirkung (aber auch die Nebenwirkungen).<br />
Die Dosisabhängigkeit des Effekts gilt auch für Mikroorganismen (Viren, Bakterien,<br />
Pilze).
10<br />
Beispiel Mikroorganismen:<br />
Wenn ein gesunder Körper mit der Nahrung 1000 Salmonellen aufnimmt, wird<br />
der Körper mit diesen Stäbchenbakterien spielend fertig. Ab 10'000 ist es nicht<br />
mehr so gemütlich, sind 100'000 im Spiel, reagieren wir mit Durchfall und sind<br />
ernsthaft krank – allein die Anzahl (Dosis) macht, dass Bakterien gefährlich sind. Für<br />
Viren und Bakterien liegen die kleinsten Infektionswerte, welche eigentlich den LDLo-<br />
Werten entsprechen, im Bereich von 10 -8 g (Bakterien) bis 10 -14 g(kleine Viren) 9 .<br />
Folgerung:<br />
Molekular funktionieren alle <strong>Wirkstoffe</strong> im Prinzip gleich, ob es sich um Drogen, Gifte,<br />
Doping oder Heilmittel handelt – nur die Folgen sind verschieden.<br />
Wie unterscheiden sich Gifte und Pharmaka?<br />
Bei Giften ist der Schaden grösser als der Nutzen, bei Pharmaka ist der Nutzen grösser<br />
als der Schaden.<br />
Wer die chemischen Eigenschaften einer Substanz kennt, kann deren Wirkungen bis zu<br />
einem gewissen Mass vorhersagen (Struktur-Aktivitäts-Beziehung; Structure-Activity-<br />
Relationship SAR oder Quantitative Structure-Activity Relationship: QSAR). Zur<br />
Unterstützung dieser Beurteilungen werden heute Computerprogramme verwendet,<br />
welche aus den Strukturen die Reaktionen ableiten.<br />
9 Koop N., ABC Abwehr in der erweiterten Luftverteidigung, Forum ABC Abwehr und Schutzaufgaben,<br />
Bonn 2001<br />
Chemie Bützer
11<br />
Welches sind chemische Voraussetzungen, damit eine Substanz gefährlich ist? (Wann<br />
ist eine Substanz physiologisch wirksam?)<br />
1. Ungewöhnliche Oxidationszahlen (reaktiv): Wasserstoffperoxid, Kohlenmonoxid,<br />
Hypochlorite, Nitrite, Chlorate. Verbindungen zwischen elektronegativen Elementen:<br />
Ozon, Peroxide, Fluor, Chlor, Brom, Iod, Phosgen, Isocyanate, Cyanide, Stickoxide,<br />
Schwefeloxide, Chloroxide..<br />
2. Sehr grosse chemische Reaktivität: Starke Säuren/Basen, Stoffe mit sehr grossem<br />
Wasserbindungsvermögen, konz. Säuren/Basen, Alkalimetalle, Halogene, spez.<br />
Modifikationen wie weisser Phosphor, Säurechloride etc.<br />
3. Gespannte Verbindungen: Drei-, Vierringe.<br />
4. Hoher Dampfdruck: Wasserstoff, Ammoniak, Chlor, Ozon, Brom, Quecksilber. Fein<br />
verteilte Stoffe (grosse Oberfläche: Nickel, Eisen, Paladium, Holz, Mehl,<br />
Medikamente..)<br />
5. Ausgeprägte Elektrophilie (mutagen, carcinogen): Epoxide, Azirine, N-Nitrosamine,<br />
Alkylierungsmittel, Dreiringe mit einem Element mit EN>2.6.<br />
6. Lipophile Stoffe (fettlösliche Stoffe): Tetrachlorkohlenstoff, Benzol, DDT, Vinylchlorid,<br />
je mehr Halogene desto toxischer (mit Ausnahmen), vor allem als schwache Basen<br />
(Amine).<br />
7. Schwache Basen (Amine)<br />
8. Polare Stoffe in unpolarer Umgebung.<br />
Eine Kombination der obigen Eigenschaften vergrössert die Gefährdung.<br />
schwach<br />
basisch<br />
elektrophil<br />
lipophil<br />
gasförmig<br />
fein verteilt<br />
reaktiv<br />
Abbildung 4: Wichtige Parameter, welche die Reaktivität einer Substanz beeinflussen<br />
Chemie Bützer
12<br />
Die gegenseitige Beeinflussung der Parameter kann mit dem Sensitivitätsmodell nach<br />
Vester 10, 11 recht gut abeschätzt werden. Für unser Betrachtung sollen nebst der Wirksamkeit<br />
nur gerade 5 Parameter berücksichtigt werden.<br />
Die erwartete Kopplung wird in 5 Stufen eingeteilt:<br />
0: keine, 1: mögliche; 2: erkennbare; 3: wichtige; 4: dominante Kopplung<br />
Es wird nur die direkte Beeinflussung der Parameter in den Zeilen auf die beurteilten<br />
Parameter in den Kolonnen zugelassen.<br />
Tabelle 4: Wirkung der Parameter<br />
von/auf �<br />
�<br />
Reaktivität<br />
Polarität<br />
Lipophilie<br />
Basizität<br />
Reaktivität ------ 0 0 0 4 4 8.0 1.0<br />
Polarität 2 ------ 4 1 3 3 13.0 2.2<br />
Lipophilie 0 4 ------ 1 3 3 11.0 1.6<br />
Basizität 2 2 1 ------ 1 3 9.0 4.5 aktiv<br />
Persistenz 4 0 2 0 ------ 3 9.0 0.8<br />
Wirksamkeit 0 0 0 0 1 ------ 1.0 0.1 reaktiv<br />
PS 8 6 7 2 12 16<br />
P = AS x PS/10 6.4 7.8 7.7 1.8 10.8 1.6<br />
kritisch puffernd<br />
Tabelle 5: Interpretation<br />
Kybernetische<br />
Rolle<br />
Charakteristik Bemerkungen<br />
Aktivsumme Beeinflusst die andern Diese Summe gibt an, wie aktiv ein Parameter auf andere<br />
(grösste AS) Parameter am stärksten wirkt (aktives Verhalten).<br />
Passivsumme Wird von den andern Diese Summe gibt an, wie stark dieser Parameter von<br />
(grösste PS) Parametern am stärksten<br />
beeinflusst<br />
anderen beeinflusst wird (passives Verhalten).<br />
aktives Viele Einflüsse gehen aus Hat stabilisierenden Einfluss.<br />
Element Wenige Einflüsse gehen ein Ist nicht leicht aus dem System heraus als Hebel zu<br />
(höchstes Q)<br />
verwenden. Wenn es sich verändert, ergeben sich<br />
nachhaltige Auswirkungen auf das Systemverhalten.<br />
reaktives Wenige Einflüsse gehen aus Guter Indikator.<br />
Element Viele Einflüsse gehen ein Diesen zu verändern ist Symptombehandlung und bringt<br />
(niedrigstes Q)<br />
für die Gesamtkonstellation des System nichts.<br />
kritisches Viele Einflüsse gehen aus Kann gut als Hebel für Veränderungen verwendet werden.<br />
Element Viele Einflüsse gehen ein Veränderungen mit diesem Element sind kontrolliert<br />
(höchstes P)<br />
durchzuführen, da sich die Entwicklung sonst<br />
aufschaukeln könnten.<br />
pufferndes Wenige Einflüsse gehen aus Einwirkungen auf diese Komponente wirken sich nicht<br />
Element Wenige Einflüsse gehen ein oder nur sehr träge aus. Vorsicht ist geboten, wenn diese<br />
(niedrigstes P)<br />
Elemente direkt und stark auf andere aktive oder kritische<br />
Elemente wirken („Wolf-im-Schafpelz“-Verhalten).<br />
10 Vester F., Die Kunst vernetzt zu denken, Deutsche Verlags-Anstalt GmbH, Stuttgart, 1999, 155ff<br />
11 Ulrich H., Probst G.J.B., Anleitung zum ganzheitlichen Denken und Handeln, Verlag Paul Haupt, Bern,<br />
1990<br />
Chemie Bützer<br />
Persistenz<br />
Wirksamkei<br />
t<br />
AS<br />
Q = AS/PS
2.1 Die biologische Wirkung<br />
« Savoir pour prévoir,<br />
prévoir pour prevenir. »<br />
(A. Compte)<br />
13<br />
<strong>Wirkstoffe</strong> sind immer Substanzen, welche chemische Besonderheiten aufweisen.<br />
Diese lassen sich erfassen und beschreiben. Erst der molekulare Zusammenhang mit<br />
der biologischen Wirkung (Enzyme, Zellen, Organe, Lebewesen, Gemeinschaften etc.)<br />
erlaubt uns aber, Vorhersagen im wissenschaftlichen Sinne zu machen.<br />
Dosis<br />
Pharmakon<br />
Resorption<br />
Abbau durch<br />
Biotransformation<br />
Transportform<br />
Wirkform<br />
Aktivierung durch<br />
Biotransformation<br />
Extrazelluläre Flüssigkeit<br />
Eiweissbindung<br />
Transport<br />
Bindung im<br />
Gewebe<br />
Ausscheidung<br />
Wirkorte für<br />
Nebenwirkungen<br />
Wirkung<br />
Dosis- Effekt-<br />
Beziehung<br />
Wirkorte für<br />
erwünschte Wirkungen<br />
Abbildung 5: Einige wichtige Grundprozesse für die Wirkung eines Pharmakons<br />
Dosis- Effekt-<br />
Beziehung<br />
Nebenwirkung<br />
Der Stoffwechsel, Metabolismus, ist bedeutsam und damit die Leber als wichtigstes<br />
Organ für chemische Reaktionen. Auch das Ausscheidungsorgan für polare Stoffe, die<br />
Niere hat einen grossen Einfluss auf die Wirkung und kann durch <strong>Wirkstoffe</strong> betroffen<br />
sein (Glomeruli als harnbildende, Tubuli als rückresorbierende Strukturen).<br />
Sehr wichtig für das Verständnis der Wirkung von Substanzen sind die molekularen<br />
Eigenschaften wie:<br />
• Molmasse<br />
• Fettlöslichkeit<br />
• Proteinbindung<br />
• Clearance (Abbaugeschwindigkeit in Leber und Ausscheidungsgeschwindigkeit<br />
in Niere)<br />
Manchmal bilden sich die wirksamen Substanzen erst als Metaboliten. Das war<br />
beispielsweise bei der Entdeckung einer therapeutisch wichtigen Substanzklasse gegen<br />
bakterielle Infektionen der Fall, bei den<br />
Chemie Bützer
Sulfonamiden:<br />
1932 untersuchte Gerhard Domagk einen roten Farbstoff auf seine Wirkung gegen<br />
Bakterien: Prontosil. Das ist nicht verwunderlich, werden doch einige Farbstoffe zum<br />
spezifischen anfärben von Bakterien in Kulturen verwendet.<br />
14<br />
Dieser war in vitro, in einer Bakterienkultur nicht wirksam, wohl aber in Lebewesen, in<br />
vivo !!!<br />
gegen Bakterien<br />
wirksamer Metabolit<br />
Spaltung im Körper<br />
N N<br />
unwirksam<br />
N<br />
N S N<br />
Prontosil<br />
O<br />
O<br />
N S N<br />
Sulfanilamid<br />
Abbildung 6: Aus einem unwirksamen Farbstoff Prontosil wird im Körper der gegen Bakterien<br />
wirksame Metabolit Sulfanilamid gebildet.<br />
Die Erklärung muss beim Stoffwechsel des Menschen gesucht werden. In vitro, als in<br />
Bakterienkulturen ist Pronosil somit nicht wirksam – das zeigt die Notwendigkeit von in<br />
vivo Tests.<br />
H2N<br />
HN<br />
2<br />
O<br />
N<br />
1<br />
4<br />
Pteroinsäure L -Glutaminsäure<br />
5<br />
N<br />
N<br />
8<br />
6<br />
7<br />
10<br />
HN<br />
9<br />
O COOH<br />
N<br />
H<br />
H<br />
4-Aminobenzoesäure<br />
O<br />
O<br />
COOH<br />
Abbildung 7: p-Aminobenoesäure wird von den Bakterien zum Aufbau der Folsäure benötigt.<br />
Bakterien können selbst Folsäure (einen Vertreter des Vitamin B- Komplexes) herstellen.<br />
Sie benötigen dazu 4-Aminobenzoesäure = p-Aminobenzoesäure (PAB). Das<br />
Sulfanilamid wird bei dieser Synthese mit der PAB verwechselt, der Stoffwechsel der<br />
Bakterien kommt zum erliegen.<br />
Chemie Bützer
15<br />
Manchmal ist es gar nicht einfach, die Ursache mit der Wirkung in einen kausalen<br />
Zusammenhang zu bringen. Wenn Vögel tot vom Himmel fallen und hohe Pestizidkonzentrationen<br />
im ZNS gefunden werden, ist ein Kausalzusammenhang relativ leicht<br />
herzustellen. Oft ist der Zusammenhang zwischen Pestizidexposition und toxischen<br />
Wirkungen komplizierter. Dazu ein Beispiel: 1974 wurden im Staate Missouri der USA<br />
Blau- und Schneegänse mit Vergiftungserscheinungen und hohen Konzentrationen von<br />
Dieldrin (Organochlorpestizid) im Hirn gefunden, obwohl in diesem Staate kein Dieldrin<br />
eingesetzt worden war.<br />
Die Exposition der Vögel fand 1000 km südlich statt, wo Dieldrin für die Behandlung von<br />
Reissaatgut eingesetzt worden war. Dieldrin wurde von diesen Vögeln in relativ hohen<br />
Konzentrationen im Fett eingelagert. Durch Fettmobilisation während des 1000 km<br />
langen Fluges nach Norden entstanden hohe Blutkonzentrationen mit den<br />
entsprechenden toxischen Konsequenzen.<br />
2.2 Faktoren, welche die Wirkung wesentlich beeinflussen können<br />
• Individuelle Unterschiede (Konstitution),<br />
• Geschlechtsunterschiede 12 (bekannt bei Schmerzmitteln etc.)<br />
• Gesundheitszustand, Befindlichkeit,<br />
• tägliche Schwankungen, Biorhythmen,<br />
• Unterschiede in der Ernährung (Bsp.: Eisen mit Vitamin C, Vitamin A mit Fetten..)<br />
• Unterschiede im Verhalten (Sport, Ruhe..),<br />
• Umwelt (Wärme, Kälte..),<br />
• Konzentration, Dauer (wie viel, wie lange, wie häufig...), Expositionshöhe,<br />
• Expositionsweg,<br />
• etc.<br />
Einfluss der Ernährung (zwei ausgewählte Beispiele):<br />
Fast alle Blutdrucksenker, Immunosuppresiva, Beruhigungsmittel etc. werden<br />
wesentlich besser aufgenommen, wenn man sie mit einen Glas Grapefruitsaft einnimmt.<br />
Grapefruitsaft blockiert im Dünndarm das Enzym CYP3A4, welches ganz bestimmte<br />
Medikamente abbauen kann. Da nicht alle Menschen gleichviel von diesem Enzym<br />
haben, wird bei diesen auch eine unterschiedliche Dosis aufgenommen. Zusammen mit<br />
Grapefruitsaft ist das nicht mehr der Fall 13 .<br />
Knoblauch kann den Blutspiegel des HIV-Medikaments Saquinavir um bis zu 50%<br />
senken, und damit die Therapie beeinträchtigen 14 .<br />
Milchprodukte können bei gleichzeitiger Einnahme mit ihren Eiweissen gewisse<br />
Antibiotika binden und somit die Aufnahme beeinträchtigen. Die Serumspiegel sind<br />
dann zu tief und die Therapie ist gefährdet.<br />
Das obige Beispiel des Einflusses von Lebensmitteln zeigt, dass es praktisch unmöglich<br />
ist alle wichtigen Wechselwirkungen mit Sicherheit zu erfassen. Andererseits müssen<br />
12 Melton L., His Pain, her Pain, New Scientist, 19 January, 2002, 32<br />
13 Barbara Kunz, NZZ Mittwoch 23.Juli 1997, Nr.168, S.17, zitiert aus J. of Clinical Investigation 99 2545-<br />
2553 (1997)<br />
14 Lahrtz S., Knoblauch beeinflusst HIV-Medikamente, NZZ, Mittwoch, 16. Januar, 2002, Nr. 12, S.48<br />
Chemie Bützer
16<br />
bei Experimenten viele Parameter fest gehalten werden. Somit hat die Übertragung von<br />
experimentellen Daten sehr sorgfältig zu erfolgen. Nicht nur die Statistik ist zu<br />
berücksichtigen (Streuungen, Messfehler), auch individuelle Unterschiede der<br />
Lebewesen können die Aussagen entscheidend beeinflussen (Extremfälle).<br />
Schlaf<br />
tritt ein<br />
if<br />
echt<br />
positiver Befund<br />
Wirkung<br />
durch das Mittel<br />
Übertragung von Befunden auf den Menschen<br />
am Beispiel eines Schlafmittels<br />
if Schlafmittel<br />
wird gegeben<br />
then else<br />
then else<br />
falsch<br />
positiver Befund<br />
- sonst müde<br />
- anderer Wirkstoff<br />
kein Schlaf<br />
tritt ein<br />
if<br />
echt<br />
negativer Befund<br />
Mittel<br />
wirkt nicht<br />
then else<br />
falsch<br />
negativer Befund<br />
- Unempfindliche Person<br />
- falsche Dosierung<br />
- zu munter<br />
- anderes Mittel weckt<br />
- Inhibitor in der Nahrung<br />
Abbildung 8: Struktogramm einer Abklärung der Wirksamkeit, Beurteilung von Befunden<br />
(Beobachtungen)<br />
Diese Beurteilung der Befunde hat eine besonders grosse Bedeutung bei der<br />
Übertragung von Resultaten von Untersuchungen bei Tieren auf den Menschen.<br />
Chemie Bützer<br />
Es ist wichtig sich klarzumachen, dass in vielen Situationen die Weigerung zu<br />
handeln selbst einer Handlung gleichkommt.<br />
(Karl R. Popper, Objektive Erkenntnis, campe, 1974)
Wirklichkeit<br />
positiv<br />
negativ<br />
positiv<br />
I<br />
17<br />
III<br />
falsch positiv<br />
Testergebnisse<br />
negativ<br />
II<br />
falsch negativ<br />
Berechnung Bezeichnung Interpretation<br />
I+II+III+IV Summe<br />
I/(I+II) Sensitivität Anteil, mit dem ein vorhandenes Merkmal erfasst werden kann<br />
Anteil, mit dem ein nicht vorhandenes Merkmal erfasst werden<br />
IV/(III+IV) Spezifität<br />
Vorhersage-<br />
kann<br />
I/(I+III) wert Richtige Ergebnisse und keine falsch positiven Resultate<br />
(I+II)/Summe Prävalenz<br />
(I+IV)/Summ<br />
Positive Ergebnisse im Vergleich zur Gesamtzahl<br />
e Konkordanz Richtige Ergebnisse im Vergleich zur Gesamtzahl<br />
Abbildung 9: Interpretation von Wirkstoffprüfungen<br />
3 Geruch, eine molekulare Wirkung<br />
Die Wahrnehmung von Gerüchen mit den Riechkolben in der Nase führt zu<br />
Informationen unmittelbar im limbischen System, einem archaischen Teil des Gehirns,<br />
wo auch Gefühle zu Hause sind und das Gedächtnis mitgeformt wird. Diese<br />
physiologische Nähe zur Welt der Emotionen und Erinnerungen macht verständlich,<br />
weshalb uns ein bestimmter Geruch urplötzlich mit grösster Deutlichkeit längst<br />
Vergessenes zurückbringen kann. Gerüche können uns enorm beglücken oder aber<br />
auch zutiefst ängstigen. Dass Gerüche für uns, wenn auch meist verdrängt, wichtig sein<br />
müssen lässt sich aus folgender Erkenntnis ableiten: Nicht weniger als ein Prozent der<br />
gesamten Gene ist wahrscheinlich für die Produktion von ca. 2000 Rezeptoren<br />
reserviert, die Geruchstoffe binden 15 . Der Gesamteindruck kommt als Kombination der<br />
verschiedenen Signale zustande 16 . Die Leistung unserer Nase ist beeindruckend,<br />
können wir doch – vielleicht erst mit Übung – bis 10’000 Gerüche unterscheiden 17 .<br />
Schlechte Gerüche verbinden wir meist mit schlechten Empfindungen, starke unbekannte<br />
Gerüche erzeugen oft Angst, kurz: Widerliche Gerüche erzeugen in<br />
genügend hohen Konzentrationen Angst – Warneigenschaft. Wird diese<br />
Empfindung gar mit einem an sich schon unheimlichen Eindruck eines ungewöhnlichen<br />
Ereignisses verbunden, dann sind panische Reaktionen zu erwarten - die instinktive,<br />
emotionale Reaktion schliesst eine rationale Beurteilung oftmals aus.<br />
Als am Montag 16. August 1999 im Senats Gebäude in Washington ein ungewöhnlicher,<br />
wenig intensiver Geruch auftrat, kam die Diskussion auf, ob es sich um<br />
einen Terror-Gas-Angriff handeln könnte. Irgend jemand gab Alarm. Die Bewohner<br />
15 Axel R., Spektrum der Wissenschaft, Dezember 1995, 72<br />
16 Axel R., Buck L.B., Nobelpreis in Medizin und Physiologie 2004<br />
17 Stahl-Bishop E., Reher G., Geschmack und Geruch, Deutsche Apotheker Zeitung, 127. Jg., Nr. 48,<br />
1987, 2529<br />
Chemie Bützer<br />
IV
18<br />
flohen, Polizei, Ärzte und Feuerwehr kamen vor Ort. Schliesslich fand man einen Sack<br />
in der Cafeteria mit geschälten und geschnittenen Zwiebeln, die für den Salat gerichtet<br />
aber vergessen worden waren und nun verrotteten. Hätten die Personen den Geruch<br />
identifizieren können, wäre keine Panik ausgebrochen, oder wie der Psychologe Pan<br />
Dalton meinte 18 : „But when people don’t recognise a smell they assume it’s a hazard.“<br />
Folgerung:<br />
Rasch auftretende, unbekannte Gerüche werden meist mit Gefahr assoziiert.<br />
Dass die Geruchswahrnehmung eine Warnung sein kann, ist beim praktisch<br />
geruchsfreien Erdgas umgesetzt worden, indem absichtlich THT<br />
(Tetrahydrothiophen) als Odorierungsmittel zugesetzt wird.<br />
3.1.1 Geruchsempfindung 19,20<br />
Es scheint, als ob uns Gerüche unmittelbarer und tiefer ansprechen als andere<br />
Sinneseindrücke. Das wollte der französische Schriftsteller Marcel Proust (1871 bis<br />
1922) in seinem wichtigen, halbautobiographischen Roman "Auf der Suche nach der<br />
verlorenen Zeit” fassen, als er die Schlüsselszene reflektierte, die ihm "die Wahrheit, die<br />
ich suche", erschloss: als er "einen Löffel Tee mit dem aufgeweichten kleinen Stück<br />
Madeleine darin" an die Lippen führte und sich urplötzlich Erinnerungen an die Kindheit<br />
wieder einstellten. Geschmack und Geruch, fuhr er fort, seien die Sinne, die "allein,<br />
zerbrechlicher, aber lebendiger, immateriell und doch haltbar, beständig und treu ... in<br />
einem beinahe unwirklich winzigen Tröpfchen das unermessliche Gebäude der<br />
Erinnerung unfehlbar in sich tragen".<br />
Wie stark der Geruchsinn beim Kind das Unterbewussten ist, zeigt nicht zuletzt die<br />
verbale Hilflosigkeit im Umgang mit Geruchsempfindungen. Im Deutschschweizer<br />
Dialekt sagen wir es „schmeckt“ nach Heu und geben damit zu erkennen, dass wir<br />
Geruch und Geschmack nicht einmal unterscheiden. Wir können Farben und Töne<br />
mehr oder weniger präzis benennen und stehen ausserdem mit Wellenlänge, Amplitude<br />
und Frequenzspektrum physikalisch wohldefinierte Parameter zur Verfügung, in der<br />
Welt der Gerüche bleibt selbst den Fachleuten nur der Weg mehr oder weniger diffuser<br />
Umschreibung. So benutzt der Parfumeur Listen mit Ausdrücken wie „kaffeeartig“,<br />
„suppig“, „seilartig“ und kann durchaus bei Bezeichnungen wie „dreckige Wäsche“ oder<br />
„nasser Hund“ landen. Spannend sind schliesslich die verbalen Bemühungen, denen<br />
wir in den Katalogen der Weinhändler begegnen. Die Ohnmacht im Umgang mit dem<br />
Geruchsinn ist noch akzentuiert durch den physiologischen Umstand, dass auch unser<br />
„Schmecken“ weitgehend eine Domäne des Riechens ist. Denn unsere Zunge kann<br />
lediglich süss, sauer, salzig, bitter und umami unterscheiden, und die sensorische<br />
Hauptarbeit beim Essen wird über den Nasen-Rachen-Raum wiederum an das<br />
Riechorgan delegiert - die Deutschweizer Mundart scheint dies zufälligerweise(?) richtig<br />
auszudrücken, wenn das Essen schmeckt.<br />
18 Pain S., Stench Warfare, New Scientist, 7 July (2001) 44<br />
19 Stahl-Bishop E., Reher G., Geschmack und Geruch, Deutsche Apotheker Zeitung, 127. Kg., Nr. 48<br />
(1987) 2529<br />
20 Freeman W. J., Physiologie und Simulation der Geruchswahrnehmung, Spektrum der Wissenschaft,<br />
April (1991) 60-69<br />
Chemie Bützer<br />
S<br />
THT
Die Gerüche werden in unterschiedlichen Konzentrationen auch qualitativ unterschiedlich<br />
wahrgenommen. Sehr hohe Konzentrationen von an sich angenehmen<br />
Düften werden meist nicht geschätzt.<br />
3.1.2 Geruchsindentifikation<br />
Chemie Bützer<br />
19<br />
Die Gestalt der Geruchsmoleküle bestimmt den Geruch der betreffenden Substanz, die<br />
Moleküle ähnlich riechender Substanzen sind oft auch ähnlich geformt. Man kennt<br />
heute etwa 1 000 unterschiedliche Rezeptortypen und 1 000 zugehörige<br />
transmembrane Proteine. Wenn diese Rezeptoren in ihrer Struktur und mit ihren<br />
Bindungseigenschaften genau bekannt wären, könnte man eine wissenschaftlich,<br />
molekular begründete Klassierung der Gerüche vornehmen – doch das ist zur Zeit noch<br />
nicht möglich. Die sieben grundlegende Düfte: Campher, Moschus, blumig, Pfefferminz,<br />
etherisch, stechend (Essig) und faulig, können diesem Anspruch nicht gerecht werden.<br />
Die Erfahrung hat gezeigt, dass die meisten Leute bei der Beschreibung eines Geruchs<br />
automatisch von dem Gegenstand ausgehen, der ihn verursacht. Das ist verständlich,<br />
denn ausserhalb des Laboratoriums wird ein Geruch dadurch definiert, dass man ihn<br />
gleichzeitig sieht und riecht. Dinge, die verschieden aussehen, riechen im allgemeinen<br />
auch unterschiedlich. Wir unterscheiden den Apfel von der Banane und die Banane von<br />
der Zitrone, indem wir sie verschieden benennen. Aus demselben Grund geben wir<br />
auch Gerüchen unterschiedliche Bezeichnungen. Diese Namen bilden, nachdem sie<br />
einmal verschiedenen Gerüchen zugeordnet wurden, die einzig annehmbare Grundlage<br />
für eine Kategorisierung: Namen definieren Gerüche, setzen sie in Beziehung zu<br />
anderen Düften und geben ihnen eine „interne Adresse“, mit deren Hilfe wir sie aus dem<br />
Gedächtnis abrufen können.<br />
Wenn die Begriffe, die man Gerüchen zuordnet, wiedergegeben, wie und wie gut<br />
Geruch enkodiert (verschlüsselt) wurde, dann kann möglicherweise auch ein vorgegebener<br />
Begriff, sowohl die Geruchsempfindung als auch die spätere Erkennbarkeit<br />
beeinflussen. Allerdings dürfen solche Manipulationen nicht ganz willkürlich sein, wenn<br />
sie Erfolg haben sollen. Sie müssen dem Betroffenen sinnvoll erscheinen und sein<br />
vorhandenes, wenn auch vielleicht lückenhaftes Wissen berücksichtigen.<br />
Das simpelste Beispiel für unsere Beeinflussbarkeit ist die Tatsache, dass eine nur<br />
vage Geruchsempfindung Gestalt annimmt, sobald man ihr einen Namen gibt. Nehmen<br />
wir an, einer Testgruppe wird ein Gegenstand vorgelegt, den sie nach dem Geruch<br />
bestimmen soll. Die Teilnehmer stellen fest, es rieche „irgendwie“ nach Öl, nach<br />
Ziegenbock und nach „Fisch“. Fordert man sie nun auf, genau diese Bestimmung für<br />
spätere Testversuche im Gedächtnis zu behalten, fällt ihnen das meist sehr schwer.<br />
Finden sie jedoch spontan heraus, was es ist, oder sagt man ihnen direkt, dass es sich<br />
um Leder handelt, gewinnt ihre Wahrnehmung eine ganz andere Qualität: Der vage<br />
Eindruck verändert sich zur Wahrnehmung von typischem Ledergeruch.
3.1.3 Geruchsintensität<br />
20<br />
Der Geruchssinn folgt, wie alle anderen Sinne dem<br />
Weber-Fechner’schen Gesetz, das besagt, dass die<br />
Empfindungen logarithmisch sind. Die Erweiterung<br />
dieses Zusammenhangs ist das Gesetz von Stevens 21 ,<br />
welches als Potenzgesetz auch Exponenten k zulässt,<br />
die grösser oder kleiner als 1 sind:<br />
k<br />
I = c • S ;<br />
I: empfundene Intensität des Geruchs<br />
S: Stimulus (Anregung: hier Geruchsstoff-Konzentration)<br />
k: stoffspezifische Konstante (für Hexan z.B. 0.6)<br />
c: „Nullwert“ (falls der Stimulus S=0 ist I = c)<br />
Mit Schwellenwert So, wobei S ≥ So:<br />
k<br />
I = c • ( S − So)<br />
; (ist nicht ganz korrekt, weil bei S
22 Winter O., Grundlagen der Sensorik, Food Technology Magazin, Juni (1990) 6<br />
23 Richardson A., in Pybus D.H., Sell Ch.S. (ed.), The Chemistry of Fragnaces, The Royal Society of<br />
Chemistry, Letchworth, 1999, 148<br />
Chemie Bützer<br />
21<br />
Frauen können generell Gerüche besser identifizieren als Männer und sie (lernen)<br />
Gerüche schneller als ihre männlichen Konkurrenten. Zwar verbessert sich auch bei<br />
den Männern das Ergebnis mit Üben, doch können die Frauen ihren Vorsprung halten.<br />
Konzentrationssteigerungen von Duftstoffen werden nur schlecht wahrgenommen: Eine<br />
Erhöhung der Konzentration um ca. 20% wird im allgemeinen erst registriert 22 .<br />
Bedingt durch die logarithmische Empfindung, kann die Geruchsintensität mit einfachen<br />
Skala wiedergegeben werden:<br />
Tabelle 6: Intensitätsskala für Gerüche<br />
3.1.4 Geruchsschwellen<br />
Intensität<br />
Empfindung<br />
log(I)-log(c)<br />
0 Kein Geruch<br />
1 Sehr schwach (Schwelle)<br />
2 Schwach<br />
3 Mittel stark<br />
4 Stark<br />
5 Sehr stark<br />
Die schwächste noch wahrnehmbare Duftkonzentration eines Stoffes ist als<br />
Geruchsschwellenwert (detection threshold) definiert, während die geringste<br />
Konzentration für die Identifikation als Erkennungsschwellenwert oder<br />
Wahrnehmungsschwellenwert (recognition threshold) bezeichnet wird. Zusätzlich<br />
kennt man die Unterscheidung von zwei Gerüchen, deren kleinste Konzentrationen als<br />
Differenzschwellenwert 23 (difference threshold) bekannt ist.<br />
Tabelle 7: Geruchsschwellen einiger ausgewählter Substanzen<br />
Formel charakterisWahrErkennungstischer Geruch nehmungsschwelleschwelle (ppm)<br />
(ppm)<br />
c(Erkennung)/ Molc(Wahrmassenehmung)<br />
(g/mol)<br />
Acetaldehyd CH3CHO scharf, fruchtig 0.004 0.21 53 44.05<br />
Allylmerchaptan CH2CHCH2SH stark nach<br />
Knoblauch,<br />
Kaffee<br />
0.0005 --- 74.15<br />
Ammoniak NH3 scharf, stechend 0.037 46.8 1265 17.03<br />
Amylmerchaptan CH3(CH2)3CH2SH unangenehm,<br />
verfault<br />
0.0003 --- 104.22<br />
Benzyl- C6H5CH2SH stark 0.00019 --- 124.21<br />
Mercaptan<br />
unangenehm<br />
Butylamin C2H5CH2CH2NH2 sauer, ähnlich<br />
wie Ammoniak<br />
--- 0.24 73.14<br />
Cadaverin H2N(CH2)5NH2 verfault, --- --- 102.18
Chemie Bützer<br />
22<br />
Chlor Cl2<br />
verwesendes<br />
Fleisch<br />
streng,<br />
erstickend<br />
0.01 0.314 31 70.91<br />
Chlorophenol ClC6H5O medizinisch,<br />
phenolartig<br />
0.00018 --- 128.55<br />
Mercaptan Crotyl CH3CH:CHCH2S nach Stinktier 0.000029 --- 90.19<br />
Dibutylamin (C4H9)2NH fischig 0.016 --- 129.25<br />
Diisopropylamin (C3H7)2NH fischig 0.0035 0.085 24 101.19<br />
Dimethylamin (CH3)2NH verfault, fischig 0.047 0.047 1 45.08<br />
Dimethyl Sulfid (CH3)2S vergammelndes<br />
Gemüse<br />
0.001 0.001 1 62.13<br />
Diphenyl- Sulfid (C6H5)2S unangenehm 0.000048 0.0021 44 186.28<br />
Ethylamin C2H5NH2 nach Ammoniak 0.83 0.83 1 45.08<br />
Ethylmercaptan C2H5SH verfaulender<br />
Kohl<br />
0.00019 0.001 5 62.1<br />
Wasserstoffsulfid H2S faule Eier 0.00047 0.0047 10 34.1<br />
Indol C2H6NH2 ekelerregend --- --- 117.15<br />
Methylamin CH3NH2 verfault, fischig 0.021 0.021 1 31.05<br />
Methyl-<br />
Mercaptan<br />
CH3SH verfaulter Kohl 0.0011 0.0021 2 48.1<br />
Ozon O3 reizend über 2<br />
ppm<br />
0.001 --- 48<br />
Propyl-<br />
Mercaptan<br />
CH3CH2CH2SH unangenehm 0.000075 --- 76.16<br />
Putrescin NH2(CH2)4NH2 verfault,<br />
ekelerregend<br />
--- --- 88.15<br />
Pyridin C6H5N unangenehm,<br />
reizend<br />
0.0037 --- 79.1<br />
Skatole C9H9N fäkal,<br />
ekelerregend<br />
0.0012 0.47 392 131.2<br />
Schwefeldioxid SO2 scharf, reizend 0.009 --- 64.07<br />
CSH-tertbutyl (CH3)3CSH Stinktier,<br />
unangenehm<br />
0.00008 --- 90.19<br />
Thiocresol CH3C6H4SH Stinktier, ranzig 0.0001 --- 124.21<br />
Thiophenol C6H5SH verfault, nach<br />
Knoblauch<br />
Triethylamin (S2H5)3N nach Ammoniak,<br />
fischig<br />
0.000026 0.28 10769 110.18<br />
0.08 --- 101.19<br />
Mittelwert 84<br />
Stabw 37<br />
Der Wahrnehmungsschwellwert ist im Durchschnitt etwa um einen Faktor 80 tiefer, als<br />
der Erkennungsschwellwert - diese Feststellung gilt mit einer Standardabweichung von<br />
fast 40.<br />
Folgerung:<br />
Die Konzentration um eine Substanz in Luft zu erkennen (identifizieren) muss ca. um<br />
einen Faktor 80 höher sein als die Konzentration für eine undefinierte Wahrnehmung.
23<br />
Die mittlere Geruchsschwelle (olfactory threshold, die Wahrnehmungsschwelle) ist z.B.<br />
beim Menschen für Diethylether 0.75 ng/cm 3 Luft, für Vanillin 0.0000435 ng/cm 3 , oder<br />
Skatol 0.00035 ng/cm 3 24,25 . Die individuellen Streuungen der Empfindlichkeit beim<br />
Menschen sind meist sehr gross und können bei einfachsten Verbindungen wie<br />
Schwefelwasserstoff (H2S) 5, oder Methanol (CH3OH) gar 6 Potenzen betragen 26 . Dies<br />
lässt sich mit dem Weber - Fechner - Gesetz begründen, nachdem die<br />
Geruchsempfindung, wie die anderen physiologischen Reize, logarithmisch zum Reiz<br />
sind (Geruchsempfindung = log(c-c0), c0: Geruchsschwellwert). Individuelle Reaktionen<br />
auf bestimmte Gerüche sind bei solchen Streubreiten nicht möglich, wohl aber mittlere<br />
Angaben, bei welcher Konzentration bei einer Vielzahl von Personen mit<br />
Geruchsempfindungen gerechnet werden muss 27 .<br />
CH3-CH2-O-CH2-CH3<br />
CHO<br />
OCH 3<br />
Diethylether<br />
OH<br />
Vanillin Skatol<br />
4 Resorption von Substanzen<br />
Beliebige Substanzen können auf den Oberflächen wirken oder in den Stoffwechsel<br />
eintreten. Nebst den physikalischen Grössen wie Zeit, Temperatur und Oberfläche sind<br />
die chemischen Eigenschaften und die biologischen Vorgänge für die Resorption<br />
(Aufnahme, Invasion, Stoffaufnahme) bestimmend.<br />
Man kennt prinzipiell vier Möglichkeiten des Substanzdurchtritts durch eine Membran:<br />
1. (rein passive) Diffusion (Permeation),<br />
2. erleichterte (Carrier-vermittelte) Diffusion,<br />
3. aktiver Transport oder<br />
4. Pinocytose, Phagocytose und Persorption<br />
Passive Diffusion<br />
Stofftransport direkt proportional :<br />
• dem Konzentrationsgradienten,<br />
• der Membranfläche sowie<br />
• dem Verteilungskoeffizienten der betreffenden Substanz,<br />
• aber umgekehrt proportional der Membrandicke.<br />
Erleichterte Diffusion<br />
24 ROCHE Lexikon Medizin, Urban & SchwarzenbergMünchen, Wien, Baltimore, (1984) 1378<br />
25 Roussellin X., Falcy M., Le nez, les produits chimiques et la sécurité, INRS, Cahiers de notes<br />
documentaires n° 124, 3e trimestre, 331 (1986)<br />
26 Verschueren K., Handbook of Environmental Data on Organic Chemicals, 2nd ed., Van Nostrand<br />
Reinhold Company, New York, 47 (1983)<br />
27 AIHA, Odor Thresholds for Chemicals with Established Occupational Health Standards, Acron (1989)<br />
Chemie Bützer<br />
H<br />
N<br />
CH 3
24<br />
Transportbeschleunigung hydrophiler Substanzen (z. Bsp. Glucose) mit geringer<br />
Membranpermeabilität durch Wechselwirkung mit speziellen Proteinen, (sog. Carriern)<br />
bei hoher Strukturspezifität und Sättigung des Transportsystems bei hohen<br />
Substanzkonzentrationen (Besetzung sämtlicher Bindungsstellen auf einer<br />
Membransseite). Hemmbarkeit durch Inhibitoren.<br />
Aktiver Transport<br />
Substanz wird entgegen dem Konzentrationsgefällle im Sinne eines Bergauftransports<br />
durch die Membran transportiert als energieverbrauchender Prozess z. Bsp. für<br />
Aminosäuren und einige wasserlösliche Vitamine.<br />
Mit Natriumionen gekoppelter Transport, wobei die Substanz und Natriumionen in<br />
dieselbe Richtung transportiert werden (Symport).<br />
Pinocytose, Phagocytose, Persorption<br />
• Pinocytose : Aufnahme kleine Flüssigkeitströpfchen.<br />
• Phagocytose : Aufnahme von Feststoffpartikeln aus dem Magen-Darm-Kanal<br />
(Oberflächenmembran stülpt sich ein und das extrazelluläre Material wird<br />
vesikulär eingeschlossen).<br />
• Persorption : feste Teilchen (selbst ganze Zellen) gelangen interzellulär d.h.<br />
zwischen den Epithelzellen hindurch, in den Organismus.<br />
Die Resorption der allermeisten Arzneistoffe erfolgt jedoch passiv durch Diffusion.<br />
Die Aufnahmeorte beim Menschen lassen sich einteilen:<br />
tiefe Einatmung<br />
100 m 2<br />
Ausatmung<br />
40 m 2<br />
Haut 1.8 m 2<br />
Lungen Magen-Darm-Trakt<br />
Dünndarm<br />
100-200 m 2<br />
Mundhöhle 0.02 m 2<br />
Dickdarm 0.5 - 1 m 2<br />
Magen 0.1 - 0.2 m 2<br />
Rektum 0.04 - 0.07 m 2<br />
Abbildung 11: Mittlere Oberflächen eines erwachsenen Menschen, Eintrittsflächen für die<br />
Resorption28 , 29<br />
Der Dünndarm ist das wichtigste Resorptionsorgan für Nahrungsmittel und oral<br />
verabreichte Medikamente.<br />
Da die Zellmembranen aus lipophilen Bestandteilen aufgebaut sind, können diese von<br />
lipophilen Substanzen besonders gut passiert werden.<br />
28 Fuhrmann G.F., Allgemeine Toxikologie für Chemiker, B.G. Teubner, Stuttgart, 1994, 26<br />
29 Scheier zitiert in: Forth W., Henschler D., Rummel W., Starke.(Hrsg.), Allgemeine und spezielle<br />
Pharmakologie und Toxikologie, Bibliographisches Institut & F.A. Brockhaus AG, Mannheim,<br />
1992, 31<br />
Chemie Bützer
25<br />
Die Schleimhäute haben den Charakter einer Lipidmembran mit Poren, weshalb sie<br />
auch für hydrophile Substanzen beschränkt durchlässig sind (Nase, Mund-Rachen,<br />
Bindehaut, Harnleiter, Blase). Kokainsüchtige benutzen daher die Nasenschleimhaut oft<br />
als Resorptionsfläche.<br />
Faustregel:<br />
Ein lipophiles Molekül passiert Membranen passiv gut, ein hydrophiles schlecht.<br />
Resorptionsgeschwindigkeit und -quote ist abhängig von:<br />
• Teilchengrösse / spezifischer Oberfläche<br />
• Dosierung<br />
• Kontaktzeit mit der Resorptionsfläche<br />
• Grösse der resorbierenden Fläche<br />
• pH-Wert im Bereich der resorbierenden Areale<br />
• Integrität der Membranen<br />
• Durchblutung des resorbierenden Organs.<br />
Die Diffusionsgeschwindigkeit bestimmt die Aufnahme von einem Kompartiment ins<br />
nächste.<br />
Beispiel 30 : 1 Gramm Dimethylformamid (DMF, H-CO-N(CH3)2) wird<br />
über die Haut innerhalb weniger Minuten aufgenommen. Um<br />
dieselbe Menge bei einem MAK-Wert von 10 ppm aufzunehmen<br />
muss man eine ganze Woche diesen Dämpfen ausgesetzt sein. Der<br />
Abbau von DMF im Körper ist jedoch so rasch, dass bei Aufnahme<br />
über die Lunge 1 g im Körper nie übersteigt.<br />
4.1 Diffusion<br />
H C<br />
O<br />
N(CH 3 ) 2<br />
Die Geschwindigkeit mit der Moleküle eine Membran passieren, mit dem passiven<br />
Transport der Diffusion,kann durch das Ficksche Gesetz beschrieben werden 31 :<br />
D A Kv ( c 2 c1)<br />
v<br />
( m / s)<br />
d<br />
− • • •<br />
=<br />
v: Diffusionsgeschwindigkeit (m/s)<br />
D: Diffusionskonstante (abängig von der Molekülgrösse)<br />
� Gase: D ≈ 10 -4 – 10 -5 m 2 sec -1 ,<br />
� Flüssigkeiten: D ≈ 10 -9 m 2 sec -1 (Wasser),<br />
� Festkörper: D ≈ 10 -14 m 2 sec -1<br />
A: Oberfläche der Membran (m 2 );<br />
Kv: Verteilungskoeffizient (cinnen/caussen, dimensionslos, c1/c2);<br />
(cinnen-caussen = c1-c2 =∆c): wirksame Konzentrationsdifferenz (mol/m 3 )<br />
d : Dicke der Membran (m);<br />
Beispiel:<br />
Wie lange dauert die Aufnahme?<br />
30 Bender H.F., Sicherer Umgang mit Gefahrstoffen, Wiley-VCH Verlag GmbH, Weinheim, 2000, 8<br />
31 Stephan U., Elstner P., Müller R.K. (Hrsg.), Fachlexikon ABC Toxikologie, Verlag Harri Deutsch,<br />
Thun/Frankfurt, 1985, 108<br />
Chemie Bützer
26<br />
Von Acetylsalicylsäure (Molmasse M= 180 g/mol = 0.18 kg/mol) werden 100 mg (m =<br />
10 -4 kg) eingenommen. Sie werden vom Magen aufgenommen, dieser enthält ca. 2,5 l<br />
Inhalt (V=2,5 x 10 -3 m 3 ).<br />
Pro 24 Stunden werden von der ca. 800 cm 2 (A<br />
= 0.08 m 2 ) grossen Magenoberfläche 1500 -<br />
3000 ml Sekret gebildet. Aus Literatur: Kv ≈<br />
100. Dicke der zu diffundierenden Magenwand<br />
ca d = 0,2 mm (d ≈ 0.0002 m).<br />
Diffusionskonstante in der lipophilen Membran<br />
D ≈ 10 -10 m 2 sec -1 (die Membran ist wie ein<br />
Flüssigkristall).<br />
c1 = 0 (am Anfang ist kein Medikament im Blut),<br />
(c2-c1) = c2;<br />
c2 = n/V = m/(M x V) = 10 -4 /(0.18 x 2,5 x 10 -3 ) =<br />
0,22 mol/m 3 ;<br />
10<br />
v =<br />
−10<br />
• 0.<br />
08 • 100 • 0.<br />
22<br />
=<br />
0.<br />
0002<br />
8.<br />
8<br />
• 10<br />
−6<br />
( m / s)<br />
t = d(Dicke der Membran)/v(Geschwindigkeit) = 22.7 s !!!<br />
Abbildung 12: REM- Aufnahme der<br />
Magenoberfläche<br />
Der passive Transport in den Körper- und Zellflüssigkeiten ist weiter durch die Diffusion<br />
bestimmt:<br />
Zeit t für den Transport durch Diffusion 32 :<br />
2<br />
l<br />
t = ( s)<br />
D<br />
t: Diffusionszeit /s)<br />
l : Diffusions-Distanz (m);<br />
D: Diffusionskonstante (m 2 /s)<br />
Beispiel:<br />
Die Diffusionsstrecke in der Lunge, die Luft-Blut-Schranke, beträgt nur 0.4 bis 2.5 μm.<br />
Die Zeit, bis beispielsweise Sauerstoff (O2) diese Membran passiert hat lässt sich grob<br />
abschätzen:<br />
d = 2.<br />
5μm<br />
d = 0.<br />
4μm<br />
: t<br />
: t<br />
2<br />
l ( 2.<br />
5 •10<br />
= = −10<br />
D 10<br />
2<br />
l ( 0.<br />
4 •10<br />
= =<br />
−10<br />
D 10<br />
−6<br />
−6<br />
)<br />
)<br />
2<br />
2<br />
=<br />
=<br />
6.<br />
26<br />
1.<br />
6<br />
•10<br />
•10<br />
−3<br />
−2<br />
( s)<br />
( s)<br />
== 63μs<br />
= 1.<br />
6μs<br />
Diese Werte zeigen, dass die Aufnahme der Gase durch Diffusion, wegen der sehr<br />
dünnen Wände der Alveolen äusserst rasch ist (sehr rasche Wirkung von Nikotin bei<br />
Inhalation von Zigarettenrauch!!).<br />
Einige Reizgase wie Chlorwasserstoff, Phosgen (Cl-C=O-Cl), Ozon oder nitrose Gase<br />
(NO, NO2, N2O4) lassen die Epithelzellen der Lungenbläschen durch Flüssigkeitsaustritt<br />
anschwellen. Damit wird der Sauerstoff- und Kohlendioxidaustausch verlangsamt –<br />
Hemmung eines notwenigen Vorgangs.<br />
32 Herleitung mit den Fickschen Gesetzen<br />
Chemie Bützer
4.1.1 Inhalation<br />
27<br />
Kennzeichnend für die Stoffaufnahme über den<br />
Atmungstrakt ist einerseits der kurze Weg zwischen<br />
Aussenbereich (Atemluft) und dem resorbierenden Organ<br />
Lunge und andererseits die Tatsache, dass praktisch keine<br />
ernstliche Barriere auf diesem Weg eingebaut ist.<br />
Beschränkte Schutzfunktionen übt lediglich die den<br />
Innenbereich des Gewebes auskleidende Schleimhaut aus.<br />
Sie dient zugleich der Befeuchtung der Atemluft und der<br />
Abscheidefläche für Festkörper. Die die Innenseite der<br />
Luftröhre bedeckenden Flimmerhärchen (Cilien) dienen zur<br />
Abwehr von gröberen Festkörpern durch Erzeugung eines<br />
Hustenreizes. Der effektive Stoffübertritt von der „Aussenwelt“ in das Körperinnere<br />
findet in den endständigen Organellen der Lunge, den Lungenbläschen (Alveolen)<br />
durch Diffusion über die trennende Gewebsmembran in die Blutkapillaren des Lungen-<br />
Blutkreislaufs statt.<br />
Abbildung 13:<br />
Aufnahmeort in den<br />
Lungen<br />
Gase, Dämpfe und Feinstäube mit geringer Partikelgrösse sind daher in der Lage mit<br />
dem Luftstrom der Einatmungsluft bis in die Alveolen zu gelangen und dort gemäss<br />
dem Konzentrationsgefälle in die Blutbahn überzutreten. Im allgemeinen werden<br />
Partikel mit einem sphärischen Durchmesser von
(enterohepatischer Kreislauf). Dieses Phänomen ist bei der Verabreichung von<br />
Medikamenten (als erwünschter Effekt einer Dosis-Verlängerung), aber auch bei<br />
Vergiftungen für Massnahmen zur Entgiftung (z.B. Darmspülung, Verabreichung von<br />
Aktivkohle etc.) zu beachten.<br />
4.1.3 Dermale Resorption<br />
Die Haut stellt für den Körper eine Schutzbarriere dar und dient zugleich der<br />
Flüssigkeits- und Temperaturregulation des Organismus. Durch die im Vergleich zu<br />
anderen biologischen Membranen enorme Schichtdicke erfolgt die<br />
diffusionskontrollierte Penetration der gesamten Hautdecke bis zum Erreichen<br />
blutführender Gefässe nur langsam und bedarf eines hohen Gradienten. Lipophile<br />
Stoffe, insbesondere Lösungsmittel, können durch Entfettung der Zellschichten die<br />
Durchlässigkeit drastisch verbessern.<br />
4.1.4 Parenterale Resorption<br />
33 Davenport H.W., Säure-Basen-Regulation, Georg Thieme Verlag, Stuttgart, 1973<br />
Chemie Bützer<br />
28<br />
Die direkte Zuführung von Stoffen in die Blutbahn hat vor allem im medizinischtherapeutischen<br />
Bereich und bei Drogen ihren Stellenwert, da auf diese Weise<br />
Resorptions-Hemmnisse umgangen werden. Im allgemeinen erfolgt die Zufuhr durch<br />
intravenöse Injektion (i.v.). Subcutan (s.c.) oder intramuskulär (i.m.) werden Wirkstoff-<br />
„Depots“ angelegt, da hier der Wirkstoff erst durch Diffusion den Zugang zu einem<br />
Blutgefäss erhält.<br />
4.2 Dissoziation<br />
Aufnahme von sauren oder basischen <strong>Wirkstoffe</strong>n mit dem Übergang von einem<br />
Kompartiment (Magen, Darm, Lunge, Haut) ins andere (Blut) 33 ist auch durch die pH-<br />
Werte der beteiligten Kompartimente bestimmt.<br />
Für die grosse Zahl der Säuren und Basen (Nahrungsmittel, Vitamine, Arzneimittel,<br />
Gifte, etc.) stellt die nichtionische Diffusion der wichtigste Mechanismus für den<br />
Transport durch die Zell-Membranen dar (Magenwand, Darmwand, Lunge, Haut, Blut-<br />
Hirn- Schranke, Niere, etc.). Diese Membranen sind vom Aufbau her sehr fetthaltig,<br />
lipophil, und lassen deshalb passiv auch nur lipophile Stoffe, also ungeladene, wenig<br />
polare Stoffe gut passieren (Ausnahmen: Transport durch Poren oder aktiver<br />
Transport).<br />
Generell gilt: In Ionen dissoziierte Stoffe werden schlechter resorbiert als undissoziierte<br />
Moleküle (Beispiel: Dissoziation einer Säure: HA � H + + A - ).<br />
Der Dissoziationsgrad einer Säure oder Base hängt vom pH- Wert des umgebenden<br />
Mediums und dem pKs- respektive pKb-Wert der Säure oder Base ab. Der<br />
Dissoziationsgrad wiederum bestimmt die Lipophilie und damit den Verteilungskoeffizienten<br />
Kv oder die Löslichkeit. Zur Bestimmung der Resorptionsfähigkeit dient<br />
der Verteilungskoeffizient Octanol/Wasser (O/W-Wert, Pow) bzw. gegenüber einem<br />
Puffer mit pH 7.4 (physiologischer pH-Wert), wobei bei dissoziierbaren Molekülen das
Verhältnis von ionisierter zu nicht ionisierter Form massgeblich ist (Henderson-<br />
Hasselbalchsche Gleichung).<br />
29<br />
Die Membranen bewirken eine Trennung in 2 Komparimente, z.B. intra- und extrazellulär<br />
usw. Die Verteilung eines Stoffes zwischen diesen beiden Kompartimenten lässt<br />
sich einfach berechnen.<br />
extrazellulär<br />
c<br />
aussen<br />
Verteilungs-<br />
Gleichgewicht<br />
Membran<br />
intrazellulär<br />
c<br />
innen<br />
Eine Substanz verteilt sich zwischen<br />
die beiden Räume extrazellulär und<br />
intrazellulär entsprechend ihrer<br />
Löslichkeit in den beiden<br />
Phasenräumen.<br />
Verteilung : K =<br />
Reaktionsgeschwindigkeit<br />
c<br />
c<br />
innen<br />
aussen<br />
Chemisches Gleichgewicht<br />
Abnahme aussen<br />
0 5 10 15 20<br />
Gleichgewicht<br />
Zunahme innen<br />
Zeit<br />
Dynamik und Lage der<br />
Gleichgewichtseinstellung<br />
Abbildung 15: Gleichgewichtseinstellung zwischen zwei Phasenräumen, z.B. extrazellulär und<br />
intrazellulär<br />
Die Verteilung stellt sich erst nach einer gewissen Zeit stabil ein, dann wenn die<br />
Diffusion nach innen der Diffusion nach aussen entspricht. Es handelt sich somit um ein<br />
dynamisches Gleichgewicht.<br />
Für die Verteilung wasserlöslicher Substanzen, oder von Substanzen, welche an<br />
wasserlösliche Teilchen gebunden werden, sind die Volumina der Kompartimente eine<br />
massgebende Grösse.<br />
Tabelle 8: Wassergehalt einiger Organe des Menschen (Gesamtgehalt 100%)<br />
Chemie Bützer
Muskelgewebe 50.8<br />
Skelett 12.5<br />
Haut 6.6<br />
Blut 4.7 (bei Erwachsenen ca. 6.5-7.1% des Köpergewichts,<br />
bei Neugeborenen ca. 10% des Körpergewichts)<br />
Magen, Darm 3.2<br />
Leber 2.8<br />
Gehirn 2.7 (begrenzt Moleküle auf MG
31<br />
[HA]: Konzentration an undissoziierter Säure, Transportform (durchdringt die<br />
lipophilen Zell-Membranen oder werden durch „Einstülpung“ in die Zelle<br />
transferiert: Pinocytose grosser Moleküle).<br />
Modellannahme: Massenbilanz: c = [A - ] + [HA]<br />
[A-] = c - [HA]<br />
Ks = (c - [HA]) [H3O + ]/ [HA];<br />
+<br />
c • [ H3<br />
O ]<br />
[ HA]<br />
=<br />
; Undissoziierte Säure, lipophil<br />
+<br />
Ks + [ H O ]<br />
3<br />
Diese Funktion ist analog der log- Dosis Wirkungs- Kurve, nur enthält sie zusätzlichen<br />
Faktor c. Da der pH-Wert dem negativen dekadischen Logarithmus entspricht, ist der<br />
Kurvenverlauf um die Vertikale gespiegelt (in der logarithmischen Form ist dieser Graph<br />
eine Sigmoide, wie das logistische Wachstum).<br />
[HA]<br />
0.01<br />
0.005<br />
0<br />
0.000001 0.00001 0.0001 0.001 0.01 0.1 1 10<br />
[H3O + ]<br />
Ks1 = 0.0001 Ks2 = 0.01<br />
Abbildung 16: Konzentration der undissoziierten Säure [HA] in Funktion der [H3O+] Konzentration<br />
(c = 0.01 mol/l)<br />
undiss. Säure [HA]<br />
1.2<br />
1<br />
0.8<br />
0.6<br />
0.4<br />
0.2<br />
0<br />
0 2 4 6 8 10 12 14<br />
pH<br />
pKs=5<br />
pKs=7<br />
pKs=9<br />
Abbildung 17: Undissoziierte Säure [HA] in Funktion des pH-Wertes der Lösung (Annahme: c= 1)<br />
Chemie Bützer
Bei jeder Säure ist dann, wenn pKs = pH 50% der Säure dissoziiert. Undissoziierte<br />
Säure (z.B. CH3COOH) ist lipophiler, da sie nicht geladen ist (CH3COO - ).<br />
Chemie Bützer<br />
32<br />
Tabelle 9: Mittlere pH- Werte von Körperflüssigkeiten des Menschen<br />
Körperflüssigkeit<br />
pH- Werte<br />
Magen 2 - 3<br />
Darm 7.3<br />
Blut Frauen 7.40±0,015, Männer 7.39±0,015<br />
Harn 5.9 - 6.2<br />
Schweiss 5.5 - 7.5<br />
Tabelle 10: pKs – Werte von sauren oder basischen <strong>Wirkstoffe</strong>n, prozentualer Anteil<br />
undissoziierter Säure bei pH = 2.5 und pH = 7.3 (berechnet mit der Gleichung von Henderson-<br />
Hasselbalch)<br />
Substanz<br />
pKs Molmasse pH=2.5 pH=7.3<br />
% [HA] % [HA]<br />
Oxalsäure 1.25 90 94.7 0.0<br />
Benzylpenicillin 2.8 334.39 33.4 0.0<br />
Oxacillin 2.8 401.43 33.4 0.0<br />
Weinsäure 2.98 150.1 24.9 0.0<br />
PAS (p-Aminosalicylsäure) 3.2 195.16 16.6 0.0<br />
Diazepam 3.3 284.75 13.7 0.0<br />
Acetylsalicylsäure 3.5 180.16 9.1 0.0<br />
Milchsäure 3.86 90.1 4.2 0.0<br />
Vitamin C 4.2 176 2.0 0.1<br />
Benzoesäure 4.2 122.1 2.0 0.1<br />
Phenylbutazon 4.5 308.37 1.0 0.2<br />
Propionsäure 4.87 74.1 0.4 0.4<br />
4- Aminophenol 5.65 109.1 0.1 2.2<br />
Dicumarol 5.7 336.3 0.1 2.5<br />
Codein 6 299.37 0.0 4.8<br />
Phenobarbital 7.6 232.23 0.0 66.6<br />
Methadon 8.6 309.45 0.0 95.2<br />
Theophyllin 8.75 180.17 0.0 96.6<br />
Procain 8.9 236.3 0.0 97.5<br />
1,3-Dihydroxybenzol 9.2 110.11 0.0 98.8<br />
Resorcin 9.2 110.1 0.0 98.8<br />
Allopurinol 9.4 136.11 0.0 99.2<br />
Propanolol 9.45 259.34 0.0 99.3<br />
Imipramin 9.5 280.41 0.0 99.4<br />
Atropin 9.8 289.37 0.0 99.7<br />
Amphetamin 9.9 135.21 0.0 99.7<br />
Dimethylamin 10.73 45.1 0.0 100.0
% undissoz. Medikament<br />
100.0<br />
80.0<br />
60.0<br />
40.0<br />
20.0<br />
0.0<br />
33<br />
0 5 10 15<br />
pKs<br />
pH=2.5<br />
pH=7.3<br />
Abbildung 18: Prozentualer Anteil von undissoziiertem Medikament im Magen (pH=2.5) und Darm<br />
(pH=7.3).<br />
Resorption:<br />
Saure Substanzen werden schon im Magen, basische Substanzen werden erst im<br />
Darm gut aufgenommen.<br />
Mit der Diskussion der Lipophilie, also der Anteile an ungeladenen Teilchen, ist nur die<br />
Frage beantwortet, wie viel eines Stoffes aufgenommen werden oder eine Membran<br />
passieren. Im 2. Kompartiment stellen sich diese Gleichgewichte erneut ein.<br />
Hat eine Base die Darmwand passiert, dann kommt sie ins Blut mit einem meist<br />
verschiedenen pH- Wert, sicher aber mit einem anderen Volumen. Diese Volumenänderung<br />
ist mit dem Verteilungsgleichgewicht zu berücksichtigen.<br />
Tabelle 11: Wirksamkeit einiger Sulfonamide (Ionisierung mit der Gleichung von Henderson-<br />
Hasselbalch berechnet)<br />
Sulfonamid min. Hemmkonz.<br />
(μmol/l )<br />
pKs<br />
-log(Ks)<br />
% ionisiert bei pH=7<br />
−<br />
[ A ] ( pH−pKs)<br />
= 10<br />
[ HA]<br />
Sulfanilamid 2500 10.5 0.03<br />
Sulfapyridin 20 8.5 3.4<br />
Sulfathiazol 4 6.8 61.6<br />
Sulfadiazin 4 6.4 80.0<br />
Chemie Bützer
Chemie Bützer<br />
34<br />
Folgerung:<br />
Bei Substanzen einer Wirkstoffgruppe wird die Wirksamkeit ganz entscheidend durch<br />
die Resorption bestimmt. Eine undissoziierte Substanz kann die Membranen wesentlich<br />
besser durchdringen (Transport durch die Zellwand � Transportform).<br />
Der Transport in der Blutbahn erfolgt entweder in gelöster Form (kleine polare Moleküle<br />
im Blut) oder bedient sich der Vehikel-Funktion der Globuline und Albumine. Mit dem<br />
Übertritt in die Blutbahn werden die Körperorgane in gleicher Weise angeschwemmt. An<br />
den Zellen der Organe treten in analoger Weise Diffusions- oder aktive Transportvorgänge<br />
auf und führen zu einem Eindringen der <strong>Wirkstoffe</strong> in die Zellen. Die stark<br />
durchbluteten Organe (Lunge, Herz, Gehirn, Leber, Niere) sind daher einem stärkeren<br />
Diffusionsdruck ausgesetzt, als das schwächer durchblutete Muskelgewebe.<br />
5 Elimination<br />
Unter Elimination versteht man die Summe aus Abbau (Metabolismus,<br />
Biotransformation) Exkretion (Ausscheidung) und aktiver Entgiftung (Detoxikation). Sehr<br />
oft kann nur die Summe dieser Prozesse erfasst werden, welche dann z.B. mit einer<br />
biologischen Halbwertszeit angegeben wird.<br />
5.1 Biotransformation<br />
Die meisten, der von einem Organismus aufgenommenen Substanzen werden<br />
metabolisiert.<br />
Die wichtigsten Reaktionen sind:<br />
� Oxidation (Energiegewinnung),<br />
� Reduktion,<br />
� Hydrolyse,<br />
� Synthese (z.B. Methylierung, Acetylierung, Amidbildung etc.),<br />
� Konjugation (Bindung an andere Moleküle).<br />
Der Körper kann grundsätzlich nicht zwischen „giftigen“ und „ungiftigen“ Stoffen<br />
unterscheiden. Die resorbierbaren Stoffe unterliegen, ungeachtet ihrer physiologischen<br />
Wirkungen, den Umwandlungs-, Speicher- und Ausscheidungsmechanismen, wie sie<br />
für die lebensnotwendigen Stoffe (Nahrungsmittel, Vitamine etc.) gegeben sind. Für die<br />
organischen Komponenten ist dies in erster Linie der enzymatische Stoffwechsel<br />
(Metabolismus) der Zellen, in besonderer Ausprägung das Leberparenchym<br />
(Cytochrom P 450-Enzyme � CYP). Der Stoffwechsel hat vor allem den Zweck,<br />
Energie und körpereigene <strong>Wirkstoffe</strong> zu gewinnen. Dabei wird meist Sauerstoff<br />
eingebaut, was zu einer Steigerung der Polarität und damit einer Erhöhung der<br />
Wasserlöslichkeit führt. Diese chemischen Veränderungen führen meist zu einer<br />
Entgiftung, sie können aber auch zu toxischeren Substanzen, also einer Giftung führen.
5.2 Exkretion<br />
Die Clearance (englisch für Reinigungsklärung) ist ein Mass für die Eliminationsgeschwindigkeit<br />
einer Substanz aus dem Blut 35 . Die renale Clearance (Nieren-<br />
Clearance) beschreibt das Verhältnis zwischen der im Urin je Zeiteinheit<br />
ausgeschiedenen Substanzmenge mu=cu•Vu bezogen auf die, Konzentration der<br />
Substanz im Plasma cp:<br />
35<br />
c u • Vu<br />
Cp<br />
=<br />
c p<br />
Cp: Clearance (ml)<br />
cu: Konzentration der Substanz im Urin (mmol/ml)<br />
Vu: Volumen der Urinmenge (ml/h)<br />
cp: Konzentration der Substanz im Plasma (mmol/ml)<br />
mu: Menge im Urin (mmol)<br />
Die Ausscheidung kann auch über andere Wege erfolgen (Leber, Galle, Haut, Lunge).<br />
Die Elimination einer Substanz (z.B. Ausscheidung durch die Niere) bewirkt einen Abfall<br />
der Blutspiegelkurve. In den allermeisten Fällen handelt es sich um eine Kinetik „erster<br />
Ordnung“ – die Geschwindigkeit ist von der Konzentration im Blut bestimmt:<br />
dc<br />
− = k e • c;<br />
dt<br />
c t<br />
( −ke<br />
•t<br />
)<br />
= c 0 • e ;<br />
ln( c ) = ln( c ) − k • t;<br />
t<br />
0<br />
e<br />
ke: Eliminationsgeschwindigkeits-Konstante (s -1 );<br />
ct: Konzentration im Blutplasma (mol/m 3 );<br />
t: laufende Zeit (s);<br />
c0: Konzentration im Blutplasma zum Zeitpunkt t = 0, (mol/m 3 );<br />
Simulationsdiagramm Zeitdiagramm der Blutkonzentration<br />
Abbildung 19: Konzentrationsabhängige Elimination (ke = 0.05)<br />
35 Das in einer Zeiteinheit formal vom Wirkstoff befreite Plasmavolumen wird als Clearance bezeichnet:<br />
Vapp<br />
t / = ln( 2)<br />
• ; t½ : Halbwertszeit der Ausscheidung, Vapp: scheinbares Verteilungsvolumen,<br />
1 2<br />
CLtot<br />
CLtot: Gesamtclearance (alle Ausscheidungen zusammen): CLtot<br />
k =<br />
Vapp<br />
Chemie Bützer
5.3 Geschwindigkeit von Gleichgewichtseinstellungen (Kinetik)<br />
Aufnahme einer Substanz in das Blut aus dem Verdauungstrakt mit der Magen-<br />
und/oder Darmwand als trennende Membran.<br />
Magen-Darm-<br />
Trakt<br />
36<br />
kr ke<br />
Blutraum<br />
Abbildung 20: Modell mit einem Kompartiment und einer Trennwand.<br />
Annahmen:<br />
c0: Anfangskonzentration im Kompartiment<br />
c(t): Konzentration zur Zeit t im Kompartiment<br />
ka : Geschwindigkeit der Aufnahme in das Kompariment (Resorption)<br />
ke : Geschwindigkeit der Elimination aus dem Kompartiment (Clearance)<br />
c0 � Dosis/Verteilvolumen 36 ,<br />
c(<br />
t)<br />
c<br />
k<br />
k − k<br />
(<br />
a −ka•<br />
t −ke<br />
•t<br />
= 0 • e − e ); Bateman-Funktion<br />
a<br />
Verdauungs<br />
trakt<br />
e<br />
kr HWZe ke<br />
Blut<br />
Resorption Elimination<br />
Abbildung 21: Simulationsdiagramm eines 1-Kompartiment-Modells<br />
Blutkonzentration<br />
36 Lüllmann H., Mohr K., Ziegler A., Taschenbuch der Pharmakologie, Georg Thieme Verlag<br />
Stuttgart/New York, 1994, 47<br />
Chemie Bützer
mg/kg<br />
100<br />
75<br />
50<br />
25<br />
0<br />
37<br />
Blutkonzentration<br />
0 1 2 3 4 5 6 7 8 9 10<br />
Time (Hour)<br />
Blutkonzentration : current<br />
Abbildung 22: Zeitdiagramm eines 1-Kompartiment-Modells (Ordinate: Prozent,<br />
Anfangskonzentration 100%, Abszisse: Zeit, kr = 0.06; ke = 0.02)<br />
Dokumentation (Gleichungen, Parameter)<br />
(01) Blut= INTEG (+Resorption-Elimination, 0)<br />
Units: mg/kg [0,?]<br />
(02) Blutkonzentration= Blut/(5)<br />
Units: mg/kg [0,?]<br />
(03) Elimination= ke*Blut<br />
Units: mg/(Hour*kg)<br />
(04) FINAL TIME = 10<br />
Units: Hour<br />
The final time for the simulation.<br />
(05) HWZe= 3<br />
Units: Hour [1,3]<br />
(06) INITIAL TIME = 0<br />
Units: Hour<br />
The initial time for the simulation.<br />
(07) ke= LN(2)/HWZe<br />
Units: 1/Hour<br />
(08) kr= 0.28<br />
Units: 1/Hour [0.1,1]<br />
(09) Resorption= kr*Verdauungstrakt<br />
Units: mg/(Hour*kg) [0,?]<br />
(10) SAVEPER = TIME STEP<br />
Units: Hour [0,?]<br />
The frequency with which output is stored.<br />
(11) TIME STEP = 0.1<br />
Units: Hour [0,?]<br />
The time step for the simulation.<br />
(12) Verdauungstrakt= INTEG (-Resorption, 1000)<br />
Units: mg/kg [0,?]<br />
Sehr wichtig für die Dynamik der Wirkung von Substanzen sind die molekularen<br />
Eigenschaften wie:<br />
• Molmasse<br />
• Fettlöslichkeit<br />
• Resorption<br />
• Proteinbindung<br />
Chemie Bützer
38<br />
• Elimination (Biotransformation, Clearance (Abbaugeschwindigkeit in Leber und<br />
Ausscheidungsgeschwindigkeit in Niere))<br />
Resorption<br />
Verteilung<br />
Biotransformation<br />
Proteinbindung<br />
Wirkort<br />
Elimination<br />
Speicherung<br />
Ausscheidung<br />
Abbildung 23: Die biologische Wirkung von Systemen mit einem Metabolismus im Überblick<br />
Die Übertragbarkeit der Daten von Kleinsäugern auf den Menschen kann recht<br />
heikel sein. So kann beispielsweise bei einer Maus bei derselben relativen Dosis<br />
(mg/kg) manchmal keine Wirkung festgestellt werden, obwohl die Substanz beim<br />
Menschen wirkt. Der enorm hohe Blutumsatz (insgesamt die metabolic rate) lässt einen<br />
Wirkstoff bei der Maus teilweise so rasch ausscheiden, dass die notwendige<br />
Blutkonzentration nicht erreicht wird 37 . Anpassungen dieser Art können jedoch mit<br />
geeigneten Modellen gemacht werden.<br />
Dieses Modell soll die wesentlichsten Aspekte der molekularen, chemischen Wirkungen<br />
deutlich machen.<br />
Drug<br />
Drug<br />
Drug<br />
Drug<br />
Drug<br />
Rezeptoren<br />
Wirkung<br />
Normale Wirkung<br />
grosse Affinität<br />
Nebenwirkung<br />
kleine Affinität<br />
Abbildung 24: Wirkung und Nebenwirkungen als Folge der Bindung an den gewünschten (oben)<br />
und nicht gewünschten Rezeptor (unten)<br />
Je höher die Konzentration, desto mehr Wirkstoff bleibt übrig, der auch mit Orten<br />
kleinerer Affinität reagieren kann – das führt zu vermehrten Nebenwirkungen.<br />
Agonist: Bindet am Rezeptor und löst eine Wirkung aus<br />
Antagonist: Bindet am Rezeptor, aber löst keine Wirkung aus. Er kann aber die<br />
Wirkung blockieren (Inhibitor).<br />
37 Schmitt W., Willmann S., Computer-Reise durch den Körper, research (Das Bayer-<br />
Forschungsmagazin), Nr.15, Dezember 2003, 62<br />
Chemie Bützer
Die Wirkung ist nicht nur eine qualitative, sondern auch eine quantitative<br />
Eigenschaft.<br />
5.4 Occupationsmodell<br />
39<br />
„Sobald wir mehr wissen, haben wir mehr Fragen zu stellen. Unser Wissen ist<br />
wie eine Insel im unendlichen Ozean des Unbekannten, und je grösser diese<br />
Insel wird, desto länger werden die Ufergrenzen zum Unbekannten.“<br />
(Viktor Weisskopf, Natur im Schaffen)<br />
Die Rezeptoren werden durch die <strong>Wirkstoffe</strong> in einer Gleichgewichtsreaktion belegt.<br />
Das ist notwendig, denn wenn die Bindung zu stark wäre, könnte an einem Rezeptor<br />
nur einmal eine Reaktion ausgelöst werden.<br />
Der Effekt ist der Anzahl der belegten Rezeptoren proportional.<br />
Ein einfaches Modell geht von folgenden Annahmen aus:<br />
1. Ein Wirkstoff muss sich an den Wirkungsort (Rezeptor) binden.<br />
2. Diese Bindung ist eine Gleichgewichtsreaktion (dynamisches Gleichgewicht wie<br />
das Niveau bei einem Brunnen)<br />
3. Die Wirkung ist dann proportional der Anzahl Wirkstoffmoleküle, die an den<br />
Rezeptor gebunden sind.<br />
4. Es wird der relative Effekt berechnet, d.h. man interessiert sich, welcher Bruchteil<br />
des maximalen Effekts erreicht wird.<br />
Dieses Modell ist nicht nur für Gifte brauchbar, sondern wird auch für Pharmaka oder<br />
die Enzymwirkung (Michaelis-Menten- Gleichung) verwendet.<br />
Rezeptor +<br />
Drug<br />
-k1 ⇔ k2- Drug-<br />
Rezeptor<br />
Komplex<br />
� k3 � Effekt<br />
[R] + [D]<br />
Gleichgewicht<br />
-k1 ⇔ k2- [DR] � k3 � E<br />
Konzentration Konzentration<br />
Konzentration Propor- Beobachtbarer<br />
der Rezeptoren des<br />
Drug-Rezeptor- tionalitäts- Effekt<br />
mol/l Drug/<strong>Wirkstoffe</strong>s<br />
mol/l<br />
Komplex Konstante (Wirkung)<br />
Abbildung 25: Aufbau des Occupationsmodells (Besetzung von Rezeptoren durch <strong>Wirkstoffe</strong>)<br />
Chemie Bützer
5.4.1 Annahmen für das Modell:<br />
Dissoziationskonstante: Kd = k2/k1 ; Reziprokwert der chemischen<br />
Gleichgewichtskonstanten K = k1/k2;<br />
40<br />
1. Gleichgewicht : Kd = ([R] [D])/[RD];<br />
2. Proportionalität: Effekt : E = [RD] k3 ; der Effekt ist proportional der mit<br />
<strong>Wirkstoffe</strong>n belegten Rezeptoren;<br />
3. Maximaler Effekt : Em = [Rt] k3 ; alle Rezeptoren sind belegt, d.h. der Effekt ist<br />
maximal;<br />
4. Massenbilanz : [Rt] = [RD] + [R] ; [Rt] Konzentration aller Rezeptoren, die R<br />
enthalten.<br />
Gesucht ist ein Modell, welches nur die messbaren Grössen [D], Kd und E/Em enthält.<br />
E/Em ist dabei der relative Effekt, als ein Mass, welcher Bruchteil des maximal<br />
möglichen Effekts erreicht wird.<br />
Mathematische Herleitung (Besetzungstheorie, Occupationsmodell nach Alfred Joseph<br />
Clark {1885 – 1951}):<br />
[R] = [Rt] - [RD] ; aus 4)<br />
[R] = Em/k3 - E/k3 ; 2) und 3) eingesetzt in 1)<br />
Kd = {(Em/k3 - E/k3) [D]}/(E/k3) ; gekürzt<br />
Kd = (Em [D] - E [D])/E; umgeformt<br />
Kd = Em/E [D] - [D].<br />
Mathematische Formulierung der Dosis- Effekt- Kurve:<br />
Relativer Effekt : E D<br />
[ D]<br />
+ Kd<br />
= ; Maximaler Effekt: Em = E • ;<br />
Em D + Kd<br />
D<br />
[D] : Dosis (mg/kg)<br />
Kd : Dissozitationskonstante (mg/kg) entspricht der Dosis für den halbmaximalen Effekt,<br />
sie ist ein Mass für die Wirksamkeit (engl. potency 38 of a drug).<br />
Diese Funktion zeigt eine perfekte Analogie zur Dissoziation von Säuren und zur<br />
Michaelis-Menten-Funktion, was nicht überrascht, äussern sich doch die <strong>Effekte</strong> sehr<br />
oft als Beeinflussung der zellulären Enzymsysteme.<br />
Effekt/Reiz<br />
5<br />
4<br />
3<br />
2<br />
1<br />
0<br />
0 20 40 60 80 100<br />
Dosis<br />
Zunahme des Effekts bei zunehmender<br />
Dosis<br />
Effekt/Reiz<br />
5<br />
4<br />
3<br />
2<br />
1<br />
0<br />
[ ]<br />
1 10 100<br />
Dosis<br />
Logarithmische Darstellung des Effekts siehe<br />
auch: Gesetz von Stevens<br />
38 Forth W., Henschler D., Rummel W., Starke.(Hrsg.), Allgemeine und spezielle Pharmakologie und<br />
Toxikologie, Bibliographisches Institut & F.A. Brockhaus AG, Mannheim, 1992, 17<br />
Chemie Bützer
41<br />
Abbildung 26: Vergleich einer linearen mit einer logarithmischen Darstellung von Dosis und Effekt<br />
(Wirkung)<br />
Das Weber-Fechnersche Gesetz 39 sagt aus, dass die Empindungen unserer Sinne in<br />
der Intensität logarithmisch sind: Sehsinn, Gehör, Tastsinn, Geruch, Geschmack,<br />
Temperaturempfindung etc.<br />
Dieses Gesetz wurde 1970 als Gesetz von Stevens erweitert und hat nun die<br />
allgemeine Form: I = a•S p<br />
I: Intensität der Empfindung<br />
a: Konstante<br />
S: Stimulus<br />
p: Konstante als Potenz (p: 0.33 – 1.7)<br />
In der logarithmierten Form: log(I) = p•log(S) + log(a) zeigt sich, dass eine doppelt<br />
logarithmische Darstellung eine Gerade ergeben wird.<br />
Unter Berücksichtigung des Schwellenwerts So wird diese Gleichung zu:<br />
log(I) = p•log(S-So) + log(a)<br />
5.4.2 Grenzen des Modells<br />
Die Bindung der meisten <strong>Wirkstoffe</strong> an ihre<br />
Rezeptoren löst nicht unmittelbar den<br />
gemessenen Effekt aus sondern bewirkt die<br />
Synthese oder Freisetzung eines oder mehrerer<br />
Mediatoren (z.B. „second messenger“ cAMP oder<br />
Ca 2+ ). Dieser wiederum bindet reversibel an ein<br />
Effektorsystem. Somit sind hier eigentlich zwei<br />
Gleichgewichte hintereinander geschaltet:<br />
D + R � DR � M + E � ME � W<br />
D: Drug<br />
R: Rezepotor<br />
M: Mediatormolekül (z.B. cAMP)<br />
E: Effektorsystem<br />
W: Wirkung<br />
5<br />
O<br />
HO<br />
'<br />
O<br />
N<br />
H<br />
H<br />
3'<br />
P<br />
O OH<br />
O<br />
N<br />
NH 2<br />
Abbildung 27: cycl. Adenosin-<br />
3',5'-monophosphat, cycl.<br />
Adenosinmonophosphat, cyclo-<br />
AMP, cAMP.<br />
39 Weber-Fechnersches Gesetz: E.H. Weber, Deutscher Physiologe (1795-1878), G. Fechner,<br />
Deutscher Psychologe (1801-1887)<br />
Chemie Bützer<br />
N<br />
N
42<br />
Die Realität zeigt, dass das Modell, trotz den bekannten Mediatoreigenschaften, die<br />
experimentellen Fakten recht gut beschreibt. Falls die Daten bekannt sind, können mit<br />
dem Modell mindestens Extrapolationen auf noch unbekannte Dosisbereiche recht gut<br />
vorgenommen werden.<br />
Unter der Annahme, dass empfindliche Individuen pro Kilogramm Körpergewicht<br />
weniger Rezeptoren haben, weniger Empfindliche mehr, kann dieses Modell auf eine<br />
Population übertragen werden.<br />
Gerade für die Untersuchung der Mediator-Moleküle und der Effektor-Systeme hat sich<br />
dieses Modell immer wieder bewährt (Pharmakologie, Toxikologie, Molekularbiologie 40 ).<br />
Bestimmung von Kd: E D<br />
= ;<br />
Em D + Kd<br />
Falls [D] = Kd, dann ist E/Em = ½ = 0,5 also 50% Effekt.<br />
Kd entspricht hier bei <strong>Wirkstoffe</strong>n der ED(50), also der Dosis, bei welcher bei der Hälfte<br />
der beobachteten Individuen ein Effekt festgestellt werden kann. Für letale <strong>Effekte</strong><br />
entspricht dies der LD(50). Diese LD(50) ist für verschiedene Lebewesen<br />
unterschiedlich (siehe Beurteilung von Befunden). Andererseits zeigen sich bei gleichen<br />
Lebewesen individuelle Unterschiede.<br />
Wirkung (%)<br />
100<br />
90<br />
80<br />
70<br />
60<br />
50<br />
40<br />
30<br />
20<br />
10<br />
0<br />
0 20 40 60 80 100<br />
besetzte Rezeptoren (%)<br />
HO<br />
HO<br />
Wirkung %<br />
berechnet<br />
OH<br />
C CH 2 NH 2<br />
Abbildung 28: Kontraktion der Kaninchenaorta durch den Neurotransmitter Noradrenalin 41 ;<br />
Berechnung mit Kd = 5 (Dosis-Effekt-Kurve).<br />
Die Dosis wird meist in Milligramm pro Kilogramm Körpergewicht angegeben. Damit<br />
werden individuelle Unterschiede in der Körpergrösse einigermassen ausgeglichen.<br />
40 Rudinger J., The Meaning of „Structure“ and „Activity“ for Peptide Hormones, Endocrinology 1971,<br />
Proc. 3rrd Int. Sym., London, 19-22 July 1971. Ed Selwyn Taylor, William Heinemann Medical<br />
Books, London 1972, 12<br />
41 Beese und Furchgott, zitiert in: Forth W., Henschler D., Rummel W., Starke.(Hrsg.), Allgemeine und<br />
spezielle Pharmakologie und Toxikologie, Bibliographisches Institut & F.A. Brockhaus AG,<br />
Mannheim, 1992, 15<br />
Chemie Bützer<br />
H
Für Kinder ist diese Anpassung aber ungenügend, da das Oberflächen zu<br />
Körpervolumen-Verhältnis zu stark von Erwachsenen abweicht.<br />
Die Youngsche Regel kann in Bezug auf das Alter als die zuverlässigste einfache<br />
Regel gelten 42 :<br />
43<br />
Dosierungsanpassung an das Alter von Kindern:<br />
Alter<br />
= Bruchteil _ der _ Erwachsenen<br />
− Dosis<br />
Alter +12<br />
Borsäure letale Dosen 43 :<br />
Erwachsene (oral): 15 – 20 g, Kleinkinder: 5 – 6 g; Säuglinge: 1 – 3 g.<br />
Berechnet nach obiger Formel, ausgehend von der Erwachsenendosis:<br />
Kinder (12 j.): 7,5 – 10 g, Kleinkinder (4 j.): 3,5 – 5 g, Säuglinge (2 j.): 2 – 3 g.<br />
Die Formel stimmt für diesen Fall recht gut.<br />
Beispiel: TCDD (Dioxin):<br />
Das stärkste synthetische Gift, das Dioxin (2,3,7,8-TCDD,<br />
Cl<br />
2,3,7,8-Tetrachlorodibenzo-1,4-dioxin) zeigt z.B. bei<br />
Goldhamstern eine 10'000 mal grössere LD(50), als die<br />
Meerschweinchen (0.6 μg/kg). Das ist erstaunlich, wenn man<br />
Cl O<br />
TCDD<br />
bedenkt, dass es sich um sehr ähnliche Organismen handelt. Die Probleme und<br />
Grenzen der Übertragbarkeit von tierexperimentellen Daten auf den Menschen sind<br />
damit angedeutet.<br />
O Cl<br />
Meist wird die Dosis-Effekt-Kurve als log(Dosis)-Effekt-Kurve dargestellt. Damit kann<br />
man grössere Dosisbereiche erfassen.<br />
Kontraktion (%)<br />
42 Meyers F.H., Jawetz E., Goldfien A., Lehrbuch der Pharmakologie, Springer-Verlag,<br />
Berlin/Heidelberg/New York, 1975, 26<br />
43 Stephan U., Elstner P., Müller R.K. (Hrsg.), Fachlexikon ABC Toxikologie, Verlag Harri Deutsch,<br />
Thun/Frankfurt, 1985, 76<br />
Chemie Bützer<br />
100<br />
90<br />
80<br />
70<br />
60<br />
50<br />
40<br />
30<br />
20<br />
10<br />
0<br />
1.00E-07 1.00E-06 1.00E-05 1.00E-04 1.00E-03 1.00E-02<br />
Noradrenalin (mol/l)<br />
Abbildung 29: Experimentelle log(Dosis)-Wirkungs-Kurve (% Kontraktion mit Noradrenalin am<br />
isolierten Milzpräparat der Katze) 44<br />
Cl
44 Forth W., Henschler D., Rummel W., Starke.(Hrsg.), Allgemeine und spezielle Pharmakologie und<br />
Toxikologie, Bibliographisches Institut & F.A. Brockhaus AG, Mannheim, 1992, 5<br />
45 Ng, P. C. et al., Individual Genomes Instead of Race for Personalized Medicine, In: Clinical<br />
Pharmacology and Therapeutics, 84, 2008, pp. 306-309<br />
Chemie Bützer<br />
44<br />
Übertragbarkeit der anhand von Tierversuchen bestimmten toxikologischen Daten auf<br />
den Menschen; z.B. weisen LD50-Werte erhebliche Schwankungen durchaus schon bei<br />
verwandten Säugetieren auf!<br />
Tabelle 12: Übertragbarkeit der LD-Werte<br />
Tierspezies LD50 für TCDD<br />
[mg/kg Körpergewicht]<br />
Meerschweinchen 0,6-2,0<br />
Ratte 20-45<br />
Küken 25-50<br />
Affe 70<br />
Kaninchen 115<br />
Maus 110-280<br />
Hund 200-300<br />
Goldhamster 1000-3000<br />
5.4.3 Übertragung auf Populationen<br />
Das Occupationsmodell kann auf eine Population von Individuen (Pflanzen,Tiere oder<br />
Menschen) übertragen werden, die unterschiedliche Empfindlichkeiten gegenüber dem<br />
Wirkstoff zeigt.<br />
Die Population ist dabei charakterisiert durch:<br />
• die mittlere Wirksamkeit des Wirkstoffs und<br />
• die Streuung in der Wirksamkeit des Wirkstoffs.<br />
Bei anscheinend ähnlichen Menschen sind manche ihrer Gene dermassen verschieden,<br />
dass sie auf dasselbe Medikament unterschiedlich reagieren 45 . Die Hautfarbe eines<br />
Menschen bestimmt nicht, wie er auf ein Medikament reagieren wird, oder auf welche<br />
Medikamente er reagiert. Die Zukunft ist daher eine personalisierte Medizin ein, die den<br />
individuellen Gen-Code berücksichtigt.<br />
Unter der Annahme, dass die Empfindlichkeitsverteilung einer Normalverteilung<br />
entspricht, zeigt sich die folgende Verteilung und deren Summenkurve:
y<br />
1<br />
0.8<br />
0.6<br />
0.4<br />
0.2<br />
0<br />
45<br />
Normalverteilung<br />
0 10 20 30<br />
x<br />
Abbildung 30: Normalverteilung mit Mittelwert 15 und Standardabweichung 5<br />
Summenkurve<br />
Normalverteilung<br />
Der Mittelwert bestimmt bei dieser Kurve die Lage, die Standardabweichung bei der<br />
Normalverteilung die Breite und bei der Summenkurve die Steilheit.<br />
y ist für die Dosis-Wirkung der relative Effekt, x ist dabei der Logarithmus der Dosis.<br />
Die x-Achse ist der Logarithmus der Dosis. Wird diese linear dargestellt, dann erhält<br />
man die bisehr bekannte Form des Grafen.<br />
1<br />
0.8<br />
0.6<br />
0.4<br />
0.2<br />
0<br />
0 2E+08 4E+08 6E+08 8E+08 1E+09<br />
Abbildung 31: Lineare Darstellung von Dosis und relativem Effekt<br />
Diese Funktion weist die typische Form einer Sigmoiden auf (wie die Wachstumskurve<br />
von Bakterien, logistisches Wachstum oder eine Titrationskurve).<br />
Chemie Bützer
elativer Effekt<br />
0.8<br />
0.6<br />
0.4<br />
0.2<br />
46<br />
log (Dosis) - Effekt - Funktion<br />
0.000001 0.001 1 1000<br />
1<br />
0<br />
Mikrogramm/kg<br />
heilend<br />
Nebenwirkungen<br />
letal<br />
Abbildung 32: Dosis-Effekt-Kurven für verschiedene Wirksamkeiten (Kd=0.001, Kd= 0.01, Kd= 0.1)<br />
In unserem Beispiel ist der Abstand der ED(50) (heilend) von der LD(50 (letal) ein<br />
Faktor 100.<br />
Diese Kurve entspricht der Summenhäufigkeit der Gaussschen Verteilungskurve.<br />
Folgerung:<br />
Je grösser der Abstand zwischen der Kurve mit den positiven <strong>Effekte</strong>n bei 50%<br />
(ED(50), zur Kurve mit der Letalität, LD(50), desto sicherer ist ein Medikament<br />
einzustufen.<br />
LD(50)/ED(50): therapeutischer Index.<br />
Aus Erfahrung hat sich bei Pharmaka für die therapeutische Breite der Quotient<br />
LD(25)/ED(75) herauskristallisiert 46 . Was könnte dafür die Begründung gewesen<br />
sein? 47<br />
Die LD(50), und damit Kd, ist die Grundlage für viele Beurteilungen der Toxizität von<br />
Substanzen, so auch der Gefahrenklassierung.<br />
Für die Funktion E<br />
Em<br />
=<br />
D<br />
gilt: Kd = ED(50) resp. LD(50) !!<br />
D + Kd<br />
5.4.4 Bedeutung für die Wirkungsbeurteilung<br />
Für die Beurteilung einer Wirkung, insbesondere für die Giftbeurteilung hat die Dosis-<br />
Effekt-Funktion eine grosse Bedeutung erlangt. Sie kann zwei Aussagen machen:<br />
• wie nimmt der Effekt in Funktion der Dosis bei einem Individuum zu und<br />
• wie zeigen sich die <strong>Effekte</strong> mit zunehmender Dosis bei einer Population.<br />
46 Kuschinsky G., Lüllmann H., Kurzes Lehrbuch der Pharmakologie, Georg Thieme Verlag, Stuttgart,<br />
1967, 269<br />
47 Falls die Steilheit der beiden Kurven nicht gleich ist, wird mit dem therapeutischen Index keine gute<br />
Aussage gemacht.<br />
Chemie Bützer
47<br />
Tabelle 13: Allgemeine Kennzeichnung als Gefahrengut/Gift 48<br />
sehr giftig<br />
giftig<br />
ätzend<br />
gesundheitsschädlich<br />
reizend<br />
Gefahrensymbole<br />
Giftigkeit bei<br />
Einnahme<br />
LD(50) mg/kg<br />
Giftigkeit bei<br />
Absorption durch<br />
Haut<br />
LD(50) mg/kg<br />
Giftigkeit beim<br />
Einatmen<br />
LC(50) mg/l<br />
auch Stäube und<br />
Nebel<br />
≤5 ≤40 ≤0.5<br />
>5-50 >40-200 >0.5-2<br />
fest: >50-500<br />
flüssig: >50-2000<br />
fest: >50-500<br />
flüssig: >50-2000<br />
500 - 2000<br />
(Erzeugnisse)<br />
> 2000<br />
(Erzeugnisse)<br />
5000-15000<br />
(Stoffe)<br />
>200-1000 >2-10<br />
>200-1000 >2-10<br />
Stoffe (Grundstoffe) sind unveränderte Naturstoffe, chemisch einheitliche Stoffe, einfache technische<br />
Stoffgemische ohne bestimmte Verwendung, also für verschiedene Zwecke einsetzbar.<br />
Erzeugnisse sind veränderte Naturstoffe oder Stoffgemische für einen bestimmten Verwendungszweck.<br />
Tabelle 14: Priorität der Gefahrensymbole 49<br />
Gefahrensymbol<br />
T, T+ Xi, Xn, C<br />
C Xi, Xn<br />
E F+, F, O<br />
Xn Xi<br />
schliesst diese gefährliche Eigenschaft mit ein<br />
ätzend: Hautzerstörung innerhalb von 4 Stunden Einwirkungszeit (R 34)<br />
stark ätzend: Hautzerstörung innerhalb von 3 Minuten Einwirkungszeit (R 35)<br />
reizend: Innerhalb maximal 4 Stunden Einwirkungsdauer wird eine<br />
Entzündung hervorgerufen, die mindestens 24 Stunden anhält.<br />
Für die Beurteilung der Gefährdung ist die Geschwindigkeit der Wirkung, die<br />
Reaktionsgeschwindigkeit der Reaktion, wesentlich.<br />
48 Gefahrstoffgesetzgebung in Zukunft: REACH (Registration, Evaluation & Authorisation of Chemicals),<br />
nachher GHS (Globally Harmonized System)<br />
49 Bender H.F., Sicherer Umgang mit Gefahrstoffen, Wiley-VCH Verlag GmbH, Weinheim, 2000, 137<br />
Chemie Bützer
48<br />
Ätzende Stoffe zerstören die Haut in ihrer gesamten Dicke (Hautnekrose). Trotz der<br />
deutlich unterscheidbaren ätzenden Wirkung, wird zwischen stark ätzenden Stoffen und<br />
ätzenden Stoffen das gleiche Gefahrensymbol verwendet.<br />
Grundsätzlich gefährden ätzende Substanzen nicht nur die Haut, sondern auch das<br />
Auge und die Lunge.<br />
Tabelle 15: Ätzende Wirkung in Abhängigkeit der Basen-/Säurestärke 50<br />
Substanz<br />
stark ätzend<br />
ätzend<br />
reizend<br />
Schwefelsäure >15% 5-15%<br />
Salzsäure >25% 10-25%<br />
Essigsäure >90 % 25-90 % 10-25%<br />
Propionsäure >25% 10-25%<br />
Natronlauge >5% 2-5% 0.5-2%<br />
Die meisten organischen Säuren, z.B. Ameisensäure, sind nur als hochkonzentrierte<br />
Säuren stark ätzend, in Konzentrationen unter 90% sind sie üblicherweise als ätzend<br />
einzustufen.<br />
Wichtig: Die ätzende Wirkung von basischen Stoffen ist stärker, als die von Säuren!<br />
Allgemeine Regel:<br />
Bei einem pH-Wert unterhalb 2 und oberhalb 11.5 ist mit einer ätzenden Reaktion zu<br />
rechnen.<br />
Weitere Gefahrensymbole:<br />
Explosionsgefährlich<br />
Brandfördernd<br />
Leichtentzündlich<br />
Hochentzündlich<br />
Biogefahr<br />
Umweltschädigend<br />
Radioaktiv<br />
50 Bender H.F., Sicherer Umgang mit Gefahrstoffen, Wiley-VCH Verlag GmbH, Weinheim, 2000, 47<br />
Chemie Bützer
Chemie Bützer<br />
49<br />
In eine toxikologische Betrachtung sind auch die Aspekte der Allergie einzuschliessen.<br />
Tabelle 16:Toxizitäten einiger Substanzen<br />
Verbindung LD(50) mg/kg<br />
Anorganische Toxine<br />
Blei 100<br />
Tetraethylblei 35<br />
Quecksilber (II)-chlorid 23<br />
Arsentrioxid, Arsenik 10<br />
Kaliumcyanid 3<br />
Kochsalz 3000<br />
Destilliertes Wasser 25000 - 30000<br />
Organische Toxine<br />
Chlorthion (Insektizid) 1500<br />
Aspirin, Acetylsalicylsäure 1500<br />
Phenobarbital (Schlafmittel) 660<br />
DDT (Insektizid) 150<br />
Parathion (Insektizid) 3<br />
TCDD (Dioxin) 0.001<br />
Pflanzentoxine<br />
Menthol (Minze) 3200<br />
Vanillin (Vanilleschoten) 3180<br />
Ethanol (Trinkalkohol) 2500<br />
Allylsenföl (Senf, Mostrich) 680<br />
Digitonin (Roter Fingerhut, herzwirksam) 150<br />
Solanin (Kartoffeln ca. 0.08% Gew.) 120<br />
Ergotoxin (Mutterkornalkaloid) 100<br />
Coniin (Coniumalkaloid) 60<br />
Nicotin (Tabak- und anderer Pflanzen) 15<br />
Strychnin 5<br />
Curarin 5<br />
Cholchizin (Herbstzeitlosegift) 3<br />
C- Toxiferin-I (Curarealkaloid) 2.5<br />
α- Amantin (Knollenblätterpilz) 0.2<br />
Ricin (aus Ricinusöl) 0.0002<br />
Bakterientoxine<br />
Diphterietoxin 0.000'03<br />
Tetanustoxin 0.000'000'1<br />
Botulinustoxin 0.000'000'03<br />
Tierische Toxine<br />
Melittin (Bienengift) 4<br />
Samandarin (Salamandergift) 1.5<br />
Buffotoxin (Krötengift) 0.4<br />
Tetrodotoxin (jap. Kugufisch, Delikatesse) 0.008<br />
Batrachotoxin (Pfeilgiftfrosch) 0.002<br />
Kobratoxin (Brillenschlange) 0.000'3<br />
Crotulostoxin (Klapperschlange) 0.000'2
Man kann einen Zusammenhang der Dosis-Effekt-Funktion mit dem logistischen<br />
Wachstum leicht aufzeigen.<br />
50<br />
Die Occupationstheorie geht davon aus, dass die Rezeptoren mit steigender Dosis<br />
zunehmend belegt werden (Occupation). Das ist beim Bakterienwachstum mit<br />
Beschränkungen (Raum, Nahrung) oder bei der Marktsättigung mit Produkten auch der<br />
Fall. Diese Situationen werden mit der Funktion des logistischen Wachstums<br />
beschrieben:<br />
E<br />
Em<br />
E<br />
Em<br />
[ D]<br />
Kd + [ D]<br />
x<br />
10<br />
= ; dieses ist die Funktion des logistischen Wachstums.<br />
log( Kd)<br />
x<br />
10 + 10<br />
= ; Falls die x-Achse logarithmisch aufgetragen wird: [D]=10 x ,<br />
5.4.5 Experimentelle Auswertung von <strong>Effekte</strong>n<br />
E<br />
1<br />
0,8<br />
0,6<br />
0,4<br />
0,2<br />
0<br />
Kd=0.001; E(max) = 1<br />
0 0,0005 0,001 0,0015 0,002 0,0025 0,003<br />
Abbildung 33: Dosis-Effekt-Funktion, Normalverlauf<br />
E = E<br />
max<br />
1 1<br />
=<br />
E E<br />
max<br />
1 1<br />
=<br />
E E<br />
Chemie Bützer<br />
max<br />
[ D]<br />
•<br />
Kd + [ D]<br />
Kd + [ D]<br />
•<br />
[ D]<br />
⎛ Kd ⎞<br />
• ⎜ + 1⎟<br />
⎝ [ D]<br />
⎠<br />
Für die grafische Darstellung:<br />
1 Kd 1 1<br />
= • +<br />
E E [ D]<br />
Emax<br />
max<br />
y = a • x + b<br />
[D]<br />
y-Achse: 1/E; x-Achse: 1/[D]; a= Kd/Emax; b=1/Emax
Beispiel: Berechnung mit einer Trendlinie (lineare Regressionsgerade)<br />
1/E<br />
6<br />
5<br />
4<br />
3<br />
2<br />
1<br />
0<br />
1/Emax<br />
51<br />
y = 1E-04x + 1<br />
-10000 0 10000 20000 30000 40000 50000<br />
1/Kd<br />
1/[D]<br />
Abbildung 34: Linewaver-Burk-Plot für Dosis-Effekt-Funktion zur Bestimmung von Kd und Emax.<br />
y=0; -1/Kd = -10'000; Kd = 0,000’1; Wirksamkeit, Kd-Wert = ED(50)<br />
x=0; 1/E = 1; Emax = 1; Maximale Aktivität, intrinsic activity<br />
Potentielle Toxizität (Wirksamkeit)<br />
Meist werden Gifte mit der Dosis in mg/kg (Körpergewicht) charakterisiert. Das ist für<br />
den Alltag sinnvoll, da es so möglich ist die Mengen abzuschätzen. Für die molekularen<br />
Mechanismen ist diese Angabe nicht sehr nützlich, weshalb 1977 von Luckey und<br />
Venugopal der Begriff der potentiellen Toxizität (pT50) mit der Einheit mol/kg geschaffen<br />
worden ist 51 :<br />
pT = - log(T) und LD(50) = T50;<br />
pT50 = - log(LD(50))<br />
Tabelle 17: Toxikologische Beurteilung mit pT-Werten<br />
Beurteilung<br />
pT50<br />
mol/kg Körpergewicht<br />
super-toxisch 6 0.000 001<br />
extrem-toxisch 5 0.000 01<br />
hoch-toxisch 4 0.000 1<br />
mässig-toxisch 3 0.001<br />
gering-toxisch 2 0.01<br />
praktisch untoxisch 1 0.1<br />
relativ harmlos 0 1<br />
harmlos -1 10<br />
Die moderne Toxikologie befasst sich intensiver als früher mit dem Aspekt<br />
Vergiftungsbilder zu erfassen und nicht nur Letalitäten zu zählen. Somit werden weit<br />
geringere Dosen bei Tierversuchen in ihren Wirkungen untersucht, als für schwere<br />
Krankheitsbilder notwendig sind.<br />
51 Luckey T.D., Venugopal B, Metal Toxicity in Mammals I, Plenum Press, New York/London, 1977<br />
Chemie Bützer
52<br />
Tabelle 18: Übersicht über einige toxische Substanzen 52<br />
Substanzen<br />
mg/kg mol/kg pT50<br />
Botulinus D 3.2•10 -7<br />
3.2•10 -16 15.49<br />
Tetanustoxin 1.67•10 -6<br />
2.53•10 -14 13.6<br />
Saxitoxin 1.4•10 -3<br />
9.14•10 -9 8.04<br />
Strychnin 0.98 2.93•10 -6 5.53<br />
Hg(II)-chlorid, HgCl2 5 1.84•10 -5 4.74<br />
Cyanwasserstoff, HCN 3 1.11•10 -4 3.95<br />
Morphin 285 9.99•10 -4 3.00<br />
Coffein 250 1.29•10 -3 2.89<br />
Natriumfluorid, NaF 125 2.98•10 -3 2.53<br />
Natriumchlorid, NaCl 2600 4.45•10 -2 1.35<br />
Bei der Angabe in mol pro kg Körpergewicht wird deutlich, wie wirksam die Moleküle<br />
respektive die Ionen sind. Die sehr grossen Botulinus D und Tetanustoxine als Moleküle<br />
zeigen ihre enorme Toxizität oder ihre Wirksamkeit mit dieser Einheit besonders<br />
deutlich.<br />
5.4.6 Praktische Anwendung und Auswertung<br />
5.4.6.1 Beispiel: Morphin<br />
Mäuse reagieren auf Morphium leicht sichtbar mit einer anormalen Haltung. Damit lässt<br />
sich die Wirkung dieser Droge in Abhängigkeit der verabreichten Dosis gut verfolgen.<br />
Normale Haltung einer Maus Haltungsanomalie einer Maus<br />
mit Morphium<br />
Abbildung 35: Wirkung von Morphin auf Mäuse (ganz auffälliges Benehmen, sichtbarer Effekt),<br />
Morphinmolekül<br />
52 Fuhrmann G.F., Allgemeine Toxikologie für Chemiker, B.G. Teubner, Stuttgart, 1994, 20<br />
Chemie Bützer
53<br />
HO<br />
O<br />
HO<br />
(-)-M.<br />
H N<br />
Molekül von der Rückseite zu � Konfigurationsformel von Morphin<br />
Abbildung 36: Das Molekül Morphin. Links: Stick and Ball-Modell mit der Elektronenhülle, rechts:<br />
Konfigurationsformel mit den chiralen Zentren<br />
Tabelle 19: Experimentelle Daten des Morphin-Versuchs mit Mäusen 53<br />
Dosis<br />
Mäuse mit Haltungsanomalie<br />
[D] mg/kg E (Effekt) Anzahl Mäuse von 10<br />
1 0<br />
2 1<br />
10 5<br />
20 6<br />
100 9<br />
140 10<br />
200 10<br />
E<br />
10<br />
8<br />
6<br />
4<br />
2<br />
0<br />
CH 3<br />
0 50 100 150 200<br />
Abbildung 37: Haltungsanomalie von Mäusen in Funktion der Morphin Dosis, lineare Darstellung<br />
53 Lüllmann H., Mohr K., Ziegler A., Taschenbuch der Pharmakologie, Georg Thieme Verlag, Stuttgart,<br />
1994, 53<br />
Chemie Bützer<br />
[D]
E<br />
10<br />
8<br />
6<br />
4<br />
2<br />
0<br />
54<br />
1 10 100 1000<br />
Abbildung 38: Halblogarithmische Darstellung; Haltungsanomalie von Mäusen<br />
(Summenhäufigkeit) in Funktion der Morphin Dosis<br />
Die beiden Darstellungen geben die Empfindlichkeitsverteilung der Mäuse gegenüber<br />
Morphin wieder. Ganz links, bei den kleinsten Dosen sind die empfindlichsten Tiere,<br />
ganz rechts, bei den höchsten Dosen die unempfindlichsten Tiere.<br />
Folgerung:<br />
Die Dosis-Effekt-Funktion zeigt in ihrer logarithmierten Form die Summenhäufigkeit<br />
der Empfindlichkeitsverteilung der Individuen gegenüber der betrachteten Substanz.<br />
1/E<br />
[D]<br />
1,2<br />
1<br />
0,8<br />
0,6<br />
0,4<br />
0,2<br />
0<br />
y = 1,8289x + 0,0747<br />
-0,2 -0,2<br />
-0,4<br />
0 0,2 0,4 0,6<br />
1/[D]<br />
Abbildung 39: Darstellung nach MMK (Michaelis-Menten-Kinetik); Haltungsanomalie von Mäusen<br />
in Funktion der Morphin Dosis<br />
y=0; x = -(-0,0747/1,8289) = -0,0408 = -1/Kd; Kd = 24.5 mg/kg � ED(50)=24.5 mg/kg<br />
x=0; y = 0,0747 = 1/Em; Em = 13.4; Maximale Aktivität (diese Angabe macht deutlich,<br />
dass das Experiment noch eine grosse Unsicherheit hat, da als Emax ja höchstens 10<br />
auftreten dürfte).<br />
Chemie Bützer<br />
„Gift in den Händen eines Weisen ist ein Heilmittel,<br />
ein Heilmittel in den Händen eines Toren ist ein Gift.“
55<br />
(Casanova 54 , Memoiren, Buhl Berlin 1850/51)<br />
5.4.6.2 Übertragbarkeit der Daten<br />
Die Empfindlichkeiten für molekulare Wirkungen sind genetisch festgelegt. So können<br />
z.B. unterschiedeliche Tierarten auf Grund ihrer unterschiedlichen Enzymmuster<br />
unterschiedlich reagieren. Andererseits können aber auch die Rezeptoren selbst<br />
molekulare Unterschiede aufweisen.<br />
450<br />
400<br />
350<br />
300<br />
250<br />
200<br />
150<br />
100<br />
50<br />
0<br />
Ratte<br />
Ratte<br />
Kaninchen<br />
Kaninchen<br />
Maus<br />
Mensch<br />
Mensch<br />
Hund<br />
Hund<br />
0 2 4 6<br />
Schlafdauer (Min.)<br />
HWZ (min.)<br />
Abbildung 40: Schlafdauer und biologische Halbwertszeit (Abbau) von Hexobarbital (100 mg/kg,<br />
Hund: 50 mg/kg) 55<br />
Das Beispiel zeigt wohl grosse Unterschiede auf, und lässt bei einer Übertragung von<br />
Stoffwirksamkeiten zur Vorsicht mahnen. Andererseits zeigt dieses Beispiel auch,<br />
worauf die Unterschiede wahrscheinlich zurückzuführen sind – andere Enzymmuster.<br />
Analogie zur Säure-Basen-Titration<br />
54 Casanova, Giacomo Girolamo, Chevalier de Seingalt (1725-1798), italienischer Abenteurer und<br />
Schriftsteller, geboren in Venedig.<br />
55 Quinn zitiert in: Forth W., Henschler D., Rummel W., Starke.(Hrsg.), Allgemeine und spezielle<br />
Pharmakologie und Toxikologie, Bibliographisches Institut & F.A. Brockhaus AG, Mannheim,<br />
1992, 7<br />
Chemie Bützer
pH-Wert<br />
14<br />
12<br />
10<br />
8<br />
6<br />
4<br />
2<br />
0<br />
56<br />
0 20 40 60 80 100 120 140 160 180<br />
Neutralisationsgrad (%)<br />
Essigsäure<br />
Salzsäure<br />
Abbildung 41: Neutralisation einer starken Säure (HCl) und einer schwachen Säure (Essigsäure)<br />
je c = 1 mol/l mit Natronlauge.<br />
5.4.6.3 Beispiel: Metamphetamin<br />
„Drogen negieren die Menschenrechte, sie negieren wesentliches Menschsein,<br />
da sie den Menschen abhängig und unfrei machen.“<br />
(Jeanne Hersch, 1997, II. Internationales Symposium gegen Drogen in der<br />
Schweiz in Zofingen)<br />
Droge: Hydrochlorid: Speed, Ice, Yaba, Thai-Pillen, Shaba, Crystal, Perlik bzw. Pernik<br />
(czech.- Lebkuchen), Crystal-Speed, Pervitin®.<br />
Weisses kristallines Pulver, wird in der Regel gesnieft. Die Substanz ist etwa 3-6 Tage<br />
nach Gebrauch im Urin nachweisbar.<br />
Die Wirkdauer beträgt 4-20 Stunden, bei höheren Dosierungen kann die Wirkung auch<br />
über 24 Stunden andauern - Adrenalin, Noradrenalin und Dopamin werden freigesetzt.<br />
HN<br />
Metamphetamin<br />
(als Racemat!)<br />
HO<br />
OH<br />
Dopamin<br />
(achiral)<br />
H 2N<br />
HO<br />
OH<br />
H<br />
HN<br />
OH<br />
HO<br />
OH<br />
H<br />
H 2N<br />
OH<br />
Adrenalin (chiral!) Noradrenalin (- 1C)<br />
(chiral!)<br />
Abbildung 42: Die Konstitutionsformeln von Metamphetamin und den von dieser Droge<br />
beeinflussten Neurotransmittern.<br />
Die Folge der Metamphetaminaufnahme ist erhöhte Aufmerksamkeit, gesteigertes<br />
Selbstbewusstsein, vermindertes Schmerzempfinden, kein Hunger- und Durstgefühl,<br />
Chemie Bützer
erhöhter Blutdruck, beschleunigter Puls und Atmung, verstärkte zwanghafte planlose<br />
motorische Aktivität, gesteigerter Rededrang.<br />
57<br />
Nebenwirkungen sind: Auftreten können: Zittern, Unruhe, Schlafstörungen, erweiterte<br />
Pupillen, eingeschränktes Kurzzeitgedächtnis, optische + akustische Halluzinationen,<br />
Aggressionen, Herzrhythmusstörungen. Bei Überdosis: Fieber, Schwitzen, trockener<br />
Mund, Schwindelgefühl, Zittern, Kollaps. An den darauf folgenden Tagen sind<br />
Depressionen, Trägheit, Paranoia, Extremhunger und 24- bis 48-stündiger tiefer Schlaf.<br />
Die möglichen Nebenwirkungen können bis zu 2 Wochen andauern.<br />
Nach längerem Konsum von Crystal können aggressives Verhalten, starker Gewichtsverlust,<br />
Hautentzündungen, Magenschmerzen, Magendurchbruch, Herzrhythmusstörungen,<br />
paranoide Wahnvorstellungen bis zur Amphetaminpsychose und<br />
Organblutungen auftreten.<br />
Zur Toleranzentwicklung, man braucht grössere Mengen, und die Gefahr starker<br />
psychischer Abhängigkeit (Sucht) sind gegeben (Missempfindungen beseitigen,<br />
Euphorie erzeugen, periodische oder ständige Einnahme). Das Absinken des<br />
Konzentrationsniveaus (Entzug) erzeugt Abstinenzerscheinungen, die bis zu<br />
schwersten Kreislaufstörungen reichen können.<br />
HN<br />
Konstitutionsformel<br />
R- und S-Form in den Drogen 50/50%<br />
Abbildung 43: Formel und Modelle von Metamphetamin<br />
Stick and Ball –Modell mit<br />
Elektronendichteverteilung auf der van<br />
der Waals’schen Oberfläche<br />
Experimentelle Daten mit männlichen Mäusen 56 . Bestimmung der Letalität bei zwei<br />
verschiedenen Umgebungstemperaturen.<br />
56 Kuschinsky G., Lüllmann H., Kurzes Lehrbuch der Pharmakologie, Georg Thieme Verlag, Stuttgart,<br />
1967, 267<br />
Chemie Bützer
% Letalität<br />
100<br />
80<br />
60<br />
40<br />
20<br />
0<br />
58<br />
0 50 100 150 200 250<br />
Dosis (mg/kg)<br />
Abbildung 44: Letalität von Metamphetamin bei männlichen Mäusen bei unterschiedlichen<br />
Umgebungstemperaturen<br />
Das Beispiel macht deutlich, dass die Umweltbedingungen einen beachtlichen Einfluss<br />
auf die Wirksamkeit (Lage der Kurve) und die Empfindlichkeit (Steilheit der Kurve)<br />
haben. Dieser lässt sich in unserem Beispiel quantitativ abschätzen.<br />
30°C<br />
25°C<br />
Umgebungstemperatur : 25°C Umgebungstemperatur : 30°C<br />
Wirksamkeit : Wirksamkeit :<br />
LD(50) ≈ 150 mg/kg = Kd LD(50) ≈ 45 mg/kg = Kd<br />
Empfindlichkeit (bei 50%): Empfindlichkeit (bei 50%):<br />
Steigung etwa 20/15 = 1.3 Steigung etwa 20/28 = 0.7<br />
Die log Dosis-Effekt-Kurve macht die Unterschiede besonders deutlich:<br />
% Letalität<br />
100<br />
90<br />
80<br />
70<br />
60<br />
50<br />
40<br />
30<br />
20<br />
10<br />
0<br />
1.00 1.50 2.00 2.50<br />
log [D] (mg/kg)<br />
Abbildung 45: Letale Wirkung von Methamphetamin auf männliche Mäuse<br />
30°C<br />
25°C<br />
Folgerung:<br />
Die Umgebungstemperatur kann auf die Wirksamkeit und die Empfindlichkeit von<br />
<strong>Wirkstoffe</strong>n einen wesentlichen Einfluss haben.<br />
Chemie Bützer
5.4.6.4 Designerdrogen<br />
Das chemische Grundgerüst des Dopamins war Ausgangspunkt für viele<br />
Designerdrogen, so auch für das Metamphetamin. Das Ausgangsmolekül ist sehr<br />
einfach und die chemischen Reaktionen recht gut bekannt.<br />
R 5<br />
R 6<br />
R 4<br />
59<br />
R 3<br />
H2 C H H<br />
C N<br />
Substanz Substituenten<br />
R 2<br />
R 1<br />
R1 R2 R3 R4 R5 R6<br />
Dopamin H- H- H-<br />
HO<br />
- HO- H-<br />
Amphetamin H- CH3- H- H- H- H-<br />
Metamphetamin CH3- CH3- H- H- H- H-<br />
PMA (para-Methoxyamphetamin) H- CH3- H- H- CH3O<br />
H-<br />
-<br />
Amphetaminil (AN1)<br />
C6H5-<br />
CH(CN)-<br />
CH3- H- H- H- H-<br />
DOM (STP) H- CH3- CH3O<br />
H- CH3-<br />
-<br />
CH3O<br />
-<br />
MDA H- CH3- H- -O-CH2-O- H-<br />
MDMA (Ecstasy) CH3- CH3- H- -O-CH2-O- H-<br />
MDE C2H5- CH3- H- -O-CH2-O- H-<br />
MBDB CH3- C2H5- H- -O-CH2-O- H-<br />
Abbildung 46: Von Dopamin abgeleitete Designerdrogen (R2 ≠ H � chiral)<br />
Die Unterschiede in der Wirkung können deshalb beachtlich sein, weil sich die<br />
sterischen Verhältnisse und vor allem die Lipophilie teilseise stark ändern.<br />
Berücksichtigt man zusätzlich noch die nahe Analogie zu den beiden Neurotransmittern<br />
Adrenalin und Noradrenalin, dann wird deutlich, dass sich hier ein grosses<br />
Wirkungsspektrum verbergen muss. Wird zusätzlich noch in Rechnung gezogen, dass<br />
das Serotonin auch nicht sehr verschieden ist, dann wird deutlich, warum die<br />
chemischen „Spielereien“ hier so „ergiebig“ waren.<br />
HN<br />
Abbildung 47: Die Droge Metaphetamin und der Neurotransmitter Serotonin im Vergleich der<br />
Konstitutionsformeln<br />
Chemie Bützer<br />
HO<br />
NH 2<br />
N<br />
H
5.4.6.5 Ökologisches Beispiel<br />
Die Dosis-Effekt-Funktion lässt sich nicht nur beim Menschen, sondern<br />
auch für Untersuchungen von wassergefährdenden Stoffen einsetzen, sie<br />
spielt somit auch in der Ökologie eine bedeutende Rolle.<br />
60<br />
Die Wirksamkeit von wassergefährdenden Stoffen wird mit einfachen Tests vorgenommen.<br />
Im vorliegenden Fall wurde die Wirkung von Quecksilber(II)chlorid (HgCl2 �<br />
Hg 2+ (aq) + 2 Cl - (aq)) auf die Eier des Zebrabärblings untersucht 57 . 20 Eier wurden<br />
eingesetzt. Nach 5 Tagen wurden die Anzahl der toten Eier ausgezählt. Die<br />
Konzentration der gelösten Substanz in Mikrogramm pro Liter zeigt die hohe<br />
Ökotoxizität dieser Substanz an.<br />
tote Eier<br />
20<br />
18<br />
16<br />
14<br />
12<br />
10<br />
8<br />
6<br />
4<br />
2<br />
0<br />
0 10 20 30 40 50<br />
Konz. (Mikrog./l)<br />
Abbildung 48: Wirkung von Quecksilber(II)chlorid (HgCl2) auf 20 Eier des Zebrabärblings<br />
(Brachydanio) nach 5 Tagen.<br />
Ein Hinweis zu den verwendeten Einheiten:<br />
Die Konzentrationsangabe in Mikroliter pro Liter Wasser (μl/l) ist nicht sinnvoll, da das<br />
wirksame Teilchen hier das aquotisierte Hg 2+ -Ion ist. Die Molmasse von HgCl2 beträgt<br />
271.5 g/mol. Die Molmasse von Hg(NO3)2 beträgt 342.6 g/mol. Somit sind 10 μg/l HgCl2<br />
gleich wirksam wie 7.9 μg/l Hg(NO3)2. Wären die Konzentrationen chemisch korrekt in<br />
Teilchen pro Liter angegeben, dann wären diese verwirrenden Unterschiede nicht<br />
vorhanden.<br />
Folgerung:<br />
Konzentrationen sind in Teilchen pro Volumen, in Mol pro Liter und nicht in Masse pro<br />
Volumen anzugeben.<br />
57 Besch W.K., Scharf B.W., Mayer E., Toxizitätstests mit Goldorfe und Zebrabärbling. Vorschläge zur<br />
Durchführung und Bemerkungen zur Aussagekraft von Toxizitätstesten mit Goldorfe (Leuciscus<br />
idus) und dem Zebrabärbling (brachydanio rerio), in: Roth, Wassergefährdende Stoffe, 5. Erg.Lfg<br />
5/87, II-*.1, S. 27-28<br />
Chemie Bützer
1/E<br />
0.4<br />
0.35<br />
0.3<br />
0.25<br />
0.2<br />
0.15<br />
0.1<br />
0.05<br />
0<br />
61<br />
y = 1.4531x + 0.0547<br />
R 2 = 0.9276<br />
0 0.05 0.1 0.15 0.2 0.25<br />
1/[D]<br />
Abbildung 49: Linewaver-Burk-Plot der Quecksilbertoxizität<br />
y=0, Kd = 27 μg/l � LC(50) ; halbletale Konzentration (LC : letal concentration)<br />
x=0, y = 0,0547 = 1/Em; Emax = 19 � Diese Abschätzung stimmt mit der Anzahl<br />
eingesetzter Eier (20) sehr gut überein.<br />
Stoffe die persitent, bioakkumulierbar oder toxisch sind, werden mit PBT abgekürzt.<br />
Werden Kombinationen mehrere <strong>Wirkstoffe</strong> untersucht, so lässt sich der resultierende<br />
Effekt auf die Komponenten aufschlüsseln. Drei grundsätzlich unterschiedliche<br />
Interaktionen können unterschieden werden:<br />
Beispiel: Komponente A: Effekt 6; Komponente B: Effekt 11<br />
Tabelle 20: Kombinationen von <strong>Effekte</strong>n<br />
Additiver Effekt<br />
Antagonismus Synergismus<br />
6 & 11 = 17 6 & 11 = 5 6 & 11 = 66<br />
Tabelle 21: Beispiel eines Synergismus: Lungenkrebsfälle<br />
Risikogruppe<br />
Lungenkrebsfälle/1000 Personen<br />
normal 0.2 - 0.3<br />
Asbest 0.3<br />
Rauchen 3 - 5<br />
Asbest + Rauchen 20 - 30<br />
Weitere Synergismen:<br />
Nicotin und Ammoniak (die Wirkung von Nikotin steigt um Faktoren, Aufnahme)<br />
Kokain und Backpulver (die basische Wirkung steigert auch hier den Effekt)<br />
Chemie Bützer
62<br />
5.4.7 Das Occupationsmodell mit Antagonisten<br />
Kompetitive Antagonisten 58<br />
Diese Substanzen besitzen wie die Agonisten eine oft hohe Affinität zum Rezeptor,<br />
ohne jedoch eine Wirkung auszulösen – es sind Inhibitoren (direkte Konkurrenten zum<br />
Wirkstoff).<br />
Normale Wirkung: D + R � DR;<br />
Mit Inhibitor: I + R � RI;<br />
K<br />
[ R<br />
E = k<br />
E<br />
i<br />
[ R]<br />
• [ I]<br />
= ;<br />
[ IR]<br />
tot<br />
max<br />
] =<br />
3<br />
= k<br />
[ R]<br />
+<br />
• [ DR];<br />
3<br />
• ([ R<br />
[ DR]<br />
tot<br />
+<br />
[ IR];<br />
] − [ IR]);<br />
Eingesetzt und umgeformt:<br />
E = E<br />
E/Emax<br />
max<br />
[ D]<br />
•<br />
⎛ [ I]<br />
⎞<br />
Kd<br />
• ⎜1+<br />
⎟ +<br />
⎝ Ki<br />
⎠<br />
[ D]<br />
;<br />
1<br />
0.9<br />
0.8<br />
0.7<br />
0.6<br />
0.5<br />
0.4<br />
0.3<br />
0.2<br />
0.1<br />
0<br />
-5 -3 -1 1 3<br />
log[D]<br />
[I]=0<br />
[I]=0.01<br />
[I]=0.1<br />
Abbildung 50: Kompetitiver Antagonismus (Kd = 0.001, Ki = 0.001); [I] = 0: kein Antagonist<br />
vorhanden<br />
Je höher die Konzentration des Antagonismus, desto geringer wird die Wirksamkeit.<br />
58 Fuhrmann G.F., Allgemeine Toxikologie für Chemiker, B.G. Teubner, Stuttgart, 1994, 129<br />
Chemie Bützer
Nichtkompetitive Antagonisten<br />
63<br />
Diese Substanzen binden nicht an der Stelle des Antagonisten, sondern führen eine<br />
Inhibition mit einem anderen Mechanismus herbei (z.B. Veränderung der Konformation<br />
des Rezeptors).<br />
E = E<br />
Chemie Bützer<br />
max<br />
E/Emax<br />
•<br />
K<br />
d<br />
⎛ [ I]<br />
• ⎜<br />
⎜1+<br />
⎝ Ki<br />
[ D]<br />
;<br />
⎞ ⎛ [ I]<br />
⎞<br />
⎟ + [ D]<br />
• ⎜<br />
⎜1+<br />
K ⎟<br />
⎠ ⎝ i ⎠<br />
1<br />
0.9<br />
0.8<br />
0.7<br />
0.6<br />
0.5<br />
0.4<br />
0.3<br />
0.2<br />
0.1<br />
-5 -3 -1 1<br />
log[D]<br />
0<br />
[I]=0<br />
[I]=0.001<br />
[I]=0.01<br />
Abbildung 51: Nichtkompetitiver Antagonismus (Kd=0.001, Ki = 0.001); [I] = 0: kein Antagonist<br />
vorhanden.<br />
Mit zunehmender Konzentration des nichtkompetitiven Antagonisten nimmt die<br />
maximale Wirkung ab und die Kurve flacht ab.<br />
Beispiel: Schmerzlindernde Wirkung von Acetylsalicylsäure<br />
HO<br />
O<br />
COX<br />
OH<br />
O<br />
OH<br />
Arachidonsäure<br />
O-<br />
O<br />
O<br />
Prostaglandin H 2<br />
Cyclo-<br />
Oxygenase<br />
CH -CO- 3 O-<br />
OH<br />
Acetyl-<br />
Abbildung 52: Arachidonsäure wird am Enzym Cyclooxygenase zum schmerzauslösenden<br />
Prostaglandin synthetisiert. ASS acetyliert das Enzym COX und unterdrückt so die Bildung von<br />
Prostaglandin H2.<br />
O
5.5 Hormesis<br />
64<br />
Von fast allen Nahrungsmitteln 59 , Mineralstoffen, Spurenelementen 60 und<br />
Medikamenten ist bekannt, dass geringe Dosen eine positive, grosse Dosen eine<br />
schädliche Wirkung auf den Organismus haben können. Dieses Verhalten beschreibt<br />
man mit der Hormesis. Dieser dosisabhängige „Umkehreffekt“ ist nicht nur bei<br />
synthetischen Medikamenten, sondern auch bei Medizinalpflanzen 61 (Phytopharmaka)<br />
gut bekannt 62 z.B. Baldrian (Valerianin, a-Methylpyrrylketon), Broccoli (Sulforaphane),<br />
Herbstzeitlose (Colchicin), Fingerhut (Digitalis), Kamille (Chamazulen), Johanniskraut<br />
(Flavonoide), Knoblauch (Allicin, Allium), Mistel (Viscotoxine), Rotwein (Resveratrol),<br />
Weidenrinde (Salicylsäure).<br />
Sogar bei krebserzeugenden Stoffen ist Hormesis nachgewiesen worden 63, 64 .<br />
Die Dosis-Wirkungs-Kurve, welche einen „Umkehreffekt“ zeigt, also nicht monoton ist,<br />
nennt man Hormesis. Damit ist es möglich die Wirkung von Colchicin aus der<br />
Herbstzeitlose gegen Gicht und die Wirkung bei höheren Konzentrationen als Gift in<br />
einer Darstellung zu zeigen.<br />
Schaden-Nutzen<br />
.<br />
1<br />
0.5<br />
0<br />
-0.5<br />
-1<br />
Hormesis<br />
0 0.30 0.60 0.90 1.20 1.50<br />
log (Dosis)<br />
Abbildung 53: Dosis-Wirkungs-Kurve von Colchicin. Positive y-Werte stellen die<br />
pharmakologische Wirkung gegen Gicht (Nutzen), negative y-Werte die toxikologische Wirkung<br />
als Mitose-Hemmstoff (Schaden) dar.<br />
Bei relativ kleinen Konzentrationen ist ein Nutzen von Colchicin als Medikament<br />
vorhanden, bei grossen Konzentrationen tritt ein immer grösserer Schaden als Gift auf.<br />
59 Hayes D.P., Nutritional hormesis, Eur J Clin Nutr, 61, August 2, 2006, pp.147-159<br />
60 Calabrese E.J., Mattson M., Best in small doses, New Scientist, 9 August, 2008, pp.36-39<br />
61 Hiller K.M., Lexikon der Arzneipflanzen und Drogen, Spektrum, Akademischer Verlag, Melzig –<br />
Heidelberg, CD-ROM, ISBN 3-8274-0414-2, 2000<br />
62 Calabrese E.J., Baldwin L.A., Hormesis as a Biological Hypothesis, Environ Health Perspect,106<br />
(Suppl 1),1998, pp.357-362<br />
63 Kinoshita A., Wanibuchi H., Wei M., Fukusuma Sh., Hormesis in Carcinogenity of Non-Carcinogens, J<br />
Toxicol Pathol, 19, 2006, pp.11-122<br />
64 Calabrese E.J., Staudenmayer J.W., Stanek E.J., Hoffmann G.R., Hormesis Outperforms Threshold<br />
Model in National Cancer Institute Antitumor Drug Screening Database, Toxicological Sciences,<br />
94(2), 2006, pp.368–378<br />
Chemie Bützer
5.6 Gefährlichste <strong>Effekte</strong><br />
65<br />
Die gefährlichsten <strong>Effekte</strong> zeigen sich dadurch, dass keine oder fast keine<br />
Regeneration möglich ist, dass also irreversible Veränderungen auftreten. Diese lassen<br />
sich für den Menschen grob wie folgt einteilen:<br />
Abbildung 54 : Irreversible toxische <strong>Effekte</strong><br />
Ort/Wirkung Hinweise<br />
Zentralnervensystem Praktisch keine Regeneration der Nervenzellen<br />
möglich<br />
Augenlinse<br />
Schädigung bei der Bildung der Linsenfasern führt<br />
zu irreversibler Trübung<br />
Missbildungen (teratogen) Keine Erholung möglich. Zelltod bei der<br />
Organogenese kann Entwicklungsstörungen geben.<br />
Mutagenese (mutagen)<br />
Erbgutveränderungen<br />
Carcinogenese (carcinogen)<br />
Somatische Mutationen<br />
Massnahme gegen:<br />
Aufnahme über die Lunge: Abzug<br />
Aufnahme über die Haut: Handschuhe<br />
Chemie Bützer
5.7 Stereochemie der <strong>Effekte</strong><br />
Chirale Moleküle binden an den Rezeptoren immer dann unterschiedlich, wenn<br />
mindestens 3 verschiedene Bindungsstellen vorhanden sind – was meist der Fall ist.<br />
66<br />
Tabelle 22: Wirkungsunterschiede einiger Isomeren<br />
Substanz Wirkung Wirkung %<br />
(nativ)<br />
Isoprenalin (Racemat)<br />
HO<br />
HO<br />
(R)-Adrenalin<br />
HO<br />
Muscarin<br />
HO<br />
H 3 C<br />
HO<br />
O<br />
L-Ascorbinsäure<br />
(S)-Propanolol<br />
HO<br />
HO<br />
O<br />
OH<br />
CH<br />
H<br />
CH 2 NH CH(CH 3 ) 2<br />
C CH 2 NH CH 3<br />
OH<br />
CH 2<br />
O<br />
O<br />
+<br />
N(CH3 ) 3<br />
OH<br />
OH<br />
OH<br />
H<br />
H<br />
N<br />
Cl -<br />
bronchodilatorisch<br />
(Bronchien<br />
erweiternd)<br />
vasokonstriktorisch<br />
(Gefäss<br />
zusammenziehend)<br />
muscarinartig<br />
(Acetylcholin-<br />
Wirkung im<br />
parasymp. Teil)<br />
antiscorbutisch<br />
(Gegen Skorbut<br />
wirkend)<br />
blutdrucksenkend<br />
(R) �<br />
contraseptisch<br />
Wirkung %<br />
(andere<br />
Chiralität)<br />
50 - 80 1<br />
12-15 1<br />
700 1<br />
100 0<br />
100 0<br />
Pharmaka mit enatiomerem Ballast:<br />
„The remarkable discrepancy between, on the one hand, the high degree of<br />
purity required for pharmaceuticals and, on the other hand, the acceptance of<br />
50% impurity, as long as isomeric ballast is involved, should be a matter of<br />
serious concern.“<br />
E. J. Ariens, 1986<br />
Chemie Bützer
67<br />
Enthält ein Molekül 2 chirale Zentren, dann können die Wirkungen wie folgt aussehen:<br />
O 2N<br />
Cl<br />
Cl<br />
O<br />
NH<br />
OH<br />
OH<br />
OH, NH Wirksamkeit<br />
R,L : 100<br />
L,R : 1-2<br />
L, L : < 0.4<br />
R, R: 1 Dämpfung; es braucht mehr als 1 Drug Molekül für ein Signal (z.B. 2 D)<br />
Mathematische Formulierung der erweiterten Dosis- Effekt- Kurve (Herleitung analog<br />
der einfachen Form mit a=1):<br />
a [ D]<br />
a [ D]<br />
+ Kd<br />
[ ]<br />
[ ] a<br />
a<br />
E<br />
D + Kd<br />
Relativer Effekt : = ; Maximaler Effekt: Em = E • ;<br />
Em<br />
D<br />
[D] : Dosis (mg/kg) ;<br />
Kd : Dissozitationskonstante (mg/kg) � Wirksamkeit<br />
a: Stöchiometrischer Faktor � Empfindlichkeit<br />
Chemie Bützer
elative Auswirkungen<br />
68<br />
1<br />
0.9<br />
0.8<br />
0.7<br />
0.6<br />
0.5<br />
0.4<br />
0.3<br />
0.2<br />
0.1<br />
0<br />
0.00001 0.0001 0.001 0.01 0.1 1 10<br />
[D]<br />
a=0.5<br />
Abbildung 57: Dosis-Effekt-Funktionen mit den stöchiometrischen Faktoren a=1,2, 0.5 (Kd = 1)<br />
Beispiel: a = 2<br />
In unserer Netzhaut müssen pro Rezeptor 2 Photonen auftreffen, damit ein<br />
Nervenimpuls weitergeleitet wird � a=2.<br />
Beispiel: a = ½<br />
Die Situation, wo ein Wirkstoff mit 2 Rezeptoren reagiert, tritt beispielsweise bei den<br />
alkylierenden Medikamenten auf, welche in der Tumortherapie verwendet werden (Bsp.:<br />
Busulfan: H3C-SO2-O-(CH2)4-OSO2-CH3) 65.<br />
[ D]<br />
a [ D]<br />
+<br />
E<br />
E rel = = ; a<br />
Em Kd<br />
a E rel<br />
[ D]<br />
= Kd • ;<br />
1 − E rel<br />
Differenzieren:<br />
⎛ E ⎞ rel<br />
dln[<br />
D]<br />
= a • dln<br />
⎜<br />
1 E ⎟<br />
⎝ − rel ⎠<br />
dlErel<br />
=<br />
dlog[<br />
D]<br />
1<br />
a<br />
•<br />
a<br />
2.<br />
303 • E<br />
rel<br />
= 1;<br />
E<br />
=<br />
rel<br />
1<br />
• E<br />
a<br />
• ( 1−<br />
E<br />
=<br />
rel<br />
[ D]<br />
a [ D]<br />
+<br />
dE<br />
rel<br />
);<br />
rel<br />
a<br />
• ( 1−<br />
E<br />
;<br />
Kd<br />
Steigung der Kurve bei 50% Wirkung (Wendepunkt): Erel = 0.5 (siehe Abbildung);<br />
a = 1: Steigung: 0.576<br />
a = 2: Steigung: 1.15<br />
a = 0.5: Steigung: 0.288<br />
log[ D]<br />
⎛ Erel<br />
= logKd<br />
+ log<br />
⎜<br />
⎝1<br />
− E<br />
rel<br />
⎞<br />
⎟<br />
⎟;<br />
⎠<br />
65 Fuhrmann G.F., Allgemeine Toxikologie für Chemiker, B.G. Teubner, Stuttgart, 1994, 126<br />
Chemie Bützer<br />
rel<br />
;<br />
)<br />
a=2<br />
a=1
69<br />
Analogie zur Puffer-Gleichung von Henderson-Hasselbalch:<br />
+<br />
⎛ [ HA]<br />
⎞<br />
log[ H3<br />
O ] = logKd<br />
+ log⎜<br />
⎟; −<br />
⎝ [ A ] ⎠<br />
Analogie zur Gleichung von Nernst:<br />
0.<br />
05916 ⎛ [ Ox]<br />
⎞<br />
E = E0<br />
+ log⎜<br />
⎟; z ⎝ [Red]<br />
⎠<br />
Interpretation der Kurven:<br />
1. Lage der Kurve: Wirksamkeit (Affinität der Substanz zum Rezeptor) � Kd<br />
2. Steilheit der Kurve: Empfindlichkeit (Stöchiometrie von Rezeptor und Wirkstoff) �<br />
a<br />
3. Maximaler Effekt: Intrinsic activity � [Rtot]<br />
5.8 Resistenzbildung bei Antibiotika<br />
Antibiotika zielen darauf ab, den Stoffwechsel von Mikroorganismen gezielt zu stoppen<br />
oder mindestens zu verlangsamen. Andererseits bauen die Mikroorganismen jede nur<br />
mögliche Strategie auf, um selbst zu überleben. Sie passen somit ihren Stoffwechsel<br />
den neuen Umweltbedingungen mit Antibiotika an.<br />
Alle Organismen sind vollbeschäftigt als Problemlöser.<br />
Ihr erstes Problem ist, zu überleben.<br />
(Karl R. Popper, Auf der Suche nach einer besseren Welt, Piper 1987, 23)<br />
Ihr sehr rascher Generationenwechsel begünstigt diese Anpassungsvorgänge. Somit<br />
versagen die Antibiotika, die vom Menschen verwendet werden, weil die Mikroorganismen<br />
ihre sehr grosse Flexibilität und Anpassungsmöglichkeiten ausspielen. Wer<br />
nicht arrogant auf die Kleinstlebewesen (incl. Viren) hinunterblickt muss erkennen, dass<br />
der Kampf ums Überleben nie enden kann – die Suche nach neuen Abwehrmitteln wird<br />
immer notwendig sein. Die Überwindung der Zellwand mit dem richtigen pKs-Wert ist<br />
dabei nur ein kleiner, aber notwendiger Faktor.<br />
Wirkung<br />
Bereich der Unwirksamkeit<br />
Bereich der<br />
Unschädlichkeit<br />
(Heilmittel)<br />
Bereich der<br />
schädlichen<br />
Wirkung<br />
(toxische<br />
Dosen)<br />
Abbildung 58: Dosis und Wirkung als Zusammenfassung<br />
Chemie Bützer<br />
Bereich der tödlichen<br />
Wirkung (letale Dosen)<br />
Dosis
70<br />
6 Haber'sche Regel, ct-Produkt und Dosis<br />
6.1 Modellvoraussetzungen<br />
Als der Erste Weltkrieg 1914 ausbrach wurde Fritz Haber zum Berater der Deutschen<br />
Heeresführung und organisierte Gasangriffe und Verteidigungen gegen Giftgase.<br />
Von ihm stammte die Formel :<br />
T = c • t (Tödlichkeitsprodukt = [Gift-Konzentration] • Zeit � Haber’sche Regel).<br />
ct-Produkt (hat nur in einem mittleren Konzentrationsbereich Gültigkeit.)<br />
Wirkung prop. c • t; W ∝ ct<br />
Auf der Basis dieses Modells sind toxikologische Werte, vor allem für hochtoxische<br />
Gase, z.B. chemische Kampfstoffe definiert:<br />
ICt50 = Incapacity Concentration für 50% der Betroffenen (mg/ m 3 •min)<br />
LCt50 = Letale Konzentration für 50% der Betroffenen (mg/ m 3 •min)<br />
Umrechnung von Einheiten bei 20°C:<br />
3 Molmasse<br />
mg/<br />
m =<br />
• ppm<br />
24.<br />
06<br />
24.<br />
06<br />
3<br />
ppm =<br />
• mg/<br />
m<br />
Molmasse<br />
Tabelle 23: Bei gasförmigen oder rauchförmigen Stoffen gebräuchliche Einheiten (nicht SI) und<br />
ein Vergleich (rechts)<br />
ppm : parts per million 1/1 000 000 1 g pro Tonne (31 Sekunden pro Jahr)<br />
ppb : parts per billion 1/1 000 000 000 1 mg pro Tonne (3/100 Sekunden/Jahr)<br />
ppt : parts per trillion 1/1 000 000 000 000 1 μg pro Tonne (1 Sek. In 32'688 Jahren)<br />
ppq : parts per quadrillion 1/1 000 000 000 000 000 1 Zucker im Walensee (2490 Mia. Liter)<br />
1 ppt heisst: 1 Weizenkorn auf 1000 Tonnen !!!<br />
Ein Stoff wird über längere Zeit über die Atemluft aufgenommen. Die Dosis ist die<br />
aufgenommene Menge eines Stoffes. Je rascher geatmet wird, desto mehr Luft, und<br />
damit auch Gase in der Luft werden aufgenommen. Folgedessen ist die Dosis von der<br />
Atemrate k abhängig.<br />
Chemie Bützer
71<br />
Tabelle 24: Mittlere Atemraten für den Menschen (Atemzeitvolumen)<br />
Tätigkeit Atemzeitvolumen<br />
Liter/Stunde<br />
Atemzeitvolumen<br />
AZV<br />
Liter/Minute<br />
Atemzeitvolumen<br />
m 3 /s<br />
Liegen 300 5 0.000’083<br />
Sitzen 400 6. 7 0.000’11<br />
Stehen 600 10 0.000’17<br />
leichte Arbeit 1000 17 0.000’28<br />
mittlere Arbeit 1600 27 0.000’44<br />
schwere Arbeit 3000 50 0.000’83<br />
schwerste Arbeit 4000 67 0.001’1<br />
Atemrate Liter/Stunde<br />
4500<br />
4000<br />
3500<br />
3000<br />
2500<br />
2000<br />
1500<br />
1000<br />
500<br />
0<br />
Liegen<br />
Sitzen<br />
Stehen<br />
leichte Arbeit<br />
mittlere Arbeit<br />
Abbildung 59: Durchschnittliche Atemraten des Menschen<br />
schwere Arbeit<br />
schwerste Arbeit<br />
Für gasförmige Stoffe, die mit der Atemluft aufgenommen werden gilt:<br />
D = konst. • t • k • c<br />
D : Dosis (kg)<br />
t : Expositionszeit (s)<br />
k : Atemrate (m 3 /s)<br />
c : Konzentration (kg/m 3 )<br />
konst.: Konstante, welche ein Mass für die Resorption ist (konst. = 1 � alles).<br />
Diese erweiterte Haber'sche Regel bestätigt die intuitive Beurteilung, dass die Wirkung<br />
eines Schadstoffes in der Luft umso grösser ist, je grösser die Konzentration, je länger<br />
die Einwirkungsdauer und je schneller die Atmung (Atemrate).<br />
Geht man bei Giften vom konservativen Fall, bei Medikamenten vom günstigsten Fall<br />
der vollständigen Resorption aus, dann wird konst. = 1.<br />
Soll für die Dosis nur der Teil berücksichtigt werden, der oberhalb einer bestimmten<br />
Schwellkonzentration cs liegt, dann lautet die Formel:<br />
Chemie Bützer
72<br />
Erweitertes ct-Produkt<br />
(c − c s ) + ABS(c − c s )<br />
Wirksame Dosis D: D = t • k •<br />
;<br />
2<br />
t : Expositionszeit (s)<br />
k : Atemrate (m 3 /s)<br />
c : Konzentration (kg/m 3 )<br />
cs : Schwellkonzentration (kg/m 3 )<br />
ABS: Absolutbetrag<br />
Annahme: Unterhalb dieser Schwellkonzentration cs müssen die <strong>Effekte</strong> nicht weiter<br />
verfolgt werden (Grenzwert, oft der Wert der natürlichen Konzentration oder der<br />
Unbedenklichkeit).<br />
Manchmal wird, um die Kurven den einzelnen Gasen besser anpassen zu können, zu<br />
der Konzentration ein Exponent a als Probit-Funktion gesetzt. Dieser hat Werte von<br />
a=0.5 –3; Funktion D = konst. • c a • t.<br />
Umrechnung: ppm (ml/m 3 ) �� mg/m 3 (Temperatur: 20°C, Druck: 101'325 Pa)<br />
mg/<br />
m<br />
ppm =<br />
Molmasse(<br />
g/<br />
mol)<br />
=<br />
• ppm;<br />
24.<br />
06<br />
24.<br />
06<br />
3<br />
• mg/<br />
m ;<br />
Molmasse(<br />
g/<br />
mol)<br />
3<br />
Dosis<br />
0.05<br />
0.04<br />
0.03<br />
0.02<br />
0.01<br />
0<br />
0 5 10 15 20<br />
Schwellkonzentration<br />
Abbildung 60: Einfluss der Schwellkonzentration auf die wirksame Dosis<br />
Konzentration: c = 18 (mol/m 3 )<br />
Einwirkungszeit: t = 10 (s)<br />
Atemrate: k = 0.00028 (m 3 /s)<br />
Dosis: D (mol)<br />
Der obige Ansatz wird immer dann verwendet, wenn man feststellen kann, dass unterhalb<br />
einer bestimmten Konzentration die Expositionsdauer keinen Einfluss mehr hat.<br />
Die Schwellkonzentration entspricht dann einem „no adverse effect level“ (NOAEL)<br />
[früher: "no effect level" (NEL)] � Grenzwerte im Gesetz und in Verordnungen).<br />
Chemie Bützer
Atemrate (l/h)<br />
4000<br />
3000<br />
2000<br />
1000<br />
0<br />
73<br />
y = 23.81x<br />
0 50 100 150 200<br />
Sauerstoffverbrauch (l/h)<br />
Abbildung 61: Zusammenhang zwischen Atemrate (Aufnahme von Luft) und Sauerstoffverbrauch<br />
beim Menschen<br />
Die Grafik macht deutlich, dass zwischen der Atmungsintensität (Atemrate) und dem<br />
Stoffwechsel (Sauerstoffumsatz) in einem weiten Teil eine proportionale<br />
Abhängigkeit besteht.<br />
Einschränkungen des Modells<br />
In diesem Modell fehlen noch zwei wichtige Parameter:<br />
1. Der Resorptionskoeffizient, also der Faktor, der angibt, welcher Teil des<br />
eingeatmeten Wirkstoffs auch aufgenommen wird und<br />
2. Die Elimination des Wirkstoffs durch Ausscheidung und Metabolismus.<br />
Normalerweise wird nicht die ganze Dosis aufgenommen, die mit der Luft eingeatmet<br />
wird. Dieser Bruchteil kann mit dem Resorptionskoeffizienten ausgedrückt werden.<br />
Gleichzeitig mit der Aufnahme findet auch eine Elimination statt. Diese ist umso<br />
wichtiger, je rascher die Elimination im Vergleich zu Aufnahmezeit ist. Da der MAK-Wert<br />
auf 8 Stunden Exposition pro Tag gerechnet ist, ist während 16 Stunden pro Tag eine<br />
Elimination ohne Aufnahme möglich.<br />
Einfluss der Lipophilie:<br />
Mit zunehmender Lipophilie steigt im Allgemeinen auch die Toxizität, wie das einfache<br />
Beispiel der Alkohole zeigt:<br />
Tabelle 25: Toxizitäten einiger Alkohole<br />
Alkohol<br />
MAK (ppm)<br />
Methanol 200<br />
Ethanol 1000<br />
n-Propanol 200<br />
n-Butanol 50<br />
Methanol ist deshalb toxischer als Ethanol, weil die Metaboliten (Formaldehyd und<br />
Ameisensäure) toxischer sind als die von Ethanol.<br />
Chemie Bützer
6.2 Grenzwerte<br />
74<br />
Der Schutz der Menschen an ihrem Aufenthaltsort hat bei Schadgasen eine besondere<br />
Bedeutung, weil sich die Gase rasch ausbreiten und über die Atmung ohne weitere<br />
Beeinflussung aufgenommen werden. Der Aufwand, sich als Einzelperson aktiv gegen<br />
eine Aufnahme zu schützen ist gross. Das ist mit ein Grund, weshalb die Gesellschaft<br />
über Gesetze und Vorschriften Massnahmen ergreift.<br />
BAT, BGW: Biologischer Arbeitstoleranz, neu: Biologischer Grenzwert<br />
LOAEL: Lowest observed adverse effect level<br />
MOK: Maximale Organ Konzentration<br />
MAK, AGW, TLV: Maximale Arbeitsplatz Konzentration, neu: Arbeitsplatzgrenzwert,<br />
Threshold Limit Value entspricht unserem MAK<br />
MEK: Maximale Emmissions Konzentration (und Emmissionsdauer)<br />
MIK: Maximale Immissions Konzentration<br />
ADI: Acceptabel Daily Intake, meist: ADI = NOAEL/100<br />
NEL, NOAEL: No Effect Level (abhängig vom Fortschritt der Analytik! Daher neu: NOAEL: No<br />
Observed Adverse Effect Level)<br />
NOAEC: No Observed Adverse Effect Concentration<br />
Abbildung 62: Gasförmige Schadstoffe deren direkte und abgeleitete Grenzwerte<br />
Für den Schutz des Menschen vor giftigen, gasförmigen Stoffen wird dieser Ansatz<br />
verwendet. Man spricht dann von einer maximalen Arbeitsplatzkonzentration, MAK-<br />
Wert, von einer maximalen Emmissionskonzentration, MEK-Wert, oder einer maximalen<br />
Immissionskonzentration MIK. Diese Werte müssen nach unserem Ansatz sowohl eine<br />
Konzentration, wie auch die Aufenthaltsdauer berücksichtigen. MAK-Werte sind damit<br />
keine sicheren Grenzen zwischen gefährlichen und ungefährlichen Bereichen.<br />
Der MAK-Wert ist so ausgelegt, dass über längere Perioden bei der ganz stark<br />
überwiegenden Zahl der gesunden Personen die Gesundheit nicht geschädigt wird. Er<br />
ist auf eine Arbeitszeit von 8-9 Stunden pro Tag und bis zu 45 Stunden pro Woche<br />
ausgelegt. Seit 1. Januar 2005 besteht in Deutschland mit dem Inkrafttreten der neuen<br />
Gefahrstoffverordnung ein neues Grenzwert-Konzept. Dieses kennt nur noch<br />
gesundheitsbasierte Grenzwerte, den Arbeitsplatzgrenzwert – AGW und den<br />
Biologischen Grenzwert – BGW.<br />
Chemie Bützer
75<br />
Der MIK-Wert muss nun aber für Leute ausgelegt sein, die sich 24 Stunden pro Tag<br />
und 7 Tage pro Woche an einem Ort aufhalten, an welchem die Immission (Einwirkung<br />
der Substanz) auftritt. Der MIK-Wert muss dieser Aufenthaltsdauer Rechnung tragen.<br />
MIK = MAK x 40/168 ≈ MAK/4. Nun halten sich aber im Bereich der Immissionen von<br />
Verkehr, Heizungen und Industrie nicht nur gesunde Leute auf, weshalb noch ein<br />
Sicherheitsfaktor 5 eingesetzt wird. Damit wird für sehr viele Fälle:<br />
Faustregel: MIK ≈ MAK / 20<br />
Bei Kohlenmonoxid stimmt diese Umrechnung beispielsweise nicht genau. Der MAK-<br />
Wert ist 30 ppm (35 mg/m 3 ), der Halbstunden MIK-Wert ist 50 ppm, das Tagesmittel ist<br />
10 ppm (24-h-MIK-Wert), gleich wie der Jahresmittelwert (Jahres-MIK-Wert).<br />
Um die Dosis abzuschätzen ist es wichtig, dass die Elimination von CO im Stoffwechsel<br />
mitberücksichtigt wird. Dazu ist beispielsweise folgende Simulation geeignet, wobei bei<br />
der hyothetischen Dosis die Elimination nicht berücksichtigt ist:<br />
Abbildung 63: Simulationsdiagramm für die Dosis von CO (DYNASYS)<br />
Gleichung 1 : Gleichungen der Simulation<br />
Zustandsgleichungen<br />
Dosis.neu
Zwischenwerte<br />
Dosis (mg) berechnet mit MAK-Wert (35<br />
mg/m 3 ),<br />
Aufnahmedauer: 8 Std. (480 Min.)<br />
76<br />
Dosis (mg) berechnet mit MIK-Wert (12<br />
mg/m 3 ),<br />
Aufnahmedauer 24 Std. (1440 Min.)<br />
Abbildung 64: Vergleich der wirksamen Dosen von CO mit MAK- und MIK-Wert(Eliminations-HWZ:<br />
96 Min., Atemrate 0.00017 m 3 /Min., Resorptionsfaktor=1; Schwellkonzentration=0)<br />
Kurzzeitige Überschreitungen des MAK-Wertes und des MIK-Wertes sind gesetzlich<br />
zulässig. Die Kurzzeitwerte sind in der Regel 2 bis 5 mal höher als die MAK- resp. die<br />
MIK-Werte.<br />
Warum die Dosis und nicht nur die Konzentration als Entscheidungskriterium?<br />
An einem einfachen, täglichen Beispiel soll diese Frage beantwortet werden. Wie haben<br />
Ethanol oder Spiritus in unseren Haushalten für verschiedene Zwecke. Schon sehr viele<br />
Personen haben an einer offenen Flasche Ethanol gerochen, ohne dabei gefährdet zu<br />
werden. Warum?<br />
Einige wichtige Daten dieser Substanz sind die Folgenden:<br />
Ethanol (Ethylalkohol, Weingeist, „Alkohol“). H3C–CH2–OH, C2H6O,<br />
• M: 46,07 g/mol.<br />
• MAK 1000 ppm<br />
• Dampfdrucke in hPa: 6.7 (+8°C), 67 (25°C), 80 (26°C), 267 (48,4°C)<br />
Der Dampfdruck bei 25 °C ist 6700 Pa.<br />
Allg. Gasgleichung:<br />
p x V = n x R x T; p = n x R x T/V;<br />
Da ein Mol jedes Gases dasselbe Volumen einnimmt, kann der Dampfdruck nach der<br />
obigen Gleichung direkt in den Volumenanteil in ppm umgerechnet werden:<br />
VT = 67’000/1’000'000 = 67'000 ppm<br />
Die Umrechnung in mg/m 3 bei 20°C erfolgt wie:<br />
mg/m 3 = Molmasse/24,06 x ppm:<br />
g/m 3 = Molmasse/24060 x ppm<br />
Der MAK-Wert des Ethanoldampfs über der Flüssigkeit ist um das 67-fache<br />
überschritten.<br />
Folgerung: Es ist trotzdem nicht gefährlich, kurz an einer Spiritusflasche zu riechen.<br />
Chemie Bützer
77<br />
Der MAK-Wert ist ja für 8 Stunden Arbeit pro Tag festgelegt.<br />
Und wenn wir länger riechen? Ja dann ist entscheidend, wie intensiv wir riechen. Das<br />
ist von unserer Einatmung bestimmt, der Atemrate.<br />
Arbeit bei Einhaltung von 1 MAK<br />
während 480 Minuten.<br />
Die maximale Dosis D bei schwerer Arbeit an<br />
einem Arbeitstag mit 8 Stunden mit der MAK-<br />
Konzentration ist:<br />
D = c x Molmasse/24060 x Atemrate x Zeit;<br />
3<br />
c •M<br />
• Ar • t ⎛ ml • g • m • s • mol ⎞<br />
D = ⎜<br />
= g ⎟ ;<br />
3<br />
24060 ⎝ m • mol • s • ml ⎠<br />
D = 1000 x 46,07/24060 x 0,000’83 x 8 x 3600 =<br />
D = 45.8 g<br />
Riechen offene Spiritusflasche während 5<br />
Sekunden<br />
MAK wird um das 67-fache überschritten<br />
Die maximale Dosis D beim Riechen während 5<br />
Sekunden an einer Spiritusflasche mit derselben<br />
Atemrate (die volle Konzentration des<br />
verdunstenden Ethanols wird aufgenommen):<br />
D = 67’000 x 46,07/24060 x 0,000’83 x 5 =<br />
D = 0.53 g<br />
Obwohl der MAK-Wert im Falle der Spiritusflasche massiv überschritten wird, ist die<br />
erhaltene Dosis 45.8 g / 0.53 g um das 80-fache niedriger als bei der 8-Stunden Arbeit<br />
bei eingehaltenem 1 MAK.<br />
Aus dieser Aufstellung zeigt sich, dass eine sinnvolle Gefährdungsabschätzung nur mit<br />
der Berücksichtigung der Zeit unternommen werden kann.<br />
Für eine realistische Sicherheit müssen beide kritischen Grössen, maximale<br />
Konzentration und Dosis gleichzeitig begrenzt werden.<br />
Eine ganz wichtige Folgerung kann aus dem Beispiel gezogen werden:<br />
Beurteilung von toxischen Gasen<br />
Es ist unrealistisch, die Gefährdung durch toxische Gase nur über die Konzentration zu<br />
bestimmen. Atemrate und Aufnahmezeit müssen zusätzlich in eine korrekte Beurteilung<br />
einbezogen werden.<br />
Beim Ethanol wird auch klar, dass die Gefährdung mit der Temperatur zunimmt, da der<br />
Dampfdruck, die Konzentration in der Luft steigt und damit die aufgenommene Dosis<br />
steigt.<br />
Chemie Bützer
Dampfdruck (hPa)<br />
1200<br />
1000<br />
800<br />
600<br />
400<br />
200<br />
0<br />
78<br />
-60 -40 -20 0 20 40 60 80 100<br />
Temperatur (°C)<br />
Abbildung 65: Dampfdruck von Ethanol in Funktion der Temperatur<br />
Zwischen 8°C und 30 °C nimmt die Dampfkonzentration über der Flüssigkeit immerhin<br />
um einen Faktor 3 zu.<br />
6.3 Kohlenmonoxid<br />
Eigenschaften:<br />
Kohlenoxid (Kohlenmonoxid, Kohlenstoffmonoxid). CO, MG. 28,01. Farbloses,<br />
geruchloses, giftiges Gas, D. 1,250 g/l (0°), Schmp. –205,1°, Sdp. –191,5°, kritischer<br />
Druck 35 bar, kritische Dichte 0,311 g/cm 3 , kritische Temperatur –140,2°. CO ist etwas<br />
leichter als Luft (relative Dichte zu dieser 0,97). MAK-Wert 35 mg/m 3 , 30 ml/m 3 (ppm) 66<br />
Leichtentzündlich<br />
Giftig<br />
Natürlicherweise ist der Gehalt an CO in der Luft etwa 0.2 ppm (mit starken<br />
Fluktuationen)<br />
Tabelle 26: Hämoglobin-CO Anteil bei verschiedenen CO-Konzentrationen und unterschiedlichen<br />
Inhalationszeiten (Atemrate 400 l/h (ruhig))<br />
CO-Gehalt der Luft 100 ppm 50 ppm 25 ppm<br />
Zeit (Min) % Hb-CO Anteil<br />
0 0 0 0<br />
2 3,2 1,6 0,8<br />
4 5,6 2,8 1,4<br />
6 7,5 3,75 1,875<br />
10 10 5 2,5<br />
15 12 6 3<br />
20 13,2 6,6 3,3<br />
30 14,5 7,25 3,625<br />
66 Umrechnung des MAK-Wertes: Bei 20°C (293 K): p*V = m/M*R*T; V=m/(M*p)*R*T =<br />
0.035/(28.1*100'000)*8.314*293 = 30.3 ml entspricht 30.3 ppm<br />
Chemie Bützer
% Hb-CO im Blut<br />
16<br />
14<br />
12<br />
10<br />
8<br />
6<br />
4<br />
2<br />
0<br />
79<br />
0 10 20 30<br />
Zeit (Min)<br />
100 ppm<br />
50 ppm<br />
25 ppm<br />
Abbildung 66: Hb-CO-Gehalte im Blut in Funktion der Zeit bei verschiedenen CO-Konzentrationen<br />
in der Luft<br />
Bei mittlerer Arbeit ist die Atemrate 1600 l/h, d.h. für dieselbe Dosis muss die Zeit um<br />
einen Faktor 4 verringert werden.<br />
Auswertung: Linewaver-Burk-Plot (1/t und 1/v aufgetragen)<br />
1/(% Hb-CO im Blut)<br />
1.4<br />
1.2<br />
y = 12,0993x<br />
+ 0,1944<br />
0.8<br />
0.6<br />
0.4<br />
0.2<br />
0<br />
y = 1,0497x + 0,0972<br />
y = 0,5248x + 0,0486<br />
-0.2 -0.2 0 0.2 0.4 0.6<br />
1/t (1/Min)<br />
100 ppm<br />
50 ppm<br />
25 ppm<br />
Abbildung 67: Linewaver-Burk-Plot von Hb-CO mit unterschiedlichen CO-Konzentrationen<br />
y=0 (Abszissenabschnitt) -1/Kd � Kd = 0,0926 (gilt für alle 3 Konzentrationen).<br />
x=0 (Ordinatenabschnitt) 1/Em �<br />
Em(100 ppm)= 20,6; Em(50 ppm)=10,3; Em(25 ppm)= 5,15 (maximaler Hb-CO-Gehalt<br />
im Blut in % bei den entsprechenden Konzentrationen).<br />
Tabelle 27: Wirkung grosser Konzentrationen von CO<br />
Chemie Bützer<br />
CO ppm Hb-CO %<br />
60 10<br />
130 20<br />
200 30<br />
660 50<br />
750 60
HbCO-Gehlat im Blut (%)<br />
70<br />
60<br />
50<br />
40<br />
30<br />
20<br />
10<br />
0<br />
80<br />
0 200 400 600 800<br />
CO Konzentration in der Luft (ppm)<br />
Abbildung 68: HbCO-Gehalt bei hohen CO Konzentrationen<br />
Aufgabe: Giftigkeit von Kohlenmonoxid<br />
Der MAK-Wert von CO beträgt 30 ppm, 35 mg/m 3<br />
a) Stimmen die beiden Werte des MAK-Werts bei 20 °C und 100 kPa überein?<br />
b) Stellen Sie die Tabelle grafisch dar, und interpretieren Sie die Kurven.<br />
a) 30 ppm = 30 ml/m 3 , p x V = n x R x T; n=m/M, p x V = m/M x R x T; m=Vx p x<br />
M/(R x T)= 30 x 10 -6 x 10 5 x 28/(8,314 x 293) = 56 x 10 -6 kg = 35 mg<br />
Tabelle 28: Toxische Wirkung von Kohlenmonoxid<br />
Wirkung Konzentration<br />
in ppm<br />
Einwirkungszeit in Stunden<br />
(Inhalationszeit)<br />
arbeitend gehend ruhend<br />
Kopfschmerzen, 1400 0.5 0.75 1.5<br />
Übelkeit 600 1 1.5 3<br />
300 2 3 6<br />
200 3 4.5 9<br />
tödlich 1600 1 1.5 3<br />
800 2 3 6<br />
500 3 4.5 9<br />
Chemie Bützer
Inhalationsdauer (Std)<br />
10<br />
9<br />
8<br />
7<br />
6<br />
5<br />
4<br />
3<br />
2<br />
1<br />
0<br />
81<br />
oben: tödlich,<br />
unten: Übelkeit<br />
0 500 1000 1500 2000<br />
Konzentration (ppm)<br />
arbeitend<br />
gehend<br />
ruhend<br />
Abbildung 69: Wirkung von Kohlenmonoxid in Funktion von Konzentration (ppm) und<br />
Inhalationsdauer (Std.)<br />
Wenn man diese Angaben in der obigen Gleichung verwenden will, dann muss die<br />
Atemrate, das heisst die pro Minute eingeatmete Luft, in der Konstanten ein- gesetzt<br />
werden. Genau in dieser Grösse unterscheiden sich nämlich die drei betrachteten Fälle:<br />
Arbeitend, stehend und ruhend. Für cs müsste dann der MAK- Wert, oder der MIK-Wert<br />
verwendet werden.<br />
Tabelle 29: Wirkungen auf den Menschen von CO in der Atemluft 67<br />
Konzentration Zeit Wirkungen<br />
(ppm) (h)<br />
10 24 MIK<br />
25 8 TLV (threshold limit value entspr. unserem MAK)<br />
30 8 MAK<br />
100 nach längerer Zeit keine Vergiftungserscheinungen<br />
200 2 Kopfschmerzen<br />
300 2 Vergiftungssymptome<br />
400 1 Vergiftungssymptome<br />
500 0.5 Halluzinationen<br />
1000 2 Tod<br />
1500 1 Tod<br />
3000 0.5 Tod<br />
Molekulare Wirkungsweise von CO<br />
Bildung von Carboxyhämoglobin: HbO2 + CO � HbCO + O2<br />
[ HbCO][<br />
O2]<br />
K =<br />
≈ 300(<br />
220 −<br />
[ HbO2][<br />
CO]<br />
400)<br />
67 Roth L., Weller U., Chemie-Brände und Vorsorgemassnahmen, ecomed-Verlag, Landsberg/Lech,<br />
1990, 30 (nach Daunderer)<br />
Chemie Bützer
82<br />
Frage: Wenn die Carboxyhämoglobinkonzentration im Blut maximal 10% sein darf, wie<br />
gross ist dann die CO-Konzentration in ppm?<br />
[ HbCO][<br />
O2]<br />
[ CO]<br />
=<br />
[ HbO ] • K<br />
2<br />
[O2]: Gehalt an Sauerstoff in der Luft: 21% = 210'000 ppm<br />
[ HbCO]<br />
10<br />
= = 0,<br />
11<br />
[ HbO ] 90<br />
[ CO]<br />
2<br />
[ HbCO][<br />
O ] 21000<br />
=<br />
= 0,<br />
11•<br />
[ HbO ] • K 300<br />
2<br />
2 =<br />
77.<br />
7 _ ppm<br />
Die HbCO-Konzentration im Blut beträgt beim MAK-Wert<br />
[ HbCO]<br />
[ CO]<br />
• K 30 * 300<br />
= = = 4.<br />
3%<br />
[ HbO2]<br />
[ O2]<br />
210000<br />
(BAT-Wert, Biologischer Arbeitstoleranz Wert: 5 % 68)<br />
Bei der Bindung des CO an das Hämoglobin handelt sich um ein Gleichgewicht, das<br />
ausgenützt wird, um den HbCO-Gehalt nach einer Vergiftung möglichst rasch wieder zu<br />
verringern.<br />
% Hb-CO<br />
70<br />
60<br />
50<br />
40<br />
30<br />
20<br />
10<br />
0 20 40 60<br />
Zeit (Min)<br />
Luft<br />
Sauerstoff<br />
Abbildung 70: CO Entfernung im Blut durch Atmung mit normaler Luft nach einer CO<br />
Vergiftung69 Eine chronische Kohlenmonoxid-Belastung im eigentlichen Sinne ist bisher nicht mit<br />
wesentlichen Auswirkungen wahrscheinlich gemacht worden. Psychovegetative<br />
Störungen werden als Folge häufig wiederholter, abortiver bzw. subakuter Intoxikation<br />
diskutiert. Es ist zu berücksichtigen, dass der COHb-Gehalt bei Rauchern bis zu 25 %<br />
betragen kann (durchschnittlich 10 %), der normale COHb-Gehalt beim Menschen ist<br />
ca. 1 %.<br />
68 Bender H.F., Sicherer Umgang mit Gefahrstoffen, Wiley-VCH Verlag GmbH, Weinheim, 2000, 99<br />
69 Moeschlin S., Klinik und Therapie der Vergiftungen, Georg Thieme Verlag, Stuttgart, 1980, 246<br />
Chemie Bützer
Beispiel: Autoabgase<br />
Chemie Bützer<br />
83<br />
Tabelle 30: Zusammensetzung von Kraftfahrzeugabgasen in Vol.-%<br />
Schadgas Ottomotor Dieselmotor<br />
CO2 6,5 – 8 3,5<br />
7 – 13 9<br />
H2O 7 – 10 3,5<br />
9 – 11 9<br />
O2 1 – 1,5 16<br />
0,1 – 2 3 – 6<br />
CO 4 – 8 unter 0,05<br />
1 – 8 0,1 – 0,3<br />
H2 0,5 – 4 –<br />
0,1 – 1 0,1<br />
N2 71 77<br />
74 – 76 77<br />
NOx 0.6 3<br />
kursive Werte für Volllast, normale Werte für Leerlauf<br />
Abgasausstoss (mit CO2 und H2O) ca. 10 m 3 pro Liter Benzin.<br />
Gefahr in der Garage?<br />
Ein Auto mit Benzinmotor wird in einer Garage (6 x 4 x 3 m) laufen gelassen und<br />
verbrennt dabei pro Stunde 5 Liter Benzin. Nach welcher Zeit ist der MAK-Wert von CO<br />
in der Garage erreicht?<br />
Lösung:<br />
Garage: V= 6 x 4 x 3 = 72 m 3 ;<br />
CO Konzentration ca. 8% entspricht 80’000 ppm = 80’000 cm 3 /m 3 ; In der Garage ist der<br />
MAK-Wert mit 72 x 30 = 2160 cm 3 CO erreicht (gleichmässige Durchmischung<br />
angenommen).<br />
Pro Liter Benzin produziert das Auto 10m 3 Abgas, davon sind 80’000 x 10 = 800’000<br />
cm 3 CO;<br />
Pro Stunde braucht das Auto 5 Liter Benzin, produziert also 5 x 800’000 = 4'000’000<br />
cm 3 CO; das sind pro Sekunde 4'000’000/3600 = 1111 cm 3<br />
Folgerung: Der MAK-Wert (30 ppm) ist bei vollständiger Durchmischung in ca. 2<br />
Sekunden erreicht!!! (72 x 30/1111= 1.94 s), bei 4% CO sind das ca. 4 Sekunden.<br />
Tabelle 31: Schadstoffkonzentrationen im Innern eines Kraftfahrzeugs<br />
Substanz mg/m 3<br />
ppm MAK<br />
ppm<br />
Kohlenmonoxid, CO 12 – 43 (Mittelwert: 25) 10.3 - 36.9 30<br />
Stickstoffmonoxid, NO 0,65 – 1,6 (Mittelwert: 1,1 ) 0.78 - 1.92 25<br />
Stickstoffdioxid, NO2 0,03 – 0,3 (Mittelwert: 0,1 ) 0.06 - 0.6 3<br />
Ist der MAK-Wert für die Summe dieser Schadstoffe, CO, NO und NO2 überschritten?
6.4 Beurteilung von Stoffgemischen 70<br />
c x<br />
Stoffindex für Stoff x: I = ;<br />
x<br />
MAK x<br />
Substanz cx<br />
ppm<br />
84<br />
MAKx<br />
ppm<br />
Stoffindex<br />
Ix<br />
ppm<br />
Kohlenmonoxid, CO 24 30 0.8<br />
Stickstoffmonoxid, NO 1.4 25 0.056<br />
Stickstoffdioxid, NO2 0.3 3 0.1<br />
Gemisch 0.956<br />
n<br />
c1<br />
c 2 c3<br />
c ⎡ ⎤<br />
n ci<br />
Gemisch: I tot = + + + ... + = ∑ ⎢ ⎥ ≤ 1<br />
MAK1<br />
MAK2<br />
MAK3<br />
MAKn<br />
i= 1 ⎣MAKi<br />
⎦<br />
Interpretation des Beispiels: Da Itot = 0.956
85<br />
Abbildung 72: Zeitdiagramm der Aufnahme von Kohlenmonoxid (Abszisse: Zeit in Minuten,<br />
Ordinate: Dosis in mg) (Konzentration von CO: 350 mg/m 3 , Schwellkonzentration: 0.24 mg/m 3 ,<br />
max. Aufenthaltsdauer 2Std. � Vergiftungssymptome, Atemrate: 0.017 m 3 /min, Resorptionsfaktor:<br />
1, Halbwertszeit der Elimination (Luft)): 96 Min. � k=ln(2)/96) Dosis in mg: Berücksichtigt die<br />
Elimination, Hyp_Dosis: Berücksichtigt die Elimination nicht.<br />
Die Grafik macht deutlich, dass die Elimination die Zunahme der Dosis im Blut<br />
verringert und gleichzeitig zu einer Begrenzung der maximalen Dosis führt<br />
(Gleichgewicht). Nach der Exposition tritt eine Abnahme der Dosis durch die Elimination<br />
ein.<br />
Kinetik und toxische Wirkung<br />
CO2 und CO durchdringen nach Inhalation rasch und leicht die Alveolarmembranen in<br />
der Lunge und gelangen in das Blut. Dort wird CO2 durch die Carboanhydrase der<br />
Erythrocyten in Kohlensäure umgewandelt. Wird somit CO2 über einen längeren<br />
Zeitraum in hohen Konzentrationen eingeatmet, dann bildet sich eine im Extremfall<br />
tödliche respiratorische Azidose. CO lagert sich dagegen unter Verdrängung von<br />
Sauerstoff an das zweiwertige Eisen des Hämoglobins an. Dabei belegt CO die<br />
gleichen Koordinationsstellen von Fe 2+ wie Sauerstoff, die Affinität von CO zu<br />
Hämoglobin ist jedoch etwa 300fach grösser als die von Sauerstoff. Bei erreichen eines<br />
Hämoglobin-CO Anteiles von 60% tritt innerhalb weniger Minuten der Tod ein.<br />
Das ausgeatmete Kohlendioxid, ein natürliches Gas, hat in höheren Konzentrationen<br />
negative Wirkungen:<br />
Chemie Bützer
CO2-Gehalt in %<br />
7<br />
6<br />
5<br />
4<br />
3<br />
2<br />
1<br />
0<br />
Normal<br />
0,035<br />
MAK<br />
0,5<br />
86<br />
Fehlleistungen<br />
1,5<br />
Kopfschmerzen<br />
3<br />
Schwindel<br />
Abbildung 73: Kohlendioxidgehalte der Atemluft und deren Auswirkungen (MAK 0.5% entspr.<br />
1'000’000/100*0.5 = 5000 ppm)<br />
6.5 Schwefelwasserstoff<br />
Ebenfalls ein natürliches Gas der Verdauung und der Vulkane ist Schwefelwasserstoff<br />
(H2S). Von Schwefelwasserstoff (z.T. auch ein Bestandteil der Stoffe von Heilquellen)<br />
kennt man folgende Angaben:<br />
Tabelle 32: Toxische Wirkung von H2S<br />
Wirkung Konzentration in<br />
mg/l Luft<br />
Geruchsschwelle 0.000’005’7<br />
MIK-Wert 0.00075<br />
MAK-Wert 0.015<br />
Leichte oder keine Wirkung 0.5-0.7<br />
Leichte Symptome nach einigen Stunden 1 - 2<br />
Symptome nach 1/2 Std. 1.5-1.6<br />
Schwere Symptome nach 1/2 Std. 3 - 4<br />
Lebensgefährlich nach 1/2 Std. 10 - 12<br />
Tödlich nach 1/2 Std. >15<br />
Dampfdichteverhältnis (Luft = 1) 1.19<br />
Dampfdruck bei 20°C (hPa) 17’300<br />
Obere Explosionsgrenze (Vol%) 44<br />
Untere Explosionsgrenze (Vol%) 4<br />
Wie lässt sich die Gefährdung mit diesen Werten sinnvoll abschätzen?<br />
Chemie Bützer<br />
6
Dosis in mg<br />
1000<br />
800<br />
600<br />
400<br />
200<br />
0<br />
87<br />
Tödlich in 30 Min.<br />
0 5 10 15 20<br />
Konzentration in der Luft in mg/l<br />
Lebensgefährlich in 30 Min<br />
Schwere Symptome nach 30 Min.<br />
Abbildung 74: Dosis von Schwefelwasserstoff (H2S) bei verschiedenen Konzentrationen in der<br />
Atemluft<br />
Interpretation:<br />
• H2S ist schwerer als Luft – tiefer liegende Bereiche sind besonders gefährdet.<br />
• Als Wert für cs wird der MIK- Wert von 0.00075 mg/l Luft angenommen.<br />
• Es fällt in der Tabelle auf, dass der Wert für leichte Symptome und der Wert für<br />
Symptome nach 1/2 Std. praktisch gleich sind.<br />
• Zwischen dem MAK- Wert und der tödlichen Konzentration ist ein Faktor 1000.<br />
• Die Wirkungsweise von Schwefelwasserstoff (H2S) lässt sich zu einem guten Teil<br />
durch die starke Bindung an Schwermetalle erklären (Bildung unlöslicher<br />
Sulfide).<br />
• Von H2S können etwa 2000 fach geringere Konzentrationen mit der Nase<br />
wahrgenommen werden, als dem MAK-Wert entspricht (die Nase ist ein<br />
Warnorgan für diese Substanz, jedoch nur für kurze Zeit, da die Adaption sehr<br />
rasch ist).<br />
• Explosive Konzentrationen von Schwefelwasserstoff (UEG = 40'000 ppm) sind<br />
vom Geruch her fast unerträglich und ausserordentlich toxisch.<br />
Tabelle 33: MAK- und MIK-Werte einiger Substanzen 71<br />
Substanz MAK-Wert<br />
mg/m 3<br />
MIK-Wert<br />
Tagesmittelwert<br />
mg/m 3<br />
MIK-Wert<br />
Höchstwert<br />
mg/m 3<br />
Amminiak, NH3 35 1 2<br />
Kohlenmonoxid, CO 33 10 50<br />
Methylenchlorid; CH2Cl2 360 50 150<br />
Schwefeldioxid, SO2 5 0.3 1<br />
Schwefelsäure, H2SO4 1 0.1 0.2<br />
Stickstoffdioxid, NO2 9 0.1 0.2<br />
Stickstoffmonoxid, NO 30 0.5 1<br />
Bei Reizgasen (z.B. HCl, SO2, NH3, O3, Phosgen, NOx etc.) ist oftmals erst nach<br />
Stunden (Latenzzeit) ein Lungenödem zu beobachten.<br />
71 Bender H.F., Sicherer Umgang mit Gefahrstoffen, Wiley-VCH Verlag GmbH, Weinheim, 2000, 101<br />
Chemie Bützer
88<br />
6.6 Die krebserzeugende Substanz Benzol<br />
C6H6<br />
Summenformel Konstitutionsformel Elektronendichteverteilung<br />
Benzol zeigt bei der Aufnahme ein ungewöhnliches Verhalten.<br />
Konz. im Blut/Harn<br />
300<br />
250<br />
200<br />
150<br />
100<br />
50<br />
0<br />
y = 5.121e 0.3969x<br />
R 2 = 0.9558<br />
0 5 10 15<br />
Konzentration in der Luft (ppm)<br />
Blut (MikroG/L)<br />
Harn (mg/L)<br />
Abbildung 75: Aufnahme aus der Luft in das Blut und Ausscheidung von Benzol 72<br />
Die Grafik zeigt, dass Benzol überproportional zur Luftkonzentration aufgenommen<br />
wird. Der TRK-Wert 1 ppm. Die Technische Richtkonzentration gilt für cancerogene<br />
Stoffe anstelle des MAK-Wertes. Eine Erklärung dafür könnte sein, dass der hydrophile<br />
Schleim auf der Lunge das Benzol umso besser absorbiert, je höher dessen Gealt an<br />
Benzol ist.<br />
Trotz der gesicherten Erkenntnisse über die carcinogene Wirkung, war Benzol als<br />
Zusatz in einer Konzentration von 5% zu Autobenzin mit einer Ausnahmeregelung<br />
während vieler Jahre zugelassen!!<br />
72 Bender H.F., Sicherer Umgang mit Gefahrstoffen, Wiley-VCH Verlag GmbH, Weinheim, 2000, 100<br />
Chemie Bützer
89<br />
6.7 Konzentrationsberechnungen in der Umweltchemie<br />
Viele Konzentrationsangaben der Umweltchemie verwirren wegen ihrer Redundanz. So<br />
werden Massen- und Volumenangaben verwendet, die dazu noch auf<br />
unterschiedlichste Einheiten der belasteten Medien normiert werden. Die Verwirrung<br />
spiegelt sich auch in Zeitungsberichten zu Umweltfragen wieder. So schreibt<br />
beispielsweise der Spiegel (20/1999) über den Schwefelgehalt von Treibstoffen: "...<br />
Gleichzeitig sollen die Schwefelgehalt-Grenzwerte für Benzin von derzeit 300 Teilchen<br />
pro Million (ppm) und für Diesel von 500 ppm drastisch sinken - auf einheitlich 10 ppm.<br />
..." Dies ist eine weitere Variante von ppm (wenn auch in diesem Fall sicherlich<br />
Massenanteile gemeint sind, da es sich nicht um Gase, sondern um Flüssigkeiten<br />
handelt).<br />
Ein typisches Beispiel sind die Konzentrationsangaben für Ozon, die man in dem MAK-<br />
Wert, den täglichen Ozonmeldungen oder in den Ozonkarten findet. (Alle diese<br />
Angaben sind für Chemiker nicht logisch. Für ihn zählen nur Konzentrationsangaben<br />
wie Mol pro Liter (mol/l) also Grössen, die proportional zur Teilchenzahl des Schadstoffs<br />
sind.)<br />
6.7.1 Problemstellung Ozon, O3<br />
"Alle sprechen vom Ozonloch, aber nur die Wenigsten wissen was Ozon ist und<br />
welche konkreten Reaktionen diese Substanz auslöst."<br />
Der Geruch des Ozons (Name von griech.: ózein = duften, stinken, riechen) wird je<br />
nach Konzentration als Nelken-, Heu-, Chlor-ähnlich oder als nach Stickoxiden riechend<br />
beschrieben und ist etwa ab 0,01 ppm wahrnehmbar. Ozon ist eines der stärksten<br />
bekannten Oxidationsmittel.<br />
+ +<br />
O<br />
O<br />
O O - - O<br />
O<br />
O<br />
+<br />
O O<br />
- -<br />
Resonanzstrukturen von Ozon<br />
Mögliche elektronische Grenzstrukturen des Moleküle<br />
Abbildung 76: Das sehr reaktive Molekül Ozon<br />
O<br />
O<br />
+<br />
O<br />
HOMO von Ozon<br />
Hier kommen die<br />
Elektronen der<br />
angegriffenen DB<br />
hinein<br />
Ozon wirkt auf Augen und Schleimhäute reizend, doch werden die Hauptschädigungen<br />
in den Atemwegen verursacht, wobei Atembeschwerden mit Abnahme des<br />
Respirationsvolumens, später auch Nasenbluten, Bronchitis, Lungenödeme auftreten<br />
können. Chronische Exposition (z. B. bei Flugpersonal) kann auch bei niedrigen O3-<br />
Konzentrationen Brust- und Kopfschmerzen sowie Schwindel zur Folge haben. Die<br />
Toxizität wird zum Teil auf die oxidative Zersetzung ungesättigter Fettsäuren im<br />
Organismus zurückgeführt. Dieser Effekt kann durch Vitamin E-Mangel potenziert,<br />
durch -Zufuhr jedoch gemildert werden. Die schädigende Wirkung von O3 auf Niedere<br />
Organismen wie Viren, Bakterien und Pilze wird für Desinfektions-Zwecke ausgenützt.<br />
Bei Pflanzen, wo sie als Folge der Luftverunreinigung auftreten kann, ist sie<br />
Chemie Bützer
unerwünscht, da direkte Einwirkung des Ozons Chlorophylle zerstört – ebenfalls eine<br />
Reaktion mit Doppelbindungen:<br />
R 1<br />
R 1<br />
R 3<br />
R 1<br />
R 3<br />
R 2<br />
O<br />
R 2<br />
R 4<br />
O O<br />
Ozonid<br />
O O<br />
R 3<br />
R 4<br />
Säure<br />
Katalysator<br />
R 2<br />
R 4<br />
O<br />
-O O+<br />
Ozon<br />
Abbildung 77: Reaktion der Ozonisierung<br />
90<br />
1,3-Dipolare<br />
Cycloaddition<br />
O<br />
R1 R3 R 1<br />
R 3<br />
O<br />
O<br />
-O<br />
+O<br />
O<br />
R2 R4 R 2<br />
R 4<br />
Primärozonid<br />
Der MAK-Wert von Ozon (O3) wird wie folgt angegeben:<br />
0,1 ml (100 µl)/m 3 Luft � 0,2 mg (200 µg)/m 3 Luft � 0,1 ppm (100 ppb) � 1 Teilchen<br />
Ozon auf 10 Mio. Teilchen Luft<br />
Diese Werte sehen sehr zufällig aus. Ob sie alle das Gleiche aussagen, soll anhand<br />
von Überschlagsrechnungen überprüft werden.<br />
3<br />
Berechnung: Molzahl n des Ozons in 1 m Luft.<br />
Die Molmasse des Ozons ist 48 g/mol.<br />
Nun rechnen wir nach, ob deren Volumen tatsächlich 100 µl ist.<br />
1 mol � 22,414 l (Satz von Avogadro)<br />
Bei 20 °C ist das Volumen 10,7 % (Faktor f = T2/T1) grösser: 1 mol => 24,056 l; 1 µmol<br />
=> 24,056 µl<br />
4,17 µmol Ozon => 100,3 µl ≈ 100 µl<br />
Überprüfung des ppb- bzw. ppm-Wertes die Anteile des Ozons in der Luft. Die Frage ist<br />
zu klären, worauf diese Werte normiert wurden: auf Masse oder Volumen der Luft.<br />
Chemie Bützer
1. Massenanteile<br />
1 m 3 Luft => 1,29 kg => 1,29 · 10 9 µg<br />
200 9<br />
9<br />
1.<br />
29 •10<br />
−<br />
= 155 •10<br />
= 155ppb<br />
= 0.<br />
155ppm(<br />
Masse)<br />
Dieser Wert stimmt nicht mit der Angabe<br />
bei den MAK-Werten überein.<br />
91<br />
2. Volumenanteile<br />
1 m 3 Luft = 10 9 µl<br />
100 9<br />
μl −<br />
= 100 •10<br />
= 100ppb<br />
9<br />
10 μl<br />
= 0.<br />
1ppm(<br />
Volumen)<br />
Dieser Wert stimmt mit der Angabe<br />
überein.<br />
Auf Teilchenzahlen bezogene Anteile<br />
Die ppm-Definition ist im Fall von Gasen identisch mit der auf Volumen bezogenen<br />
Angabe. Dahinter steckt der Satz von Avogadro, dass gleiche Volumina von<br />
verschiedenen Gasen die gleiche Teilchenzahl enthalten. Volumenzahlen sind bei<br />
Gasen deshalb proportional zu Teilchenzahlen. Sie sind bis zu ziemlich extremen<br />
Bedingungen unabhängig von Druck und Temperatur, da diese Korrekturen alle Gase<br />
gleichmässig betreffen (abgesehen von Realgas-Korrekturen).<br />
Der Teilchenanteil ist also<br />
1 Ozonteilchen auf 10 Mio. Luftteilchen = 0,1 ppm (auf Teilchenzahl bezogen).<br />
Diesen ppm-Wert kann man auch über die Molzahl berechnen.<br />
Überschlagsrechnung:<br />
Ein Kubikmeter trockene Luft hat bei Normalbedingungen die Masse 1,29 kg. Die<br />
Molzahl der Luft berechnet man mithilfe der durchschnittlichen Luftmolmasse ML.<br />
Nur Stickstoff, Sauerstoff und Argon werden berücksichtigt:<br />
ML = 0,781 · 28,02 g/mol + 0,21 · 32 g/mol + 0,0093 · 39,95 g/mol = 21,88 + 6,72 + 0,37<br />
= 28,97 g/mol<br />
Die Molzahl n der Luft in 1,29 kg ist dann<br />
n (Luft) = 1290 g / 28,97 g/mol = 44,53 mol<br />
Wir vergleichen die Teilchenzahlen von Ozon und Luft:<br />
n( Ozon)<br />
4.<br />
17μmol<br />
−6<br />
= = 0.<br />
093 •10<br />
≈<br />
n(<br />
Luft)<br />
44.<br />
53mol<br />
0.<br />
1ppm(<br />
auf _ Teilchen _ bezogen)<br />
Die verschiedenen Angaben des MAK-Werts sind also in sich stimmig.<br />
6.8 Dioxin und ADI-Wert<br />
Beispiel: Maximale Konzentration von Dioxin im Körper<br />
Der ADI-Wert (Acceptable Daily Intake = annehmbare (duldbare) tägliche Aufnahme<br />
admissible daily intake) für den Menschen liegt bei 1 pg TE/kg LG. (TE:<br />
Toxizitätseinheiten, da ein Substanzgemisch; LG: Lebendgewicht).<br />
Gleichzeitig werden die Dioxine aber ausgeschieden; die Halbwertszeit t½ beträgt<br />
hierfür 5 Jahre. Daraus ergibt sich ein Gleichgewicht mit einer Sättigungskonzentration.<br />
Wie gross ist diese?<br />
Reaktionsgeschwindigkeitskonstante: t½ = ln(2)/k � k = ln(2)/ t½<br />
Chemie Bützer
Allgemeiner Ansatz:<br />
Reaktionsgeschwindigkeit v = Aufnahme - Ausscheidung von Dioxinen<br />
v = k1 – k2 · c<br />
92<br />
Der Sättigungswert wird im Gleichgewichtszustand erreicht.<br />
Hier ist RG = 0, c= csätt. Daraus folgt:<br />
k1<br />
c sätt =<br />
k<br />
2<br />
Für den konkreten Fall von Dioxin gilt:<br />
k1 = ADI-Wert · 365 Dimension: pg TE/kg LG und Jahr; (k1 = 365)<br />
k2 = ln(2)/t½ Dimension: Jahr -1 ; ln(2) = 0,693; (k2 = 0.1386)<br />
Die Sättigungskonzentration ist mit diesen Werten:<br />
ADI•<br />
365 • t1/<br />
2<br />
csätt<br />
= ; pg TE/kg LG<br />
ln( 2)<br />
Die Beziehung gestattet, rasch zu überschlagen, was es bedeutet, wenn der ADI erhöht<br />
wird und/oder die Halbwertszeit doch grösser ist als vermutet.<br />
Unter den Bedingungen (Aufnahme: ADI = 1 pg/Tag und kg LG und Ausscheidung: t½ =<br />
5 Jahre) findet man den bekannten Literaturwert von 3 000 pg TE/kg LG:<br />
csätt = 2 633 pg TE/kg LG<br />
Diskutiert wird z.B. die Erhöhung des ADI auf 10 pg/Tag und kg LG. Kalkuliert man<br />
konservativer eine grössere Halbwertszeit von 10 Jahren mit ein, so erhält man<br />
csätt = 52 670 pg TE/kg LG.<br />
Simulationsdiagramm des<br />
Dioxinmetabolismus<br />
Abbildung 78: Dioxinmetabolismus<br />
Zeitdiagramm des Dioxinmetabolismus:<br />
Dioxinaufnahme (ADI= 1 pg/kg pro Tag) und der<br />
Ausscheidung (HWZ = 5 Jahre)<br />
Abszisse: Zeit in Jahren<br />
Ordinate: Dosis in pg<br />
Diese Grafik macht deutlich wie lange es dauert, bis das Gleichgewicht erreicht ist. Sie<br />
zeigt auf, dass es nicht viel Sinn macht über Gleichgewichte zu sprechen, ohne die<br />
Reaktionsgeschwindigkeiten zu betrachten.<br />
Chemie Bützer
Abbildung 79: Dioxinmetabolismus mit ADI=10 pg, Abbau HWZ = 10 Jahre (Abszisse: Zeit in<br />
Jahren, Ordinate: Dosis in pg)<br />
Diese Grafik zeigt, dass das Gleichgewicht auch bei hohen Dosen relativ langsam<br />
erreicht wird.<br />
Chemie Bützer<br />
93
7 Carcinogene Wirkungen<br />
Spezielle toxische Eigenschaften sind:<br />
c: carcinogen, kanzerogen � krebserzeugend<br />
m: mutagen � erbgutverändernd<br />
r: reproduktionstoxisch, teratogen � fortpflanzungsgefährdend<br />
Chemie Bützer<br />
94<br />
Diese drei Gefährdungen werden für die Beurteilung von Chemikalien zu der Kategorie<br />
CMR (carcinogen, mutagen, reproduktionstoxisch) zusammengefasst.<br />
Eine Reihe von Faktoren kann zur Carcinogenese (Krebsbildung) beitragen. Zu diesen<br />
Faktoren zählen Vererbung, Viren, ionisierende Strahlung, Chemikalien und<br />
Beeinträchtigungen des Immunsystems. Heute wird erforscht, wie diese Faktoren<br />
möglicherweise in bestimmten Abfolgen zusammenspielen und schliesslich zu Krebs<br />
führen. Grundsätzlich handelt es sich bei der Carcinogenese um einen genetischen<br />
Vorgang. Genabnormitäten können vererbt oder durch Viren oder äussere<br />
Schädigungen in einer Körperzelle verursacht werden. Wahrscheinlich entsteht nach<br />
einer Reihe aufeinander folgender Genmutationen eine einzelne bösartige Zelle, die<br />
sich als Clon vermehrt. Ursprünglich nahm man an, dass ein bösartiger Clon völlig<br />
abnorm ist und die einzige Möglichkeit, Krebserkrankungen zu heilen, daher in der<br />
vollständigen Beseitigung aller abnormen Zellen besteht. Heute weist vieles darauf hin,<br />
dass das Problem in der Unfähigkeit der Zelle liegt, sich bis zum endgültigen,<br />
funktionsfähigen Reifestadium weiterzuentwickeln und zu differenzieren<br />
(möglicherweise weil eine dazu nötige Komponente nicht produziert werden kann).<br />
Erst seit 1960 macht man sich ernsthafte Gedanken über die Wirkung von Schimmel<br />
befallenen Lebensmitteln. Zu dieser Zeit waren in England - kurz vor Weihnachten - von<br />
Geflügel, einige tausend Tiere durch verschimmeltes Erdnussschrot eingegangen. Die<br />
intensive Suche nach dem eigentlichen Verursacher führte zunächst zur Entdeckung<br />
der Aflatoxine, einem hochtoxischen Stoffwechselprodukt einiger Arten von Arpegillus<br />
flavus. Akute Vergiftungen mit Aflatoxin sind beim Menschen kaum bekannt. In<br />
tropischen Ländern, mit günstigen klimatischen Bedingungen für Pilzwachstum, sind<br />
chronische Vergiftungen vermutet worden. Eine gleichzeitige Häufung von primärem<br />
Leberkrebs und einem hohen Aflatoxingehalt der Nahrungsmittel ist in Mozambique ein<br />
solcher Zusammenhang gefunden worden. Im Gegensatz zu den akuten Wirkungen,<br />
treten diese Schäden erst verzögert auf. Bei den Aflatoxinen lässt sich zeigen, dass<br />
nicht alles, was naturbelassen ist ("Bioprodukte") auch besonders gesund sein muss.<br />
So sind die höchsten Gehalte an Aflatoxinen auf unpräparierten Nüssen zu finden, weil<br />
dort die Schimmelpilze besonders gut wachsen.<br />
Vorgänge, durch die chemische Substanzen Krebs verursachen, wurden eingehend<br />
untersucht. Einige Chemikalien aber auch „natürliche Stoffe“ wie Buchen- oder<br />
Eichenolzstaub oder Asbest wirken carcinogen. Dabei ist eine einmalige Einwirkung<br />
ausreichend, doch die Krebserkrankung tritt erst nach einer langen Latenzzeit zu Tage,<br />
nachdem ein weiterer Krebs fördernder Faktor hinzugekommen ist.
95<br />
Tabelle 34: Latenzzeit für einige beim Menschen bekannte Carcinogene<br />
Carcinogen Ort der Krebsbildung Bereich der<br />
Latenzzeit (Jahre)<br />
Röntgenstrahlen Haut 10 - 30<br />
Radioaktive Farben Knochen 10 - 30<br />
Radioaktive Gesteine Lunge 5 - 20<br />
Ultraviolette Strahlen Haut 10 - 40<br />
Aromatische Amine Blase 10 - 20<br />
Teer (Kohle) Haut 10 - 25<br />
Russ (Kamine) Hoden 11 - 17<br />
Bei den verzögerten Wirkungen, wie dies die Carcinogenese darstellt, ist eine<br />
Abhängigkeit von der Dosis zu beobachten. Dies ist mit unter auch ein Grund dafür,<br />
weshalb die Latenzzeit mit sehr grossen Bereichen, und nicht mit genauen Werten<br />
angegeben wird.<br />
„Ein Gift, welches nicht gleich wirkt,<br />
ist darum kein minder gefährliches Gift.“<br />
(Claudia in Lessing, Emilia Galotti)<br />
Die Latenzzeit ist umso kürzer, je höher die Dosis:<br />
-1<br />
t1 = Konstante( 1) • D<br />
Latenzzeit<br />
1<br />
0.9<br />
0.8<br />
0.7<br />
0.6<br />
0.5<br />
0.4<br />
0.3<br />
0.2<br />
0.1<br />
0<br />
0 5 10 15 20<br />
Abbildung 80: Latenzzeit als Funktion der Dosis<br />
Dosis<br />
Falls die Dosis D genügend klein ist gilt: Latenzzeit t1 > Lebenserwartung.<br />
Ist die Latenzzeit t1 grösser als die Lebenserwartung, dann ist die entsprechende Dosis<br />
nicht von Belang.<br />
Chemie Bützer
Der Anstieg der Wirkung W ist exponentiell.<br />
t<br />
1<br />
= Konstante( 1) •D<br />
a<br />
W = Konstante( 2) •D<br />
• t<br />
a: 2 – 4 (üblicherweise)<br />
W : Wirkung<br />
D: Dosis<br />
t1: Latenzzeit<br />
t: laufende Zeit<br />
Wirkung<br />
4000<br />
3500<br />
3000<br />
2500<br />
2000<br />
1500<br />
1000<br />
500<br />
0<br />
-1<br />
96<br />
0 5 10 15 20<br />
Zeit<br />
Abbildung 81: Tumorbildung in Funktion der Zeit und der Dosis<br />
W (D=1)<br />
W (D=3)<br />
W (D=10)<br />
Krebsauslöser (Initiatoren) bewirken irreversible Veränderungen an der DNA. Krebs<br />
fördernde Faktoren (Promotoren) lassen die DNA unverändert, aber erhöhen die<br />
Produktion der DNA und fördern die Genexpression (Bildung der Proteine, für die diese<br />
Gene codieren). Sie haben keine Auswirkungen, wenn sie vor einem Initiator in Aktion<br />
treten. Wirken die Promotoren jedoch nach einem Initiator über einen längeren Zeitraum<br />
wiederholt ein, fördern sie die Tumorbildung. Tabakrauch enthält beispielsweise viele<br />
chemische Initiatoren und Promotoren. Die Krebs fördernde Wirkung von Zigaretten ist<br />
äusserst bedeutend. Wird das Rauchen aufgegeben, sinkt das Lungenkrebsrisiko<br />
rasch. Ebenfalls Lungenkrebs auslösen kann das Edelgas Radon, das als radioaktives<br />
Zerfallsprodukt des Urans in grösseren Konzentrationen Böden und Baumaterialien und<br />
damit in Häusern (Tunnels und Bergwerken) vorkommt. Alkohol ist ein weiterer<br />
bedeutender Promotor. Chronischer Alkoholmissbrauch erhöht deutlich das Risiko für<br />
Krebserkrankungen, die durch andere Stoffe ausgelöst werden, z. B. Lungenkrebs bei<br />
Rauchern. Carcinogene (Krebs erzeugende) Stoffe verursachen ebenfalls<br />
Chromosomenbrüche und Translokationen.<br />
Der Ursprung eines Tumors, die Initiation, geht somit auf eine Veränderung der DNA<br />
zurück, die innerhalb von Tagen ablaufen kann.<br />
Diese Läsionen brauchen Zeit und günstige Bedingungen, damit Zellen entstehen, die<br />
einen Tumor bilden können. Gewisse Substanzen können hier einen Einfluss zeigen.<br />
Bei solchen Substanzen, z.B. nS sind folgende Möglichkeiten gegeben:<br />
Chemie Bützer
97<br />
Kein Effekt Inhibition Promotion<br />
8 & nS = 8 8 & nS = 2 8 & nS = 16<br />
Promotoren sind selbst keine carcinognene Stoffe. Dabei ist es wesentlich zu wissen,<br />
dass der Organismus Abwehrmechanismen zur Verfügung hat, um auch mit derartigen<br />
Prozessen fertig zu werden. Diese sehen schematisch etwa wie folgt aus:<br />
7.1 Beispiele für die Giftung im Körper<br />
O<br />
O<br />
HO<br />
O<br />
O<br />
R<br />
OH<br />
H 3 C N N<br />
S<br />
O<br />
R<br />
O<br />
NH<br />
O<br />
R<br />
R<br />
Enzyme<br />
O<br />
Enzyme<br />
Enzyme<br />
Saccharin<br />
O<br />
Aflatoxin B 1<br />
H 3 C<br />
H 3 C<br />
O<br />
O<br />
OCH 3<br />
Benz(a)pyren<br />
N N O<br />
O<br />
Säure<br />
Dimethylnitrosamin<br />
H 3 C<br />
H 3 C<br />
NH<br />
+<br />
Dimethylamin<br />
Carcinogene Metallverbindungen: As, Be, Cr, Ni<br />
Carcinogenes Mineral: Crysotil (Vertreter von Asbestmineralien): Mg2Si(OH)4O5<br />
Carcionogene Werkstoffe: Hartholzstäube 73 (z.B. Eichen- und Buchenholzstaub)<br />
HNO 2<br />
Nitrit<br />
Abbildung 82: Krebserzeugende Substanzen, eine Auswahl aus verschiedenen Stoffklassen<br />
73 Bender H.F., Sicherer Umgang mit Gefahrstoffen, Wiley-VCH Verlag GmbH, Weinheim, 2000, 151<br />
Chemie Bützer
7.2 Tumorbildung<br />
Aufnahme<br />
einer<br />
chemisch<br />
inerten<br />
Substanz<br />
Aufnahme<br />
einer<br />
chemisch<br />
reaktiven<br />
Substanz<br />
98<br />
Organismus Ausscheidung<br />
Umwandlung in<br />
reaktiven Metaboliten<br />
(Giftung)<br />
Verarbeitung im<br />
Organismus<br />
Aufnahme in den<br />
Zellkern<br />
Kovalente Bindung<br />
an die DNA<br />
DNA -<br />
Reparatur<br />
Reparatur-<br />
Fehler<br />
Zelltransformation<br />
Tumor<br />
Inaktivierung<br />
Ausscheidung<br />
Intakter Zellkern<br />
Zelltod<br />
Immunabwehr<br />
Abbildung 83: Normale Abwehrmechanismen gegen die Tumorbildung, am Beispiel einer<br />
chemischen Induktion<br />
Chemie Bützer
7.3 Das lineare Modell<br />
Chemie Bützer<br />
99<br />
Zwischen der Dosis und der Wirkung muss ein Zusammenhang bestehen. Ganz einfach<br />
ausgedrückt könnte dies etwa so lauten:<br />
Je grösser die Dosis, desto grösser die Wirkung.<br />
Und der einfachste mathematische Zusammenhang ist hier die Proportionalität, d.h. die<br />
Wirkung steigt proportional (linear) zu der Dosis. Welches sind die wichtigsten<br />
Aussagen dieses Modells? Wohl die wichtigste Aussage des linearen Modells ist, dass<br />
jede noch so kleine Menge Wirkstoff zu einem Effekt führt. Andererseits gibt es auch<br />
Hinweise, darauf, dass bei carcinogenen (krebserzeugenden) Substanzen erst ab einer<br />
gewissen Konzentration beobachtbare <strong>Effekte</strong> eintreten. dies wird dadurch erklärt, dass<br />
unser Körper Reparaturmechanismen besitzt, welche bei zu grosser Belastung (Dosis)<br />
überfordert werden.<br />
Aufgabe:<br />
1) Geben Sie Beispiele an, wo das lineare Modell nicht zutrifft.<br />
2) Geben sie Beispiele an, wo das lineare Modell unüberprüfbar wird.<br />
Bei krebserzeugenden Substanzen oder bei ionisierender Strahlung wird dieses Modell,<br />
mangels zuverlässigen Daten bei ganz tiefen Dosen, allgemein verwendet.<br />
Beispiel:<br />
Diethylnitrosamin [(C2H5)2-N-N=O)] ist eine krebserzeugende Substanz, die sich vor<br />
allem im Magen zwischen Nitriten (NO2 - ) und Aminen, welche beide in der Nahrung<br />
vorkommen können, bilden.<br />
Die Abhängigkeit der mittleren Dosis von Diethylnitrosamin für die Bildung von<br />
Carcinomen bei Ratten.<br />
Tabelle 35: Induktionszeit für die Bildung von Carcinomen mit Diethylnitrosamin<br />
Dosis Induktionszeit Anteil der Carcinome relative<br />
(mg/kg) (Tage) an allen Tieren in % Unsicherheit in %<br />
1000 68 100 8<br />
963 101 100 2<br />
660 137 100 3<br />
460 192 100 4,7<br />
285 238 100 6,5<br />
213 355 100 7,1<br />
137 457 100 8,9<br />
91 609 90 6,3<br />
64 840 71 ca.8
Induktionszeit (Tage)<br />
900<br />
800<br />
700<br />
600<br />
500<br />
400<br />
300<br />
200<br />
100<br />
0<br />
100<br />
0 200 400 600 800 1000 1200<br />
Dosis (mg/kg)<br />
Abbildung 84: Induktionszeit (Latenzzeit) für die Bildung von Carcinomen mit Diethylnitrosamin<br />
bei der Ratte.<br />
Frage:<br />
a) Welchen Einfluss hat die Dosis auf die Krebsbildung?<br />
b) Was sagt die Kolonne mit der relativen Unsicherheit aus?<br />
Latenzzeit (Tage)<br />
900<br />
800<br />
700<br />
600<br />
500<br />
400<br />
300<br />
200<br />
100<br />
0<br />
y = 50753x + 63.195<br />
R 2 = 0.988<br />
0 0.005 0.01 0.015 0.02<br />
Abbildung 85: Latenzzeit (Induktionszeit) zur Bildung eines Carcinoms mit Dimethylnitrosamin<br />
Folgerung:<br />
Die Latenzzeit ist ungefähr proportional 1/D. Für x = ∞, also die völlige Abwesenheit von<br />
Dimethylnitrosamin ergibt sich eine Latenzzeit von t1 = ∞. Ist die Latenzzeit t1 grösser<br />
als die Lebenserwartung, dann spielt die Wirkung W keine Rolle!! Die Lebenserwartung<br />
bei Ratten beträgt ca. 1000 Tage.<br />
Die Krebsanfälligkeit der Bevölkerung kann zu einer einfachen Formel<br />
zusammengefasst werden 74:<br />
74 M. Reitz: Beruf der Eltern - Krebs der Kinder, NZZ, Nr. 111, S.77, 1989<br />
Chemie Bützer<br />
1/D
„Krebsformel“:<br />
Chemie Bützer<br />
101<br />
Disposition & Exposition & Alter = Krebs<br />
• Disposition: Erbanlagen eines Menschen (Veranlagung, Metabolismus..)<br />
• Exposition : Äusserer Einfluss von Krebs erregenden Faktoren (Wirkstoff, Strahlung,<br />
Konzentration, Expositionsdauer)<br />
• Alter : Lebensalter (Reduktion der Immunabwehr und Reparaturmechanismen)<br />
Aufgabe:<br />
Man versuche die "Krebsformel" mit dem Beispiel von Diethylnitrosamin zu<br />
interpretieren, resp. zu bestätigen. Man zeige auch auf, welche Faktoren mit diesem<br />
Beispiel nicht erfasst werden.<br />
Der Zusammenhang zwischen der Dosis und der Wirkung (Effekt) ist schon bei der<br />
Einleitung zum Thema Gifte als zentraler Punkt dargestellt worden. Die linearen<br />
Modelle sind wohl leicht verständlich, sie treffen aber nur für ganz wenige Fälle zu, oder<br />
man verwendet sie überall dort, wo der Zusammenhang zwischen der Dosis und der<br />
Wirkung nicht ermittelt werden kann. Dies ist meist dann der Fall, wenn die Wirkungen<br />
nach denselben Gesetzmässigkeiten auftreten, wie ein Gewinn beim Lotto, nämlich<br />
sehr selten (kleiner 1: 10 000) und statistisch verteilt. Damit muss eine sehr grosse<br />
Anzahl Individuen untersucht werden. Man weicht dann meist auf sog.<br />
epidemiologische Untersuchungen aus, und gibt damit den grossen Vorteil von<br />
Laboruntersuchungen preis, definierte Verhältnisse zu haben, und zwischen Ursache<br />
und Wirkung klare und reproduzierbare Verhältnisse zu schaffen (verschiedene<br />
Bevölkerungsgruppen ernähren sich unterschiedlich, haben andere Umweltbe-<br />
dingungen, unterschiedliche Verhaltensweisen etc.). Resultat aus solchen epidemiologischen<br />
Untersuchungen werden oft nach dem linearen Modell beurteilt.
8 Chemikaliengesetz<br />
Chemie Bützer<br />
102<br />
§ 1 Zweck des Gesetzes<br />
Zweck des Gesetzes ist es, den Menschen und die Umwelt vor schädlichen<br />
Einwirkungen gefährlicher Stoffe und Zubereitungen zu schützen, insbesondere sie<br />
erkennbar zu machen, sie abzuwenden und ihrem Entstehen vorzubeugen.<br />
Sorgfaltspflicht:<br />
Wer mit Stoffen oder Zubereitungen umgeht, muss deren gefährliche Eigenschaften<br />
beachten und die zum Schutz von Leben und Gesundheit erforderlichen Massnahmen<br />
treffen. Insbesondere sind diesbezügliche Informationen der Herstellerin zu beachten.<br />
In Betrieben und Bildungsstätten, in denen beruflich oder gewerblich mit gefährlichen<br />
Stoffen oder Zubereitungen umgegangen wird, ist eine Person zu bezeichnen, die für<br />
Fragen des vorschriftsgemässen Umgangs zuständig ist und die den Vollzugsbehörden<br />
die erforderlichen Auskünfte erteilen kann. Sie muss über die nötigen fachlichen<br />
Qualifikationen und betrieblichen Kompetenzen verfügen. Ihr Name ist der zuständigen<br />
Vollzugsbehörde mitzuteilen.<br />
Gefährliche Stoffe oder gefährliche Zubereitungen sind:<br />
1. explosionsgefährlich,<br />
2. brandfördernd,<br />
3. hochentzündlich,<br />
4. leichtentzündlich,<br />
5. entzündlich,<br />
6. sehr giftig,<br />
7. giftig,<br />
8. gesundheitsschädlich,<br />
9. ätzend,<br />
10. reizend,<br />
11. sensibilisierend,<br />
12. krebserzeugend,<br />
13. fortpflanzungsgefährdend,<br />
14. erbgutverändernd oder<br />
15. umweltgefährlich sind;<br />
ausgenommen sind gefährliche Eigenschaften ionisierender Strahlen (� separat<br />
geregelt)<br />
Als gefährlich gelten Stoffe und Zubereitungen, die das Leben oder die Gesundheit<br />
durch physikalisch-chemische oder toxische Wirkung gefährden können.<br />
8.1 Sicherheitsdatenblatt<br />
Sicherheit vor Handel, "No data - no market", "Keine Daten - kein Markt": Das ist das<br />
Motto, unter dem das neue Chemikalienrichtlinie steht.<br />
Das Sicherheitsdatenblatt ist dazu bestimmt, den beruflichen Verwendern die beim<br />
Umgang mit gefährlichen Stoffen und Erzeugnissen notwendigen physikalischchemischen,<br />
sicherheitstechnischen, toxikologischen und ökologischen Daten und<br />
Umgangsempfehlungen zu vermitteln. Diese werden benötigt, um die erforderlichen<br />
Massnahmen für den Gesundheitsschutz, die Sicherheit am Arbeitsplatz und den
103<br />
Schutz der Umwelt treffen zu können. Die wichtigsten ökologischen Kriterien werden in<br />
der Kategorie persistent, bioakkumulierbar und toxisch, PBT, zusammengefasse,<br />
Das Sicherheitsdatenblatt muss zwingend folgende Angaben enthalten :<br />
1 . Stoff/Zubereitungs - und Firmenbezeichnung<br />
2 . Zusammensetzung/Angaben zu Bestandteilen<br />
3 . Mögliche Gefahren<br />
4 . Erste-Hilfe-Massnahmen<br />
5 . Massnahmen zur Brandbekämpfung<br />
6 . Massnahmen bei unbeabsichtigter Freisetzung<br />
7 . Handhabung und Lagerung<br />
8 . Expositionsbegrenzung und persönliche Schutzausrüstungen<br />
9 . Physikalische und chemische Eigenschaften<br />
10 . Stabilität und Reaktivität<br />
11 . Angaben zur Toxikologie<br />
12 . Angaben zur Ökologie<br />
13 . Hinweise zur Entsorgung<br />
14 . Angaben zum Transport<br />
15 . Vorschriften<br />
16 . Sonstige Angaben .<br />
Zu: 3. Mögliche Gefahren<br />
1. Die wichtigsten Gefährdungen, die von dem Stoff oder dem Erzeugnis<br />
insbesondere für Mensch und Umwelt ausgehen, sind kurz und klar zu<br />
beschreiben.<br />
2. Die wichtigsten schädlichen Auswirkungen auf die menschliche Gesundheit<br />
sowie die Symptome, die bei der Verwendung und einem absehbaren<br />
Missbrauch auftreten können, sind zu beschreiben.<br />
3. Die Angaben müssen von den Angaben auf der Etikette, der Verpackung oder<br />
dem Behälter ausgehen. Sie müssen diese aber nicht wiederholen.<br />
Zu: 4. Erste-Hilfe-Massnahmen<br />
1. Anzugeben sind die erforderlichen Erste-Hilfe-Massnahmen. Insbesondere ist<br />
anzugeben, ob eine sofortige ärztliche Untersuchung notwendig ist.<br />
2. Die Anweisungen für die Erste Hilfe müssen für das Opfer, Umstehende und<br />
Erste-Hilfe-Leistende kurz, klar und verständlich formuliert sein. Symptome und<br />
Auswirkungen sind kurz zu beschreiben. Aus den Angaben muss hervorgehen,<br />
welche Sofortmassnahmen bei Unfällen zu ergreifen sind und ob mit möglichen<br />
verzögerten Wirkungen der Exposition gerechnet werden muss.<br />
3. Die Informationen sind nach den verschiedenen Expositionswegen, d.h.<br />
Einatmen, Haut- und Augenkontakt und Verschlucken, zu unterteilen.<br />
4. Es muss angegeben werden, ob eine ärztliche Betreuung erforderlich ist.<br />
5. Bei bestimmten Stoffen und Erzeugnissen kann es von Bedeutung sein, darauf<br />
hinzuweisen, dass am Arbeitsplatz besondere Mittel verfügbar sein müssen,<br />
damit eine gezielte und sofortige Behandlung gewährleistet ist.<br />
Zu: 5. Massnahmen zur Brandbekämpfung<br />
Anzugeben sind die Anforderungen an die Bekämpfung eines Brandes, der von einem<br />
Stoff oder einem Erzeugnis ausgeht oder diese betreffen könnte, insbesondere:<br />
a. geeignete Löschmittel;<br />
b. aus Sicherheitsgründen ungeeignete Löschmittel;<br />
c. besondere Gefährdungen durch den Stoff oder das Erzeugnis selbst, seine<br />
Verbrennungsprodukte oder entstehende Gase;<br />
Chemie Bützer
Chemie Bützer<br />
104<br />
d. besondere Schutzausrüstung für die Brandbekämpfung.<br />
Zu: 6. Massnahmen bei unbeabsichtigter Freisetzung<br />
1. Je nach Stoff oder Erzeugnis sind folgende Angaben über Massnahmen bei<br />
unbeabsichtigter Freisetzung zu machen:<br />
a. personenbezogene Vorsichtsmassnahmen:<br />
z. B. Entfernen von Zündquellen, Sicherstellen einer ausreichenden Belüftung zw. eines<br />
ausreichenden Atemschutzes, Vermeidung von Staubentwicklung, Verhindern von Haut-<br />
und Augenkontakt;<br />
b. Umweltschutzmassnahmen:<br />
z. B. Verhütung des Eindringens in die Kanalisation, in Oberflächen- und Grundwasser sowie in<br />
den Boden, eventuelle Alarmierung der Nachbarschaft;<br />
c. Verfahren zur Reinigung:<br />
z. B. Einsatz absorbierender Stoffe (z. B. Sand, Kieselgur, saure Bindemittel,<br />
Universalbindemittel, Sägemehl ...), Niederschlagen von Gas und Rauch mit Wasser,<br />
Verdünnung; ausserdem ist möglicherweise auf Mittel, die keinesfalls verwendet werden<br />
dürfen, oder auf geeignete Neutralisierungsmittel hinzuweisen, z. B. „keinesfalls<br />
verwenden“, „neutralisieren mit“.<br />
2. Gegebenenfalls ist auf die Ziffern 8 und 13 zu verweisen.<br />
Zu: 7. Handhabung und Lagerung<br />
7.1 Handhabung<br />
Anzugeben sind Schutzmassnahmen für den sicheren Umgang einschliesslich Empfehlungen für<br />
technische Massnahmen, wie zum Beispiel örtliche Absaugung und<br />
Lüftungsmassnahmen, Massnahmen zur Verhinderung von Aerosol- und Staubbildung,<br />
Brandschutzmassnahmen sowie weitere spezifische Anforderungen oder<br />
Handhabungsregeln im Zusammenhang mit dem Stoff oder dem Erzeugnis (z.B.<br />
geeignete oder nicht zulässige Arbeitsverfahren oder Geräte). Die Art der Massnahmen<br />
sollte nach Möglichkeit kurz beschrieben werden.<br />
7.2 Lagerung<br />
1. Anzugeben sind die Bedingungen für eine sichere Lagerung, wie z. B. spezielle<br />
Anforderungen an Lagerräume oder –behälter (einschliesslich Rückhaltewände<br />
und Belüftung), unverträgliche Materialien, Lagerbedingungen (Temperatur- und<br />
Feuchtigkeitsgrenze/-bereich, Licht, Inertgas usw.), besondere Anforderungen an<br />
elektrische Anlagen und Geräte sowie Massnahmen gegen statische Aufladung.<br />
2. Anzugeben sind, falls erforderlich, Mengenbegrenzungen in Abhängigkeit von<br />
den Lagerbedingungen. Insbesondere sind spezielle Angaben zu machen, wie<br />
die Art des Materials, das für die Verpackung/die Behältnisse des Stoffs oder des<br />
Erzeugnisses verwendet wird.<br />
Zu: 8. Expositionsbegrenzung und persönliche Schutzausrüstung<br />
1. Massnahmen zur Begrenzung und Überwachung der Exposition umfassen alle<br />
Vorkehrungen, die während der Verwendung des Stoffs oder des Erzeugnisses<br />
zu ergreifen sind, um die Exposition der Beschäftigten so gering wie möglich zu<br />
halten.<br />
2. Technische Massnahmen haben Vorrang vor dem Einsatz persönlicher<br />
Schutzausrüstungen. Deshalb sind Angaben über die Gestaltung der<br />
technischen Anlagen zu machen, z. B. geschlossene Anlagen.<br />
3. Anzugeben sind spezifisch zu überwachende Parameter, z. B. Grenzwerte in der<br />
Luft oder in biologischem Material sowie Messverfahren und die entsprechende<br />
Methode.<br />
4. Ist eine persönliche Schutzausrüstung erforderlich, so ist die Art der Ausrüstung<br />
anzugeben, die einen angemessenen Schutz gewährleistet:<br />
a. Atemschutz:
Chemie Bützer<br />
105<br />
Bei gefährlichen Gasen, Dämpfen oder Staub ist auf die geeignete Schutzausrüstung,<br />
wie beispielsweise umluftunabhängige Atemschutzgeräte, geeignete<br />
Masken und Filter hinzuweisen.<br />
b. Handschutz:<br />
Anzugeben ist die Art der bei der Handhabung des Stoffs oder des Erzeugnisses<br />
erforderlichen Schutzhandschuhe. Falls erforderlich, sind zusätzliche<br />
Hand- und Hautschutzmassnahmen anzugeben.<br />
c. Augenschutz:<br />
Anzugeben ist die Art des erforderlichen Augenschutzes, wie zum Beispiel<br />
Sicherheitsglas, Schutzbrillen, Gesichtsschild.<br />
d. Körperschutz:<br />
Anzugeben sind für den Schutz anderer Hautpartien als der Hände die erforderliche Art<br />
und Qualität der Schutzausrüstung, wie zum Beispiel Vollschutz-<br />
Schutzanzug, Schürze, Stiefel. Falls erforderlich, sind besondere<br />
Hygienemassnahmen anzugeben.<br />
5. Gegebenenfalls ist auf die einschlägigen Normen zu verweisen.<br />
Zu: 9. Physikalisch-chemische Eigenschaften<br />
Anzugeben sind gegebenenfalls die nachfolgenden Informationen zum Stoff oder zum<br />
Erzeugnis.<br />
a. Aussehen: Aggregatszustand (fest, flüssig, gasförmig) und Farbe des Stoffs<br />
oder des Erzeugnisses im Lieferzustand.<br />
b. Geruch: Ist ein Geruch wahrnehmbar, so ist dieser kurz zu beschreiben.<br />
c. pH-Wert: pH-Wert des Stoffs oder des Erzeugnisses im Lieferzustand oder in<br />
wässriger Lösung. Im letzteren Fall ist die Konzentration anzugeben.<br />
d. Siedepunkt/Siedebereich:<br />
e. Schmelzpunkt/Schmelzbereich:<br />
f. Flammpunkt:<br />
g. Entzündlichkeit (fest, gasförmig):<br />
h. Selbstentzündlichkeit:<br />
i. Explosionsgefahr:<br />
k. Brandfördernde Eigenschaften:<br />
l. Dampfdruck:<br />
m. Relative Dichte:<br />
n. Löslichkeit:<br />
- Wasserlöslichkeit<br />
- Fettlöslichkeit (Lösungsmittel und Öl angeben)<br />
o. Verteilungskoeffizient n-Octanol/Wasser<br />
p. Sonstige Angaben: Anzugeben sind sicherheitsrelevante Parameter wie<br />
Dampfdichte, Mischbarkeit, Verdampfungsgeschwindigkeit, Leitfähigkeit,<br />
Viskosität usw.<br />
Zu: 10. Stabilität und Reaktivität<br />
Anzugeben sind die Stabilität des Stoffs oder des Erzeugnisses sowie eventuelle<br />
gefährliche Reaktionen unter bestimmten Bedingungen.<br />
a. zu vermeidende Bedingungen:<br />
Anzugeben sind Bedingungen wie Temperatur, Druck, Licht, Erschütterung usw., die zu<br />
einer gefährlichen Reaktion führen können. Wenn möglich ist die Reaktion<br />
kurz zu beschreiben.<br />
b. zu vermeidende Stoffe:
106<br />
Anzugeben sind Stoffe wie Wasser, Luft, Säuren, Basen, Oxidationsmittel oder jeder<br />
andere Stoff, der zu einer gefährlichen Reaktion führen kann. Wenn<br />
möglich sind die Reaktionen kurz zu beschreiben.<br />
c. Gefährliche Zersetzungsprodukte:<br />
Anzugeben sind gefährliche Stoffe, die bei der Zersetzung eines Stoffs in<br />
kritischen Mengen entstehen können. Insbesondere sind anzugeben:<br />
1. die Notwendigkeit von Stabilisatoren und ihr Vorhandensein;<br />
2. die Möglichkeit einer gefährlichen exothermen Reaktion;<br />
3. Auswirkungen einer Änderung des Aggregatzustands des Stoffs oder des<br />
Erzeugnisses auf die Sicherheit;<br />
4. gegebenenfalls gefährliche Zersetzungsprodukte bei Kontakt mit Wasser;<br />
5. mögliche Zersetzung zu instabilen Produkten.<br />
Zu: 11. Angaben zur Toxikologie<br />
Dieser Abschnitt umfasst die kurze, aber vollständige und verständliche Beschreibung der verschiedenen<br />
toxikologischen Auswirkungen ( auf die Gesundheit), die sich beim Kontakt mit dem Stoff oder der<br />
Zubereitung für den Verwender ergeben können .<br />
Anzugeben sind schädliche Auswirkungen durch Exposition gegenüber dem Stoff oder der Zubereitung,<br />
wobei von Erfahrungen aus der Praxis oder/und den Ergebnissen wissenschaftlicher Versuche<br />
auszugehen ist . Die Wirkungen sind entsprechend den physikalischen, chemischen und toxikologischen<br />
Eigenschaften nach Expositionswegen ( Einatmen, Verschlucken, Haut - und Augenkontakt ) getrennt zu<br />
beschreiben. Dabei sind die sofort oder verzögert auftretenden Wirkungen sowie die chronischen<br />
Wirkungen nach kurzer oder länger anhaltender Exposition zu berücksichtigen, z . B . Sensibilisierung,<br />
Karzinogenität, Mutagenität, Reproduktionstoxizität einschliesslich der Teratogenität und narkotische<br />
Wirkungen .<br />
Unter Berücksichtigung der Angaben in Punkt 2 "Zusammensetzung/Angaben zu Bestandteilen" kann es<br />
erforderlich sein, auf besondere Wirkungen bestimmter Bestandteile einer Zubereitung hinzuweisen .<br />
Zu: 12. Angaben zur Ökologie<br />
1. Anzugeben ist eine Bewertung der Auswirkungen, des Verhaltens und des<br />
Verbleibs in der Umwelt, in Abhängigkeit von der Beschaffenheit und den<br />
wahrscheinlichen Verwendungsarten des Stoffs oder des Erzeugnisses. Die<br />
gleichen Angaben sind bei Giften und umweltgefährlichen Stoffen und<br />
Erzeugnissen zu machen, die sich aus dem Abbau von Stoffen oder<br />
Erzeugnissen ergeben.<br />
2. Insbesondere können folgende umweltrelevante Angaben massgebend sein:<br />
a. Mobilität: - nachgewiesene oder vorhersehbare Verbreitung in die einzelnen<br />
Umweltbereiche,<br />
- Oberflächenspannung,<br />
- Adsorption/Desorption,<br />
- sonstige physikalisch-chemische Eigenschaften;<br />
b. Abbaubarkeit: - biotischer und abiotischer Abbau,<br />
- aerober und anaerober Abbau,<br />
- Persistenz;<br />
c. Akkumulation: - Bioakkumulationspotential,<br />
- Anreicherung über die Nahrungskette;<br />
d. Kurz- und Langzeitfolgen hinsichtlich:<br />
1. Ökotoxizität:<br />
- Wasserorganismen,<br />
- Bodenorganismen,<br />
- Pflanzen und Tiere;<br />
2. Sonstige negative Auswirkungen:<br />
- Ozonabbaupotential,<br />
- photochemisches Ozonaufbaupotential,<br />
- Erderwärmungspotential,<br />
Chemie Bützer
Chemie Bützer<br />
107<br />
- Auswirkungen auf Abwasserreinigungsanlagen.<br />
3. Es ist dafür zu sorgen, dass auch in anderen Abschnitten des<br />
Sicherheitsdatenblatts umweltrelevante Angaben gemacht werden, insbesondere<br />
bei den Ratschlägen für die kontrollierte Freisetzung, den Massnahmen bei<br />
unbeabsichtigter Freisetzung und den Hinweisen zur Entsorgung.<br />
4. Solange noch keine Kriterien für die Bewertung der Umweltverträglichkeit eines<br />
Erzeugnisses aufgestellt sind, sind Angaben zu den oben genannten<br />
Eigenschaften auch für Stoffe zu machen, die in einem Erzeugnis enthalten und<br />
als umweltgefährlich eingestuft sind.<br />
Abiotischer Abbau (Hydrolyse, Photolyse, Photooxidation)<br />
Hier können Angaben zur Hydrolyse und zum Photoabbau im Wasser (bei flüchtigen Stoffen zum<br />
photooxidativen Abbau in der Luft) erfolgen.<br />
Biologischer Abbau / Elimination<br />
Stoffe und Zubereitungen bei denen zur biologischen Abbaubarkeit rechtliche Mindestanforderungen<br />
bestehen (z. B. Tenside), sind entsprechend zu bewerten.<br />
Eine Abschätzung der „Mobilität“ kann unter Berücksichtigung des Dampfdrucks, des<br />
Verteilungskoeffizienten n-Octanol / Wasser, der Wasserlöslichkeit und des Adsorptions-<br />
/Desorptionsverhaltens des chemischen Stoffs bzw. der einzelnen Komponenten eines Erzeugnisses<br />
erfolgen.<br />
Zum „Bioakkumulationspotential“ oder zur Bioakkumulation sind Angaben für chemische Stoffe<br />
erforderlich (z. B. in Form des Biokonzentrationsfaktors BCF). Sofern Hinweise auf eine Gefährdung<br />
durch Biomagnifikation vorliegen, sind diese ebenfalls anzugeben. Das Bioakkumulationspotential kann<br />
aus dem Verteilungskoeffizienten n-Octanol / Wasser (log Pow), der Oberflächenspannung und dem<br />
Adsorptionsverhalten abgeleitet werden. Dieses gilt auch für als „umweltgefährlich“ einzustufende<br />
Einzelkomponenten bei Erzeugnissen. Bei nicht oberflächenaktiven Stoffen (σ > 50 mN/m bei einer<br />
Konzentration ≤ 1 g/l), deren log Pow < 3 ist und die keine starke Adsorption aufweisen, kann hier eine<br />
Aussage wie „Kein Hinweis auf Bioakkumulationspotential“ vorgenommen werden. Es ist zu<br />
berücksichtigen, dass bestimmte Stoffklassen (z. B. dissoziierte Säuren oder Basen, Salze, ionische<br />
Tenside) für eine Bestimmung ihres Verteilungsverhaltens im System n-Octanol / Wasser nicht geeignet<br />
sind.<br />
Ökotoxizität: Hier sind Daten zur Toxizität gegenüber aquatischen Organismen (Fisch, Daphnie, Alge),<br />
Bodenorganismen, Pflanzen und Tieren mit Versuchsdauer und Testmethode anzugeben.<br />
Zu: 13. Hinweise zur Entsorgung<br />
1. Besteht bei der Entsorgung eines Stoffs oder eines Erzeugnisses (Restmengen<br />
oder Abfälle aus der planmässigen Verwendung) die Gefahr, dass es bei<br />
unsachgemässer Behandlung zu schädlichen oder lästigen Einwirkungen<br />
kommen kann, müssen die Rückstände genannt und Hinweise für ihre sichere<br />
Handhabung gegeben werden.<br />
2. Anzugeben sind die geeigneten Entsorgungsverfahren für den Stoff oder das<br />
Erzeugnis sowie für verunreinigtes Verpackungsmaterial (stoffliche Verwertung,<br />
Verbrennung, Deponie usw.). Dabei sind die Bestimmungen der<br />
Umweltschutzgesetzgebung zu beachten.<br />
9 Die Wirkung von Strahlen<br />
9.1 Kernaussagen zur Radioaktivität<br />
• Radioaktivität ist die spontane Umwandlung von Atomkernen unter gleichzeitiger<br />
Aussendung von Bestandteilen von Atomen, die als Alpha-, Betateilchen bezeichnet
108<br />
werden oder von elektromagnetischen Strahlen, die man Gammastrahlen bzw.<br />
Röntgenstrahlen nennt. Die Strahlung heisst ionisierende Strahlung weil sie bei<br />
Elektronen aus den Hüllen der Atome herausschlagen kann und damit geladene<br />
Teilchen,Ionen, erzeugt.<br />
• Ein Zerfall pro Sekunde hat den Wert 1 Becquerel (1 Bq).<br />
• Radioaktivität tritt auch natürlich auf, zum Beispiel auch bei Uranerzen.<br />
• Diese Strahlung ist leicht messbar..<br />
• Man kennt verschiedene Strahlenarten (z.B. α, β - ,β + ,γ- Strahlen) die für Radioaktivität<br />
verantwortlich sind, verschiedene Quellen (Höhenstrahlung, Elemente) aber<br />
auch unterschiedliche Energien.<br />
• Selbst kleinste Mengen Radioaktivität lassen sich mit den ausserordentlich<br />
empfindlichen Messgeräten nachweisen.<br />
• Messungen von kleinen Dosisleistungen geben immer unterschiedliche Werte, sie<br />
lassen sich nur mithilfe der Statistik auswerten. Interpretierbare Resultate ergeben<br />
sich nur bei einer grossen Zahl oder bei sehr langzeitigen Messungen.<br />
• Es gibt natürlicherweise Orte mit sehr tiefer, aber auch solche mit sehr hoher<br />
Aktivität.<br />
• Die Strahlenexpositionen durch natürliche Radioaktivität streuen je nach<br />
Zeit, Ort, Umgebungsbedingungen und Verhalten auch im Kanton St.<br />
Gallen recht stark.<br />
• Ionisierende Strahlen spürt man nicht, ebenso wenig, wie die UV- Strahlen, die den<br />
Sonnenbrand verursachen.<br />
• Kleider halten Gammastrahlen nicht ab.<br />
• Ein Körper, der ionisierenden Strahlen ausgesetzt war, ist nachher selbst nicht<br />
radioaktiv (mit Ausnahme von Neutronen).<br />
• Unser Körper kann durch natürliche Radioaktivität von aussen oder von innen<br />
bestrahlt werden. Beides können wir bis zu einem gewissen Mass nicht vermeiden.<br />
• Unser Körper enthält natürlicherweise radioaktive Stoffe. In einem Menschen von 70<br />
kg zerfallen pro Sekunde rund 20'000 Atome (20 kBq).<br />
• Von ein und demselben Element gibt es nichtradioaktive (stabile) und radioaktive<br />
Vertreter (instabile Isotope). Unser Körper, aber auch Pflanzen und Tiere können<br />
diese im Stoffwechsel fast nicht unterscheiden.<br />
• Die Evolution des Lebens hat im Strahlungsfeld der natürlichen Radioaktivität<br />
stattgefunden. Es ist anzunehmen, dass sich die Lebewesen an unterschiedliche<br />
Strahlenexpositionen angepasst oder diese sogar ausgenützt haben (genetische<br />
Mutationen).<br />
• Die wichtigsten Strahlenschäden bei grösseren Dosen werden durch Protein- nicht<br />
durch DNA-Schäden verursacht 75.<br />
9.2 Auswirkungen auf den Menschen<br />
Uran macht etwa einen Drittel der gesamten terrestrischen Strahlung (Kalium, Thorium<br />
und Uran) aus. Das entspricht einer effektiven Dosis von ungefähr 0.15 mSv pro Jahr,<br />
was etwa 4% der mittleren Jahresdosis von Schweizerinnen und Schweizern<br />
entspricht.<br />
Der menschliche Organismus enthält selbst stets eine kleine Menge Uran, welche eine<br />
Aktivität von durchschnittlich 7 mBq/kg erzeugt (bei einem Menschen von 70 kg im<br />
Durchschnitt also etwa alle 2 Sekunden ein Zerfall) 76.<br />
75 Daly J.M. et al., Protein Oxidation Implicated as the Primary Determinant of Bacterial Radioresistance,<br />
PLoS Biol 5(4): e92 doi:10.1371/journal.pbio.0050092<br />
Chemie Bützer
9.2.1 Ortsdosisleistung<br />
109<br />
Als Ortsdosisleistung wird die Aktivität pro Zeit an einem Ort verstanden.<br />
Einheit für übliche Werte: nSv/h oder 1000 mal grösser: μSv/h<br />
Bisherige gesamtschweizerische Messungen der Ortsdosisleistungen und der Gehalte<br />
an natürlichen radioaktiven Stoffen in Nahrungsmitteln und Trinkwasser zeigen,<br />
dass der Kanton St. Gallen keine besondere Stellung einnimmt. Die mittleren Werte, der<br />
an einem Ort direkt messbaren Strahlung, liegen bei 60 bis 80 nSv/h 77. Vor allem weist<br />
der Kanton, wie die Radonmessungen von 1996 gezeigt haben, keine grösseren<br />
Gebiete auf, die eine überhöhte Radioaktivität zeigen.<br />
Was sagen aber Mittelwerte aus, wie sind sie für einzelne Personen zu interpretieren?<br />
Irgendwie steht immer auch die Frage im Raum: „Ist diese natürliche Strahlung<br />
gefährlich?“<br />
Eine endgültige Antwort darauf ist uns nicht möglich. Sicher ist, dass sich der Mensch<br />
in seiner ganzen Evolution zusammen mit der natürlichen Radioaktivität entwickelt<br />
hat. Es ist somit anzunehmen, dass sich das Leben auf diese Strahlung eingestellt<br />
hat. Im Kanton St. Gallen schwankt die Ortsdosisleistung zwischen 60 und 80<br />
nS/h, die höchsten Werte im Kanton wurden auf dem Risetengrat im Weistannental mit<br />
ca. 1800 nS/h gemessen.<br />
Aus vielen Messungen wissen wir: Die Ortsdosisleistungen sind über die Zeit gesehen<br />
nicht konstant. Die Stundenmittelwerte variieren besonders stark bei Niederschlägen -<br />
über 100%!!.<br />
Die Höhenstrahlung liefert ebenfalls einen nicht zu unterschätzenden Beitrag. Diese<br />
Dosisleistung nimmt wegen der Abnahme der Luftschichtdicke mit zunehmenden Höhe<br />
ab (Strahlenbelastung durch Fliegen!!).<br />
MikroSievert/h<br />
0.200<br />
0.150<br />
0.100<br />
0.050<br />
0.000<br />
y = 0.0002x - 0.1749<br />
R 2 = 0.9754<br />
1200 1400 1600 1800 2000 2200<br />
Höhe über Meer<br />
Abbildung 86: Zunahme der Höhenstrahlung im Weisstannental; Dosisleistung (μSv/h) in Funktion<br />
der Höhe über Meer (die Grundwerte sind gegenüber den Normalwerten erhöht)<br />
76 Nationale Genossenschaft für die Lagerung radioaktiver Abfälle (Nagra), Nagra informiert Nr. 25,<br />
Nagra, Wettingen 1995, S.61ff.<br />
77 Nationale Alarmzentrale, Zürich, Übung NARACH, 31.8. bis 3..9.1992<br />
Chemie Bützer
110<br />
Beurteilung der Gefährdung: Faustregel<br />
kBq klein<br />
MBq mässig<br />
GBq giftig<br />
TBq tödlich<br />
9.2.2 Interne Bestrahlung<br />
Die inkorporierten Radionuklide sind insofern besonders bedeutsam, weil sie dauernd<br />
bestrahlen und die Distanz zum bestrahlten Gewebe ausserordentlich klein ist (interne<br />
Bestrahlung). Daher sind hier grosse Schäden möglich.<br />
Gehen wir davon aus, dass Stoffe im Körper abgebaut und gleichzeitig auch<br />
ausgeschieden werden. Es existieren damit in diesem einfachen Modell zwei Wege,<br />
wie ein Stoff aus dem Körper entfernt werden kann. Bei einem Medikament hängt<br />
die Wirkungsdauer ganz entscheidend von den zwei Prozessen Metabolisierung<br />
und Elimination (Ausscheidung) ab, aber auch bei Giften sind diese beiden<br />
Abbauwege von grosser Bedeutung.<br />
Ein einfaches Modell für gleichzeitigen Abbau sieht wie folgt aus:<br />
Substanz → λm, Tm → m (Metabolisierung, Zerfall)<br />
→ λe, Te → e (Elimination)<br />
λm: Zerfallskonst. Metabolisierung [1/sec] (chemisch km: Geschwindigkeitskonstante)<br />
λe: Zerfallskonst. Elimination [1/sec] (chemisch ke: Geschwindigkeitskonstante)<br />
Tm, Ta: Halbwertszeit: Tm = ln2/ λm resp. Te = ln2/ λe) [sec]<br />
Allgemein gilt : λ(eff) = λa + λb + λc + ... + λn<br />
und für die partiellen Halbwertszeiten:<br />
1/Teff = 1/Ta + 1/Tb + 1/Tc +....+ 1/Tn<br />
Teff : effektiv beobachtete Halbwertszeit des gesamten Prozesses und für unseren<br />
einfachen Fall eines dualen Abbaus:<br />
1/Teff = 1/Tm + 1/Te<br />
Tm • Te<br />
Teff =<br />
Tm + Te<br />
Beispiel: Verminderung der Strahlenbelastung durch Einsatz von nichtradioaktiven<br />
Stoffen.<br />
Caesium-137: Physikalische Halbwertszeit Tm = 30 Jahre<br />
Ausscheidung von Caesium durch die Kuh über die Milch:<br />
Teff = 15 - 30 Tage = 0.041 - 0.082 Jahre<br />
damit wird Te = 15 - 30 Tage = 0.041 - 0.082 Jahre<br />
Te : biologische Halbwertszeit<br />
Ausscheidung von Cs-137 bei der Kuh über das Fleisch: Teff = 30 Tage<br />
bei Ziege und Schaf: Teff = 20 Tage<br />
d.h. bei der Kuh, der Ziege und dem Schaf wird die Ausscheidung von Caesium<br />
massgeblich nicht durch den radioaktiven Zerfall, sondern durch die biologische<br />
Chemie Bützer
Chemie Bützer<br />
111<br />
Ausscheidung bestimmt. Wird nun dem Futter pro Tag zwei mal ca. 1.5 Gramm<br />
Ammoniumeisen(III)-hexacyanoferrat NH4Fe(Fe(CN)6) (Giese- Salz) zugemischt, dann<br />
wird das Caesiumion durch das fast gleich grosse Ammoniumion in einem Ionentausch<br />
ersetzt. Die biologische Halbwertszeit bei einer Kuh sinkt mit diesem Salz von<br />
durchschnittlich 21 Tagen auf etwa 4 Tage, bei Schafen von 14 Tagen auf etwa 3 Tage.<br />
Damit sinkt auch die Strahlenbelastung der Tiere, im Fleisch von Kühen wird noch etwa<br />
22% der normalen Caesiumkonzentration gefunden, und selbstverständlich auch die<br />
Konzentration der radioaktiven Nuklide in der Milch. Der im Magen gebildete<br />
schwerlösliche Caesiumkomplex ist gegen Säuren, Verdauungssekrete und<br />
Mikroorganismen stabil und wird mit dem Kot ausgeschieden - das nächste Entsorgungsproblem<br />
ergibt sich leider zwangsläufig...<br />
Der Gras- Kuh- Milchpfad von Iod-131:<br />
• Physikalische Halbwertszeit Tm = 8 Tage<br />
• Effektive Halbwertszeit Tm = 4 Tage (Gras)<br />
• Biologische Halbwertszeit Te = 8 Tage (Gras)<br />
• Effektive Halbwertszeit Teff = 1 Tag (Kuhmilch)<br />
• Biologische Halbwertszeit Te = 1.14 Tage (Kuhmilch)<br />
Folgerung:<br />
• Wird ein Stoff über zwei Wege gleichzeitig inaktiviert, dann kann ein einfaches<br />
Modell für die Beurteilung eingesetzt werden.<br />
• Die Halbwertszeiten für beide Wege sind kommutativ.<br />
• Unterscheiden sich die beiden Halbwertszeiten sehr stark, dann ist kleinere<br />
massgebend für die Beurteilung.<br />
• Wenn sich die beiden Halbwertszeiten kaum unterscheiden, kann im günstigsten<br />
Fall für den effektiven Prozess die Hälfte der Halbwertszeit erwartet werden.<br />
9.2.3 Molekulare <strong>Effekte</strong><br />
Beispiel: Spaltung von Sauerstoff O2, O=O<br />
Mit welcher Wellenlänge von Licht kann Sauerstoff gespalten werden?<br />
Bindungsenergie von O=O: 495 kJ/mol = 495'000 J/mol<br />
Pro Molekül: 495’000/NA = 495’000/6,022 x 10 23 = 8,25 x 10 -19 J<br />
E = h x ν; h = 6.625 x 10 -34 Js (Planck’sches Wirkungsquantum)<br />
c = ν x λ; c = 3 x 10 8 m/s; E = h x c/λ;<br />
λ = h x c/E = 6.625 x 10 -34 x 3 x 10 8 /8,25 x 10 19 = 2.5 x 10 -7 m = 250 nm (UV-Strahlen)<br />
Die Wellenlänge muss kleiner als 250 nm sein.<br />
UV-A: 400–320 nm, UV-B: 320–280 nm, UV-C: 280–200 nm;<br />
Ionisierende Strahlung ist eine wesentliche Ursache für Krebserkrankungen. Strahlung<br />
bewirkt DNA-Veränderungen wie Chromosomenbrüche und Transpositionen, d. h.,<br />
abgespaltene Chromosomenenden werden ausgetauscht. Strahlung ist ein Auslöser<br />
der Carcinogenese. Sie ruft Veränderungen hervor, die nach einer Latenzzeit von<br />
einigen Jahren zu Krebs führen können. Diese Verzögerung ermöglicht weiteren<br />
Faktoren, zu diesem Prozess beizutragen. Ionisierende Strahlung ist vergleichsweise<br />
sehr wirksam.
112<br />
Tabelle 36: Verschiedene Wirkungen der Inaktivierung im Vergleich (KBV<br />
Koloniebildungsvermögen von Escherichia Coli-Bakterien) 78<br />
Agens Dosis um das KBV auf<br />
37 % zu reduzieren<br />
Strahlungsenergie<br />
Gammastrahlen +<br />
Sauerstoff<br />
20 Gy (Gray) = 20 J/kg<br />
(Energie-)Dosis der<br />
Strahlungsabsorption<br />
Energieäquivalent<br />
pro Zelle (nJ)<br />
0,000 000 04<br />
Ultraviolett (260 nm) 0,000005 (J/mm 2 ), 10% absorbiert 0,000 000 1<br />
Wärmeenergie<br />
Hitze (70 °C) 1 Minute 0,02<br />
Chemische Energie<br />
Cyanid (CN - ) 300 000 000 000 Moleküle pro Zelle 0,05<br />
Wasserstoffperoxid 30 000 000 000 Moleküle pro Zelle 0,005<br />
Mitomycin C 500 000 000 Moleküle pro Zelle 0.0001<br />
Die ionisierenden Strahlen sind mit Abstand die Wirkungsvollsten, sie benötigen am<br />
wenigsten Energie um die Zellen zu inaktivieren. Alle Wirkungen spielen sich letztlich<br />
auf molekularer Ebene ab und können mit chemischen Reaktionen erklärt werden. Was<br />
sich auch immer abspielt, es werden Bindungen gebrochen und neue Bindungen<br />
gebildet. In einem intakten Stoffwechsel werden die richtigen Substanzen zur rechten<br />
Zeit am richtigen Ort gebildet. Das ist bei einer Einwirkung von aussen nicht mehr der<br />
Fall – das führt zu Schäden.<br />
Nichtionisierende Strahlen:<br />
Hierzu gehören vor allem: UV, Mikrowellen etc.<br />
Es gilt hier das Gesetz von Bunsen-Roscoe 79: „Die photochemische Wirkung von Licht<br />
hängt nur von dessen Dosis (Intensität mal Zeit), jedoch nicht alleine von der Internsität<br />
ab.“<br />
9.3 Das Krebsrisiko<br />
Der Mensch besitzt etwa 100 000 000 000 Zellen, und ein Minimum an Wirkung ist ab<br />
etwa 500 - 1000 Molekülen pro Zelle zu erwarten. Damit ist eine minimale Dosis von 10<br />
000 000 000 000 000 Molekülen oder 0.000 001 mol ein Richtwert. Für die Wirkung von<br />
Molekülen ist von entscheidender Bedeutung, dass die thermodynamische Temperatur<br />
in Kelvin, also absolut, massgebend ist. Damit hat die normale Körpertemperatur den<br />
Wert von 273+37 = 310 K, also eine relativ hohe Temperatur. Für die chemische<br />
Wirkung kann also bei normaler Körpertemperatur von 37°C schon von einer hohen<br />
Aktivierungsenergie und von einer hohen "Betriebstemperatur" ausgegangen werden.<br />
Man nimmt an, dass auf 100'000 Personen, die mit einer Dosis von 10 mSv bestrahlt<br />
werden, zusätzlich 50 tödliche Krebsfälle auftreten 80.<br />
Da es keine belegbaren Gründe gegen die Annahme gibt, dass im schlimmsten Falle<br />
ein einziges Molekül zu Krebs führen kann, lässt sich kein praktisch brauchbarer "no<br />
observed adverse effect level" (NOAEL) im üblichen Sinne postulieren (ist kaum<br />
78 Fritz-Niggli H., Strahlengefährdung, Strahlenschutz, Verlag Hans Huber, Bern/Stuttgart/Wien, 1975,<br />
63<br />
79 Schmidt W., Die Biophysik des Farbensehens, Edition Farbe beim Regenbogen Verlag (1999) 107<br />
80 BAG, Radioaktivität und Stralenschutz, Bern (1999) S.18<br />
Chemie Bützer
113<br />
beweisbar!). Obschon es möglich ist, tumorinitiierende Stoffe in Industrie, Haushalt und<br />
Landwirtschaft zu verbieten, sind wir trotzdem solchen Stoffen in der Umwelt<br />
ausgesetzt, z.B. Nitrosaminen und Aflatoxinen. In solchen Fällen versucht man die<br />
Anzahl zusätzlicher Krebserkrankungen (z.B. pro 1'000'000 Menschen in 70 Jahren) zu<br />
berechnen, die bei einer bestimmten Exposition auftreten. Fraglich ist dann noch, was<br />
als akzeptables Risiko zu gelten hat. Als Massstab werden dabei Risiken herangezogen,<br />
die wir im täglichen Leben ohne weiteres akzeptieren (vide supra). Danach kann<br />
ein zusätzlicher Krebstodesfall pro 106 Menschenleben à 70 Jahre als akzeptabel<br />
gelten (für wen?). Auf Grund solcher Überlegungen wurde z.B. für Aflatoxine eine<br />
Toleranz von < 5 ppb in Milch festgelegt (Deutschland).<br />
Im Strahlenschutz gilt das sogenannte ALARA-Prinzip: "As Low As Reasonably<br />
Achievable".<br />
Man kennt nicht nur die ionisierenden Strahlen, sondern auch solche, welche keine<br />
Bindungen spalten können, sogenannte nichtionisierende Strahlen NIR (non ionizing<br />
radiation). Dazu gehören z.B.: Schall, Ultraschall, Infrarot, Mikrowellen (Handy),<br />
Radiowellen, elektromagnetische Wechselfelder etc.<br />
10 Überblick<br />
Dosis<br />
therap. Breite<br />
MAK, MIK, MEK, MOK<br />
Konzentration x Zeit<br />
Atemrate<br />
aehnliche Stoffe<br />
chirale Stoffe<br />
Dosis<br />
ED, LD, Kd<br />
Stoechiometrie<br />
a=1 -> ED(50)=Kd<br />
Chemie Bützer<br />
Reparatur<br />
Dosis<br />
Latenzzeit<br />
a<br />
Aufnahmedauer<br />
Aufnahmezeitpunkt<br />
akut<br />
chronisch<br />
Spezifitaet<br />
Wirksamkeit<br />
Empfindlichkeit<br />
CARCINOGENITAET<br />
GEFAEHRDUNG<br />
ZEIT<br />
DOSIS<br />
BINDUNG<br />
WIRKSTOFFE<br />
GRUNDSATZ<br />
VORKOMMEN<br />
WIRKUNG<br />
MODELLE<br />
PHYSIOLOGIE<br />
Allein die Dosis<br />
macht, dass etwas<br />
ein Gift ist.<br />
Natur<br />
Natur und Synthese<br />
Synthese<br />
Aufnahme, Resorption<br />
Verteilung<br />
Speicherung<br />
Wirkort (Rezeptor)<br />
Abbau<br />
Umbau<br />
Zugang zum Rezeptor<br />
Bindung<br />
Ausscheidung, HWZ<br />
Ausloesung der Wirkung<br />
Occupationstheorie<br />
ct-Produkt (Haber'sche Regel)<br />
Saeure<br />
Base<br />
Dissoziation<br />
pH<br />
Volumen<br />
Konzentration<br />
Rezeptor Gleichgewicht<br />
log-Dosis-Wirkungskurve<br />
Sigmoide<br />
relativer Effekt<br />
Atemrate<br />
Schwellwert
11 Glossar<br />
Chemie Bützer<br />
114<br />
• Abhängigkeit ist ein Überbegriff, der sich in � Gewohnheitsbildung und � Sucht<br />
unterteilen lässt. Der Übergang zwischen den beiden ist fliessend.<br />
• Adaption: Anpassung von Organen oder Organismen an bestimmte äussere Reize<br />
oder Bedingungen.<br />
• ADI ( Acceptable Daily Intake = annehmbare (duldbare) tägliche Aufnahme): Die<br />
tägliche Aufnahme während des ganzen Lebens, die nach dem Stand allen<br />
verfügbaren Wissens kein erkennbares Risiko darstellt. Er ergibt sich aus der in<br />
langfristigen Tierversuchen (chronische Dosis) ermittelten Dosis, bei der kein<br />
erkennbarer Effekt – auch nicht bei den Nachkommen – eintritt (NEL: No Effect<br />
Level oder NOEL). ADI ≈ NOEL/100. Der Faktor 100 ist ein Sicherheitsfaktor; Faktor<br />
10 für die Übertrageun Tier-Mansch, Faktor 10 als Sicherheitsfaktor. Im Allgemeinen<br />
liegen die Fremdstoff-, Pflanzenschutzmittel- und Schädlingsbekämpfungsmittel-<br />
Höchstmengen unter den ADI-Werten. Für den Menschen zulässige tägliche<br />
Aufnahme eines Fremdstoffes, höchste duldbare Tagesdosis.<br />
• Aerosol: Ein Gas (oder Gasgemisch), das feinstverteilte, feste oder flüssige<br />
Bestandteile enthält. Optimal lungengängige Teilchen haben etwa einen<br />
Durchmesser von 1 – 5 μm.<br />
• Agonist: Substanz, die wie ein physiologischer Mediator einen Rezeptor aktivieren<br />
kann.<br />
• AGW: Der Arbeitsplatzgrenzwert (AGW) ist die zeitlich gewichtete durchschnittliche<br />
Konzentration eines Stoffes in der Luft am Arbeitsplatz, bei der eine akute oder<br />
chronische Schädigung der Gesundheit der Beschäftigten nicht zu erwarten ist. Bei<br />
der Festlegung wird von einer in der Regel achtstündigen Exposition an fünf Tagen<br />
in der Woche während der Lebensarbeitszeit ausgegangen. Der<br />
Arbeitsplatzgrenzwert wird in mg/m³ und ml/m³ (ppm) angegeben.<br />
• Akkumulation: Anreicherung (Kumulation) einer Substanz im Organismus.<br />
• akute Toxizität : Toxizität einer Einzeldosis, - die schädliche Wirkung tritt bereits<br />
nach einmaliger Verabreichung der toxischen Substanz auf. Beobachtungszeitraum<br />
max. 2 Wochen, normal 5 Tage, Angabe z.B. LD(50).<br />
• Allergie: Überempfindlichkeitsreaktion des Organismus auf einen wiederholt<br />
angetroffenen Stoff (=Antigene wie Proteine, Polysaccharide oder einfache<br />
chemische Stoffe). Allergie bei Vereinigung des allergenen Stoffes mit dem<br />
spezifischen, meist zellgebundenen Antikörper, äussert sich in entzündlichen<br />
Reaktionen (Hautekzem, Heuschnupfen, Nesselfieber usw.) siehe auch<br />
Idiosynkrasie.<br />
• Antagonismus (lateinisch: Gegensatz, Widerstreit): Gegenteil von Synergismus.<br />
• analgetisch: schmerzlindernd<br />
• Antidote sind im engeren Sinn Stoffe, welche bereits resorbierte Gifte inaktivieren,<br />
d.h. entweder a) durch pharmakologische <strong>Effekte</strong> die Wirkung am Rezeptor oder<br />
Organsystem aufheben oder doch vermieden werden, oder b) durch direkte und<br />
indirekte chemische Reaktion den Giftstoff inaktivieren.<br />
• antiphlogistisch: entzündungshemmend<br />
• antipyretisch: fiebersenkend<br />
• antirheumatisch: gegen Rheumatismus<br />
• antithromotisch: verhindert die Blutplättchenaggregation<br />
• Atemrate : das pro Zeiteinheit benötigte Luftvolumen bei der Atmung.<br />
• BAT-Wert: Biologischer Arbeitsstoff-Toleranzwert. Die beim Menschen<br />
höchstzulässige Menge eines Arbeitsstoffs bzw. dessen Metaboliten im Organismus,<br />
die die Gesundheit des Exponierten nicht beeinträchtigen.
115<br />
• BGW: Grenzwert für die toxikologisch-arbeitsmedizinisch abgeleitete Konzentration<br />
eines Stoffes, eines seines Metaboliten oder eines Beanspruchungsindikators im<br />
entsprechenden biologischen Material, bei dem im Allgemeinen die Gesundheit<br />
eines Beschäftigten nicht beeinträchtigt wird.<br />
• Biotransformation, Metabolismus, Metabolisierung, Stoffwechsel<br />
(biotransformation, metabolism) Unter Biotransformation ist die durch Enzyme<br />
katalysierte chemische Umwandlung von Arzneimitteln oder anderen Xenobiotika in<br />
eine andere Molekülart zu verstehen. Heute empfehlen viele Fachleute, statt<br />
«Metabolismus» bei Arzneimitteln den Begriff «Biotransformation» einzusetzen und<br />
den Ausdruck «Metabolismus» für Stoffwechselvorgänge zu reservieren, die mit der<br />
Ernährung zu tun haben. Die Leber ist das zentrale Organ für die Biotransformation<br />
von Arzneimitteln. Man unterscheidet zwei Phasen: in der Phase I finden<br />
Veränderungen (Oxidation, Reduktion, Hydrolyse) statt, die funktionelle Gruppen am<br />
Arzneimittelmolekül freilegen. Diese Biotransformations-Produkte - Metaboliten -<br />
sind meistens weniger aktiv oder ganz inaktiv, können aber auch aktiver als die<br />
Ausgangssubstanz sein. In der Phase II werden Konjugate (z.B. mit Glukuronsäure)<br />
gebildet, die in der Regel inaktiv sind und gut ausgeschieden werden können.<br />
• Bioverfügbarkeit, Biologische Verfügbarkeit, systemische Verfügbarkeit<br />
(bioavailability) Die Bioverfügbarkeit entspricht dem Prozentsatz einer extravaskulär<br />
(z.B. oral) verabreichten Dosis, der den Systemkreislauf erreicht. Die Bestimmung<br />
dieser Grösse erfolgt (soweit möglich) durch den Vergleich mit der gleichen, aber<br />
intravenös verabreichten Dosis. Verglichen wird die Fläche unter der<br />
Konzentrations-Zeit-Kurve. Werden zwei nicht intravenös verabreichte Präparate<br />
(Standard und Test) miteinander verglichen, so bestimmt man die relative<br />
Bioverfügbarkeit des Testpräparates.<br />
• Blut-Hirn-Schranke (blood-brain barrier): Die Zellen und Flüssigkeits-(Liquor)räume<br />
des Zentralnervensystems werden vom Blutraum durch eine "Barriere" getrennt.<br />
Diese Schranke wird durch eine besondere Beschaffenheit und Funktionsweise der<br />
Kapillaren gebildet. Diese besitzen nur wenige oder gar keine Poren, welche den<br />
Durchtritt wasserlöslicher Stoffe erlauben. Stark ionisierte und polare Stoffe (Säuren,<br />
quaternäre Ammoniumverbindungen) können somit keine oder nur geringe Wirkung<br />
am Zentralnervensystem entfalten und sind, falls es sich um Gifte handelt, vergleichsweise<br />
wenig toxisch. Ionisierungsgrad und Lipidlöslichkeit des Moleküls<br />
spielen dabei eine wichtige Rolle. Die Blut-Hirn-Schranke ist aber nicht<br />
unüberwindlich. Bei Überdosierung und entzündlichen Veränderungen der Meningen<br />
können auch Medikamente in den Liquor penetrieren, die dies normalerweise nicht<br />
tun.<br />
• brandfördernd : Brandfördernde Stoffe können brennbare Stoffe entzünden oder<br />
ausgebrochene Brände fördern und somit die Brandbekämpfung<br />
erschweren.<br />
• Breite, therapeutische: Mass für die Gefährlichkeit eines Arzneimittels. Gibt an, wie<br />
gross der Sicherheitsabstand zwischen der (erwünschten) pharmakologischen und<br />
der (unerwünschten) eigentoxischen Wirkung ist. Häufig definiert als Quotient<br />
zwischen mittlerer tödlicher und mittlerer wirksamer Dosis LD(50)/ED(50). Je<br />
grösser die therapeutische Breite, desto sicherer das Medikament: kleine therapeutische<br />
Breite: 2-4, mittlere: 4-10, grosse über 10.<br />
• carcinogen: Krebserzeugend auch kanzerogen oder cancerogen<br />
• chronische Toxizität: Ab 6 Monaten (6, 12, 18, 24 Monate). Tägliche<br />
Verabreichung. Meist 3 verschiedene Dosierungen. Eine Dosis sollte eindeutig<br />
Schadwirkung zeigen. Eine Dosis sollte bei Medikamenten der therapeutischen<br />
Chemie Bützer
116<br />
Dosis entsprechen. Eine Dosis sollte dazwischen liegen. In der Regel Tiere zweier<br />
verschiedener Spezies.<br />
• dermal: Aufnahme über die Haut (Salben, Gele, Sprays..).<br />
• Distribution: Verteilung<br />
• Dosen : LD(50) halbletale Dosis, die Hälfte der Versuchstiere sterben. LD(75) FD:<br />
fatal dose für Gifte. LD(99) die sicher tödliche Dosis. ED(50) (Dosis effectiva)<br />
Standard-Dosis für Effekt, Wirkung (erwünscht), WD(50) (Wirkungsdosis 50). Toleranzdosis:<br />
höchstzulässige Dosis.<br />
• Droge: Bezeichnung für Wirksubstanzen mit therapiewidrigen Eigenschaften �<br />
Suchtmittel.<br />
• <strong>Effekte</strong> : absolut : Mass für die kausal beobachtbare, spezifische Wirkung. relativ :<br />
Mass für die kausal beobachtbare, spezifische Wirkung bezogen auf die maximal<br />
mögliche Wirkung.<br />
• Emission : Ausstoss von Schadstoffen an der Quelle.<br />
• ED(50) : Effekt-Dosis für 50% Wirkung, z.B. bei Medikamenten oder 50% nichtletale<br />
Wirkung bei Giften.<br />
• Elimination: Entfernung von <strong>Wirkstoffe</strong>n durch Metabolisierung zu inaktiven Stoffen<br />
und/oder Ausscheidung.<br />
• enteral: (von griech.: enteron = Darm). Bezeichnung für eine Applikationsform von<br />
Nährstoffen und Medikamenten durch Magen und Darm; Gegensatz dazu:<br />
parenteral, d.h. unter Umgehung von Magen und Darm.<br />
• Erzeugnisse: Für bestimmte Verwendungen zusammengesetzte oder veränderte<br />
Naturstoffe oder in bestimmte Form gebrachte Stoffe.<br />
• explosiv : Dieses Symbol kennzeichnet Stoffe, die unter bestimmten Bedingungen<br />
•<br />
explodieren können.<br />
Exposition: Kurz- oder langfristiger Kontakt mit einem Wirkstoff oder einer<br />
Einwirkung.<br />
• First-Pass-Effekt: Elimination einer Substanz aus dem Pfortaderblut beim ersten<br />
Durchgang durch die Leber - oder Elimination durch die Mucosa im Darm.<br />
• Flammpunkt: Die niedrigste Temperatur (bezogen auf einen Druck von 1013 mbar),<br />
bei der sich in einem geschlossenen oder offenen tigel aus der Flüssigkeit Dämpfe<br />
in solchen Mengen entwickeln, dass sich im Tigel ein durch Fremdzündung<br />
entflammbares Dampf-Luft-Gemisch bildet.<br />
• Flash: das blitzartige Aufleuchten als visuelle eventuell komplexe Illusion nach<br />
Einnahme einer � Droge.<br />
• Flashback: Plötzliches, überraschendes, unerwartetes Auftreten eines � Flash<br />
lange nachdem die unmittelbare Wirkung abgeklungen ist.<br />
• Gefahrenbezeichnungen<br />
Gefahrenbezeichnung<br />
Gefahrensymbol<br />
sehr giftig giftig gesundheitsschädlich<br />
Verschlucken (R-Satz) 28 25 22<br />
LD(50) (Ratte oral)<br />
[mg/kg]<br />
≤25 >25–200 >200–2000<br />
krit. Dosis (Ratte oral),<br />
100% Überlebensrate,<br />
jedoch offensichtliche<br />
– 5 50<br />
Chemie Bützer
Vergiftungserscheinungen<br />
[mg/kg]<br />
LD(50) (Ratte oral),<br />
nach der Fest-Dosis-<br />
Methode<br />
[mg/kg]<br />
Berührung mit der Haut<br />
(R-Satz)<br />
LD(50) (Ratte oder<br />
Kaninchen dermal)<br />
[mg/kg]<br />
Chemie Bützer<br />
117<br />
– – 500<br />
27 24 21<br />
≤50 >50–400 >400–2000<br />
Einatmen (R-Satz) 26 23 20<br />
LC(50) (Ratte inhalativ)<br />
für Aerosole od. Stäube<br />
[mg/L/4 h]<br />
LC(50) (Ratte inhalativ)<br />
für Gase oder Dämpfe<br />
[mg/L/4 h]<br />
sonstige Gefahren<br />
(R-Sätze)<br />
≤0,25 >0,25–1 >1–5<br />
≤0,5 >0,5–2 >2–20<br />
39<br />
ernste Gefahr<br />
irreversiblen<br />
Schadens<br />
39<br />
ernste Gefahr<br />
irreversiblen<br />
Schadens<br />
48<br />
Gefahr ernster<br />
Gesundheits-<br />
schäden bei<br />
längerer<br />
Exposition<br />
40<br />
irreversibler<br />
Schaden<br />
möglich<br />
48<br />
Gefahr ernster<br />
Gesundheitsschäden<br />
bei längerer Exposition<br />
Weitere Gefahrensymbole:<br />
Xi reizend; führen bei Berührung mit Haut oder Augen zu Entzündungen und reizen die<br />
Atemwege.<br />
C ätzend: zerstören Haut- und Körpergewebe, irreparable Augenschäden sind möglich.<br />
• Gewerbliche Stoffe: Stoffe und Erzeugnisse, die für den gewerblichen oder<br />
industriellen Gebrauch angepriesen werden.<br />
• Gewohnheitsbildung ist die psychische, nicht zwanghafte Neigung eine � Droge<br />
einzunehmen, und beinhaltet normalerweise keine Tendenz zur fortschreitenden<br />
Dosissteigerung (� Toleranz). Körperliche Entzugssymptome finden sich meist<br />
nicht.<br />
• Gewöhnung: gesteigerte � Toleranz gegenüber der � Droge. Bei vielen Drogen<br />
kommt es zu einer fortschreitenden (progredienten) Unempfindlichkeit<br />
(Toleranzsteigerung) des Körpers, wodurch im Verlauf zur Erzielung desselben<br />
Effekts die Dosis zunehmend gesteigert werden muss.<br />
• Gifte: Stoffe, die im lebenden Organismus schon in verhältnismässig kleinen<br />
Mengen Funktionsstörungen hervorrufen.<br />
• Grundstoffe (unveränderte Naturstoffe, chemisch einheitliche Stoffe) oder einfache,<br />
technische Stoffgemische, die nicht im Hinblick auf bestimmte Verwendungen<br />
zusammengesetzt wurden.
118<br />
• hochentzündlich : Flüssigkeiten mit einem Flammpunkt unter 0°C.<br />
• Hormesis (griechisch: "Anregung, Anstoss", englisch: Adaptive Response) wird das<br />
Phänomen genannt, dass vernünftig kleine Dosen 81 von <strong>Wirkstoffe</strong>n den<br />
umgekehrten oder einen anderen Effekt als grossen Dosen zeigen. Dieses<br />
Verhalten kann mit den üblichen monotonen 82 Dosis-Wirkungs-Kurven 83 nicht<br />
dargestellt werden.<br />
• Idiosynkrasie: (griech.: idios = eigentümlich, synkrasis = Vermischung).<br />
Bezeichnung für eine angeborene abnorme Überempfindlichkeit gegenüber<br />
bestimmten Stoffen (Allergie).<br />
• Immission: Substanzen am Ort ihres Einwirkens auf Mensch, Tier, Pflanze, Böden<br />
und Sachgüter.<br />
• Induktionszeit: Zeit bis Symptome oder <strong>Effekte</strong> ausgelöst werden (=Latenzzeit).<br />
• Inhalation: Aufnahme durch die Atemorgane, über die Lunge (inhalativ).<br />
• Inhibition: Von lateinisch: inhibere = anhalten, hindern abgeleitet, in Wissenschaft<br />
und Technik Bezeichnung für die Hemmung oder vollständige Unterbindung der<br />
verschiedenartigsten Vorgänge.<br />
• irreversibel : nicht umkehrbar<br />
• Kd: Dissoziationskonstante; Reziprokwert der chem. Gleichgewichtskonstante K<br />
• Kompartiment (compartment): Abgeschlossener (theoretischer)Teil für das<br />
betrachtete System, bei <strong>Wirkstoffe</strong>n Teil des gesamten Verteilungsraumes, z.B. der<br />
Magen, Darm, Blut etc.<br />
• kompetitiv: konkurrierend z.B. mit der körpereigenen Substanz<br />
• Kumulation (accumulation), kumulative Wirkung: Anhäufung, Anreicherung.<br />
Substanzkumulation, wenn dem Organismus mehr zugeführt wird, als er eliminieren<br />
kann, d.h. wenn sich ein Stoff bei täglicher einmaliger Zufuhr nichttoxischer Dosen<br />
anreichert (z.B. Blei, Quecksilber, Cadmium usw.). Vergiftungsgefahr, sobald im<br />
Körper eine toxische Konzentration erreicht wird, oder ein rascher Abbau erfolgt<br />
(z.B. Fettabbau und DDT). Von der Substanzkumulation ist die Wirkkumulation zu<br />
unterscheiden, bei welcher der Wirkstoff eliminiert wird, aber die ausgelösten<br />
Veränderungen bestehen bleiben und bei jeder Zufuhr ausgeprägter werden (z.B.<br />
carcinogene Stoffe, Cholinesterasehemmer usw.). Wird ein Medikament erneut<br />
verabreicht, bevor die vorherige Dosis vollständig eliminiert ist, so kommt es zur<br />
Kumulation, d.h. zu einer Zunahme der im Körper vorhandenen Substanzmenge, bis<br />
nach einer gewissen Zeit ein Gleichgewicht zwischen Zufuhr und Elimination erreicht<br />
wird. Die Zeit bis zum Gleichgewicht hängt von Plasmahalbwertszeit des<br />
Medikamentes ab. Siehe: Fliessgleichgewicht. Die Höhe der Plasmakonzentration<br />
im Fliessgleichgewicht (durchschnittlicher «steady-state»-Spiegel) ist parallel zum<br />
Quotienten aus Dosisintervall und Plasmahalbwertszeit.<br />
• Kurzzeitgrenzwerte: Die maximale Arbeitsplatzkonzentrationswerte sind 8-<br />
Stunden-Mittelwerte. In der Praxis schwankt jedoch die aktuelle Konzentration der<br />
Stoffe in der Atemluft häufig in erheblichem Ausmass. Die Überschreitung des<br />
Mittelwertes bedarf bei vielen Stoffen der Begrenzung, um Gesundheitsschäden zu<br />
verhüten. Basierend auf toxikologischen und arbeitshygienischen Kriterien werden<br />
kurzzeitige Abweichungen der aktuell gemessenen Raumluftkonzentration über den<br />
publizierten auf die Arbeitsschicht bezogenen Grenzwert des Arbeitsstoffes<br />
hinsichtlich Höhe, Dauer und Häufigkeit pro Arbeitstag oder Schicht begrenzt. Die<br />
81 Die Homöopathie verwendet „Giftstoffe“ in extrem verdünnter Form als Heilmittel gegen Krankheiten.<br />
Dies ist im hormetischen Sinn nicht interpretierbar und eher einer Placebowirkung zuzuschreiben.<br />
82 Die üblichen Dosis-Wirkungskurven sind als stetig steigende Kurven, monotone Kurven, entweder<br />
linear oder S-förmig ansteigend (sigmoid).<br />
83 Reichl F.X., Taschenatlas der Toxikologie, Georg Thieme Verlag Stuttgart/New York, 1997, S.8,9<br />
Chemie Bützer
Chemie Bützer<br />
119<br />
Liste der MAK-Werte enthält in der besonderen Kolonne „Kurzzeitgrenzwerte“ die<br />
jeweiligen so errechneten Grenzwerte. Der 8-Stunden-Mittelwert ist in jedem Falle<br />
einzuhalten. Bei starken Reizstoffen kann durch kurzzeitige Konzentrationsspitzen<br />
die Wirkungsschwelle überschritten werden.<br />
• Latenzzeit: Der Zeitraum zwischen Giftzufuhr und feststellbarer Wirkung (=<br />
Induktionszeit).<br />
• LC (letal concentration) die für Menschen innerhalb einer beliebigen Expositionszeit,<br />
für Tiere innerhalb längstens 8 Stunden tödlich wirkende Konzentration.<br />
• LC(50) - Wert für die akute Giftigkeit beim Einatmen. Diejenige Konzentration von<br />
Dampf, Nebel oder Staub, die bei kontinuierlichem Einatmen während einer Stunde<br />
durch eine Gruppe von jungen, weissen, erwachsenen, männlichen und weiblichen<br />
Ratten mit einer Lebendmasse von 200 bis 300 Gramm mit der grössten<br />
Erfolgsaussicht den Tod der Hälfte der Tiergruppe innerhalb von 14 Tagen<br />
herbeiführt. Wenn der Stoff den Tieren in Form von Staub oder Nebel verabreicht<br />
wird, müssen mehr als 90% der Partikel, denen die Tiere ausgesetzt sind, einen<br />
Durchmesser von 10 μm oder weniger aufweisen, vorausgesetzt, dass es nicht<br />
unwahrscheinlich ist, dass ein Mensch während der Beförderung einer solchen<br />
ausgesetzt sein kann. Das Ergebnis wird in mg je Liter Luft für den Staub und Nebel<br />
und in ml je m 3 Luft (ppm) für den Dampf ausgedrückt. Die Kriterien für die Giftigkeit<br />
beim Einatmen von Stäuben oder Nebeln beruhen auf LC(50)-Werten, bei einer<br />
Versuchsdauer von einer Stunde, und wenn solche Daten vorhanden sind, müssen<br />
sie auch verwendet werden. Wenn jedoch nur LC(50)-Werte bei einer<br />
Versuchsdauer von 4 Stunden erhältlich sind, können diese auch verwendet<br />
werden. Sie können mit 4 multipliziert werden und das Resultat kann dann mit den in<br />
der Tabelle angegebenen Werten verglichen werden. Mit anderen Worten: LC(50)<br />
(Versuchsdauer 4 Stunden) x 4 wird als äquivalent angesehen einer LC(50)<br />
(Versuchsdauer 1 Std.)<br />
• LD = Letaldosis - Diejenige Dosis einer Substanz, die zum Tode des Individiums<br />
führt.<br />
• LD(50) - Die im Tierversuch einmalig verabreichte Dosis (akute Toxizität), die bei<br />
der Hälfte der Tiere den Tod innerhalb 5 Tagen verursacht. Die LD(50) ist abhängig<br />
von der Art der Verabreichung der Testsubstanz und der Tierart. z.B. LD(50) oral<br />
(Aufnahme via Mund), z.B. Ratte; LD(50) intravenös (Injektion in Vene), z.B. Hund;<br />
LD(50) intraperitoneal (Injektion in Bauchhöhle; LD(50) dermal (Aufnahme via Haut).<br />
• leichtentzündlich : Stoffe, die sich bei gewöhnlicher Temperatur an der Luft ohne<br />
Energiezufuhr erhitzen und schliesslich entzünden können, oder die durch<br />
kurzzeitige Einwirkung einer Zündquelle leicht entzündet werden können und nach<br />
deren Entfernung weiterbrennen oder weiterglimmen; – flüssige Stoffe, die einen<br />
Flammpunkt unter 21° C haben, aber nicht hochentzündlich sind; – Gase bzw.<br />
verflüssigte Gase, die bei Normaldruck mit Luft einen Zündbereich haben; – Stoffe,<br />
die bei Berührung mit Wasser oder mit feuchter Luft leicht entzündliche Gase in<br />
gefährlicher Menge (mindestens 1 L pro kg und h) entwickeln.<br />
• letal : tödlich<br />
• limbisches System: Einige Teile von Thalamus, Hypothalamus, Hippocampus,<br />
Mandelkern, Schweifkern, Septum cervicale und Mittelhirn bilden zusammen eine<br />
Funktionseinheit des Gehirns, die man als limbisches System bezeichnet. Diese<br />
Strukturen sind in besonderer Weise über Nervenfasern verknüpft und steuern viele<br />
Aspekte des Verhaltens, so z. B. Gefühlsausdruck, epileptische Anfälle sowie die<br />
Speicherung und den Abruf von Erinnerungen.<br />
• Lineare Kinetik, Kinetik erster Ordnung (linear kinetics, first order kinetics).<br />
Verschiedene kinetische Vorgänge imitieren monomolekulare Reaktionen, die<br />
gemäss dem Massenwirkungsgesetz proportional der Konzentration des
Chemie Bützer<br />
120<br />
Ausgangsmoleküls verlaufen. Eine lineare Eliminationskinetik ist vorhanden, wenn<br />
die Geschwindigkeit der Konzentrationsänderung direkt proportional der<br />
Konzentration des noch unveränderten Arzneimittels ist. Substanzen, deren<br />
Elimination so erfolgt, haben eine «Halbwertszeit».<br />
• LOAEL: Lowest observed adverse effect level. Die niedrigste Dosis eines<br />
verabreichten chemischen Stoffes, bei der eine toxische Wirkung im Tierexperiment<br />
nachgewiesen wurde.<br />
• Lungenödem: Eine akute oder chronische Durchtränkung der Lunge mit einem<br />
Luftbläschen-durchsetzten, zunächst zellfreien, wässrigen, später Leuko- und<br />
Erythrozyten und Alveolardeckzellen enthaltenden gallertartigen Transsudat in<br />
Alveolarräumen, kleinen Bronchien und im Interstitium. Symptome: Unruhe,<br />
Angstgefühl, Zyanose, feuchte Rasselgeräusche mit Trachealrasseln (»Kochen auf<br />
der Brust«), dünnflüssiger, blutig-schaumiger Auswurf.<br />
• MAC: Abkürzung für: Minimale Alveoläre Concentration, die alveoläre Konzentration<br />
eines Inhalationsnarkotikums, bei der 50% aller Patienten auf den chirurgischen<br />
Hautschnitt nicht mehr mit einer Abwehrbewegung reagieren. Die MAC ist ein<br />
direktes Mass für die Wirkungsstärke eines Anästhetikums. Sie wird in Prozent einer<br />
Atmosphäre angegeben, wobei sie je nach Kombination mit der O2-Konzentration<br />
schwankt. Englisch: MAC (minimal alveolar concentration).<br />
AC-Werte von Inhalationsanästhetika in absteigender Wirkungsstärke:<br />
MAC-Werte (% atm)<br />
Inhalationsanästhetikum<br />
100% O2 mit 70% N2O<br />
Methoxyfluran (H3C-O-CF2-CHCl2) 0,16 0,07<br />
Halothan (F3C-CHBrCl) 0,75 0,29<br />
Isofluran (CF3-(CHCl)-OCHF2) 1,15 0,50<br />
Enfluran (CF3-O-CF2-CHClF) 1,68 0,57<br />
N20 110 -<br />
• MAK: maximale Arbeitsplatzkonzentration. Der Maximale Arbeitskonzentrationswert<br />
(MAK-Wert) ist diejenige Durchschnittskonzentration eines gas-, dampf- oder<br />
staubförmigen Arbeitsstoffes in der Luft, die nach derzeitiger Kenntnis in der Regel<br />
bei Einwirkung während der Arbeitszeit von 8 Stunden täglich und bis 42 Stunden<br />
pro Woche auch über längere Perioden bei der ganz stark überwiegenden Zahl der<br />
gesunden, am Arbeitsplatz Beschäftigten die Gesundheit nicht gefährdet. Besonders<br />
empfindliche oder in ihrer Gesundheit beeinträchtigte Personen können auch durch<br />
tiefere Konzentrationen gefährdet werden. MAK ppm = MAK ml/m 3 = 24.06 x MAK<br />
mg/m 3 / Molmasse MAK mg/m 3 = MAK ppm x Molmasse / 24.06. 24.06 l =<br />
Molvolumen bei 20°C (293 K) und 760 Torr (1013.25 mbar, 101'325 Pa). Dem MAK-<br />
Wert im geschlossenen Raum steht der MIK-Wert im Freien gegenüber.<br />
� Mediator: Second messenger (zweiter Bote) sind intrazelluläre Botensubstanzen,<br />
die nach Bindung eines extrazellulären Botenstoffs (Neurotransmitter, Hormon oder<br />
Wachstumsfaktor – „erster Bote“) an einen Rezeptor der Zellmembran oder nach<br />
Aktivierung desselben durch Licht usw. eine Konzentrations-Änderung erfährt und<br />
dadurch spezifische Reaktionen auslöst (z. B. Abbau von Glykogen, Sekretion von<br />
Hormonen, Hyperpolarisierung der Zellmembran). Damit dient der second<br />
messenger der Weiterleitung eines externen chemischen/physikalischen Signals<br />
innerhalb der Zelle. Beispiele sind: Adenosin-3',5'-monophosphat (cAMP),<br />
Arachidonsäure, Calcium-Ionen, Diacylglycerine, Guanosin-3',5'-monophosphat, Dmyo-Inosit-1,4,5-trisphosphat<br />
(IP3), Jasmonsäure und andere.<br />
• MEK: maximale Emmissionskonzentration.<br />
• Metabolismus: Stoffwechsel
Chemie Bützer<br />
121<br />
• MIK: maximale Immissionskonzentration; MIK-Wert (Maximale Immissions-<br />
Konzentration) Die maximale Immissions-Konzentration ist diejenige Konzentration<br />
eines luftverunreinigenden Stoffes, die bodennah im Freien ausserhalb der<br />
Emissionsquelle für Mensch und Tier oder Pflanze bei dauernder Einwirkung als<br />
unbedenklich ist. Bei Stäuben wird der MIK-Wert als Niederschlag in g/m 2 pro Tag<br />
angegeben (Erste Näherung: MIK ≈ MAK/20)<br />
• MLD (minimal letal dose; daneben auch D.I.m.: Dosis letalis minima) kleinste zum<br />
Tod eines Versuchstieres oder Menschen minimale letale Dosis führende Dosis,<br />
meist in mg/kg Körpergewicht<br />
• MOK: maximale Organkonzentration (wichtig bei Akkumulation)<br />
• Morbidität: Erkrankungshäufigkeit<br />
• Mortalität: Sterblichkeit<br />
• Mutagenität - Toxische Wirkung besteht in der Veränderung der Erbsubstanz, die<br />
eine Schädigung des Organismus oder, wenn Keimzellen (Eizellen und<br />
Samenzellen) betroffen werden, eine Schädigung der Nachkommen zur Folge<br />
haben kann (mutagen).<br />
• NEL: No Effect Level. Die höchste im chronischen Tierversuch, beim<br />
empfindlichsten Versuchstier geprüfte Dosierung einer Substanz, die keinen<br />
schädlichen Effekt zeigt � neu NOAEL (Deutsch: Schwellenkonzentration).<br />
• NOAEL : „No Observed Adverse Effect Level“ (früher NEL), die höchste im<br />
chronischen Tierversuch, beim empfindlichsten Versuchstier geprüfte Dosierung<br />
einer Substanz, die keinen schädlichen Effekt zeigt. Der NOAEL dient in der<br />
Rückstandstoxikologie als Richtwert für die Festlegung von duldbaren<br />
Giftexpositionen des Menschen, dem so genannten "Admissible Daily Intake" (ADI).<br />
(Deutsch: Schwellenkonzentration).<br />
• Neurotransmitter sind Überträgersubstanzen (Botenstoffe), die auf chemischem<br />
Wege an den � Synapsen oder den motorischen Endplatten Nervenimpulse<br />
übertragen.<br />
• Nicht-lineare Kinetik, Kinetik nullter Ordnung (non-linear kinetics, zero order<br />
kinetics). Bei der nicht-linearen Kinetik ist die Eliminationsgeschwindigkeit nicht<br />
proportional zur Konzentration der Ausgangssubstanz. In diesem Fall ist die<br />
Arzneimittelelimination pro Zeiteinheit konstant. Medikamente, die so ausgeschieden<br />
werden, haben keine konstante «Halbwertszeit». Dies erklärt sich durch die<br />
Sättigung der für die Elimination verantwortlichen Enzyme.<br />
• NOAEC: No Observed Adverse Effect Concentration. Die höchste im chronischen<br />
Tierversuch, beim empfindlichsten Versuchstier geprüfte Konzentration einer<br />
Substanz, die keinen schädlichen Effekt zeigt.<br />
• NOAEL : „No Observed Adverse Effect Level“ (früher NEL), die höchste im<br />
chronischen Tierversuch, beim empfindlichsten Versuchstier geprüfte Dosierung<br />
einer Substanz, die keinen schädlichen Effekt zeigt. Der NOAEL dient in der<br />
Rückstandstoxikologie als Richtwert für die Festlegung von duldbaren<br />
Giftexpositionen des Menschen, dem so genannten "Admissible Daily Intake" (ADI).<br />
(Deutsch: Schwellenkonzentration). Kann der NOAEL nicht aus Toxizitätsstudien<br />
ermittelt werden, wird die niedrigste geprüfte Konzentration/Dosis angegeben, bei<br />
der noch schädliche Wirkungen beobachtet werden (LOAEL).<br />
• NOEL : „No Observed Effect Level“ analog NOAEL<br />
• NOEC : „No Observed Effect Concentration“, Die höchste Konzentration eines<br />
Stoffes, bei welcher noch gerade kein Effekt feststellbar ist.<br />
• Noxe : Schadfaktor, physikalisch (Lärm, Vibration, Strahlung) oder chemisch.<br />
• Octanol: CH3-(CH2)7-OH, nicht wasserlöslich<br />
• Ökotoxizität: Auswirkungen von Stoffen auf die belebte Umwelt.<br />
Untersuchungsschwerpunkte sind die <strong>Effekte</strong> auf den Organisationsebenen
122<br />
Organell, Zelle, Organ, Organismus, Population und Ökosystem, soweit daraus<br />
direkte oder indirekte, reversible und irreversible Veränderungen oder Schäden<br />
entstehen.<br />
• oral: (latein.: os = Mund). Adjektiv mit der Bedeutung „zum Munde gehörig, durch<br />
den Mund“.<br />
• parenteral: (griech.: Para- = neben und entera = Eingeweide). Bei Arzneiformen<br />
und besonderen Formen der Ernährung versteht man unter parenteral – als<br />
Gegensatz zu enteral oder oral (per os) – die Einführung von systemisch wirkenden<br />
Stoffen in den Körper unter Umgehung des Magen-Darm-Trakts. Im engeren Sinne<br />
umfasst dieser Begriff nur die Injektionen und Infusionen (ausser den rektalen), nicht<br />
aber Applikationsformen wie Salben, Gele, Implantate, Membranpräparate, Aerosole<br />
und dergleichen.<br />
• Persistenz: Beständigkeit eines Stoffes gegenüber dem Abbau (im Organismus, in<br />
der Umwelt)<br />
• Pharmakologie: Wissenschaft vom Zusammenwirken zwischen chemischen<br />
Substanzen und lebendem Gewebe.<br />
• Placebo : Wirkstofffreies, äusserlich nicht vom Original unterscheidbares »Leer-«<br />
oder »Scheinmedikament« (»Falsum-Präparat«). Ein Placebo (lateinisch "ich werde<br />
gefallen") ist eine medizinische Massnahme, die per Definition nicht direkt wirken<br />
kann – beispielsweise eine Tablette oder eine Spritze ohne Wirkstoff.<br />
• Potenzierung: Eine besondere Form des Synergismus, die bei der Kombination von<br />
zwei Stoffen mit gleicher oder ähnlicher Wirkung auftreten kann. Die Wirkung der<br />
beiden Substanzen ist dann enorm viel grösser, als die Summe der beiden<br />
Wirkungen.<br />
• Proteinbindung, Eiweissbindung, Plasmaproteinbindung (protein binding) : Viele<br />
Arzneimittel werden im Blut an Plasmaproteine gebunden. Saure Moleküle werden<br />
vorwiegend an Albumine gebunden, basische Verbindungen eher an saure a1-<br />
Glykoproteine oder Lipoproteine. Verschiedene Medikamente können an<br />
Proteinbindungsstellen miteinander in Kompetition treten; das Medikament, das<br />
stärker gebunden wird, verdrängt das weniger stark gebundene aus der Bindung.<br />
Eine solche Interaktion hat komplexe Folgen: Da eine vorübergehende Zunahme der<br />
freien Arzneimittel-Fraktion meistens zu vermehrter Elimination führt, ergibt sich aus<br />
der beschriebenen Interaktion nicht notwendigerweise eine verstärkte Wirkung.<br />
• Publikumsprodukte: Stoffe, die für den Allgemeingebrauch angepriesen oder<br />
jedermann abgegeben werden können.<br />
• Radioaktivität: Eigenschaft einer Reihe von Atomkernen, sich ohne äussere<br />
Einwirkung spontan in einen anderen Atomkern umzuwandeln<br />
(Kernumwandlungen). Die dabei freiwerdende Energie wird in Form von<br />
elektromagnetischer Strahlung (γ- Strahlung) und/oder Teilchen (α-, β-, β+ oder<br />
Neutronenstrahlung) abgegeben.<br />
• reizend: Stoffe und Zubereitungen werden als reizend eingestuft, wenn sie – ohne<br />
ätzend zu sein – bei kurzzeitigem, länger andauerndem oder wiederholtem Kontakt<br />
mit Haut und/oder Schleimhäuten (Atemwege, Augen) eine Entzündung<br />
verursachen.<br />
• rektal: (latein.: rectum = Mastdarm). Adjektiv mit der Bedeutung „zum Mastdarm<br />
gehörig, durch den Mastdarm“.<br />
Chemie Bützer
Chemie Bützer<br />
123<br />
• Resorption: (von lateinisch: resorbere = aufsaugen) Aufnahme von<br />
Nahrungsmitteln, <strong>Wirkstoffe</strong>n und ähnlichen Stoffen in die Blut- und Lymphbahnen.<br />
Resorption, Absorption, Aufnahme (absorption) Die Resorption im engeren Sinn<br />
beschreibt Ausmass und Geschwindigkeit des Verschwindens eines <strong>Wirkstoffe</strong>s<br />
vom Verabreichungsort (Magen-Darm-Trakt, Muskel, Subkutis usw.). Nach dieser<br />
Definition kann ein Wirkstoff zu 100% resorbiert werden, aber z.B. dennoch nur zu<br />
50% systemisch verfügbar sein (wenn er präsystemisch metabolisiert wird). Im<br />
weiteren Sinn versteht man alle Vorgänge, die zwischen Verabreichung eines<br />
<strong>Wirkstoffe</strong>s und seiner Präsenz im systemischen Kreislauf liegen. Nach dieser<br />
Definition kann eine 80%ige Resorption z.B. einer 100%igen Resorption im engeren<br />
Sinn in Kombination mit einer präsystemischen Metabolisierung entsprechen (d.h.<br />
die Bioverfügbarkeit beträgt 80%).<br />
• Rezeptoren: zelluläre Strukturen, die als Bindungs- bzw. Reaktionsstellen für<br />
körpereigene � Neurotransmitter oder körperfremde Stoffe funktionieren und<br />
biologische Wirkungen in Gang setzen.<br />
• R-Sätze: diese geben in standardisierter Form Hinweise auf besondere Gefahren<br />
von Stoffen und Zubereitungen, die sich aus physikalisch-chemischen<br />
Eigenschaften (explosionsgefährlich; entzündlich etc.), toxischen oder gentoxischen<br />
Eigenschaften (giftig; krebserzeugend etc.) oder deren Auswirkungen auf die<br />
Umwelt (Ökotoxizität: giftig für Pflanzen; gefährlich für die Ozon-Schicht etc.)<br />
ergeben.<br />
• Schwellenkonzentration: (engl.: no observed adverse effect level, NOAEL). Die<br />
höchste im chronischen Tierversuch, beim empfindlichsten Versuchstier geprüfte<br />
Dosierung einer Substanz, die keinen schädlichen Effekt zeigte.<br />
• Smog: smoke + fog = Rauchnebel; Ansammlung von Schadstoffen in Form von<br />
feinen, dunstartigen Partikeln.<br />
• S-Sätze: Dies sind standardisierte Sicherheitsratschläge und geben Hinweise auf<br />
notwendige Vorsichtsmassnahmen bei der gebräuchlichen Handhabung und<br />
Verwendung gefährlicher Stoffe (Gefahrstoffen) und Zubereitungen.<br />
� Second messenger (zweiter Bote) sind intrazelluläre Botensubstanzen, die nach<br />
Bindung eines extrazellulären Botenstoffs (Neurotransmitter, Hormon oder<br />
Wachstumsfaktor – „erster Bote“) an einen Rezeptor der Zellmembran oder nach<br />
Aktivierung desselben durch Licht usw. eine Konzentrations-Änderung erfährt und<br />
dadurch spezifische Reaktionen auslöst (z. B. Abbau von Glykogen, Sekretion von<br />
Hormonen, Hyperpolarisierung der Zellmembran). Damit dient der<br />
second messenger der Weiterleitung eines externen chemischen/physikalischen<br />
Signals innerhalb der Zelle. Beispiele sind: Adenosin-3',5'-monophosphat (cAMP),<br />
Arachidonsäure, Calcium-Ionen, Diacylglycerine, Guanosin-3',5'-monophosphat, Dmyo-Inosit-1,4,5-trisphosphat<br />
(IP3), Jasmonsäure und andere.<br />
� Stoffe sind chemische Elemente oder chemische Verbindungen, wie sie natürlich<br />
vorkommen oder hergestellt werden, einschliesslich der zur Wahrung der Stabilität<br />
notwendigen Hilfsstoffe und der durch das Herstellungsverfahren bedingten<br />
Verunreinigungen, mit Ausnahme von Lösungsmitteln, die von dem Stoff ohne<br />
Beeinträchtigung seiner Stabilität und ohne Änderung seiner Zusammensetzung<br />
abgetrennt werden können.<br />
• subchronische Toxizität oder subakute Toxizität - Die schädliche Wirkung tritt<br />
erst nach mehrmaliger Verabreichung auf. (Subakuter Tierversuch: tägliche<br />
Verabreichung bei einer Versuchsdauer von 14 - 28 aber auch bis zu 90 Tagen).<br />
Kumulation, Toleranzentwicklung.<br />
• Sucht ist eine psychische und/oder physische Fixierung eines Menschen an eine<br />
Droge. Zwanghaftes Angewiesensein auf die Befriedigung ungeachtet des Verlusts<br />
an Selbstwert- und Umweltbezug. Typische Merkmale: übermächtiger Wunsch nach
124<br />
Beschaffung des � Suchtmittels, Tendenz zur Dosissteigerung (� Toleranz),<br />
Auftreten eines Entzugssymptoms.<br />
• Suchtmittel, ist ein psychotroper Stoff, der Euphorie und Bewusstseinsänderungen<br />
hervorruft.<br />
• SUVA : Schweizerische Unfall-Versicherungs-Anstalt<br />
• Synapse: Kontaktstelle zwischen Nervenzellen bzw. Nervenzellen und dem<br />
Plasmalemma anderer Zellen (Sinnes-, Epithel-, Muskelzellen). Die<br />
Nervenreizleitung findet an diesen Stellen stets nur in einer Richtung statt. Die �<br />
Neurotransmitter übertragen die Nervenimpulse bei den Synapsen.<br />
• Synergismus: Prinzip, bei dem eine Struktur oder eine Substanz eine andere in<br />
ihrer Wirkung unterstützt oder verstärkt. Die Gesamtwirkung übertrifft dabei die<br />
Summe der Einzelwirkungen.<br />
• TC (toxic concentration) bei Gasen diejenige Konzentration, bei welcher für den<br />
Menschen irgend eine toxische Wirkung oder für Versuchstiere karzinogene,<br />
teratogene oder mutagene <strong>Effekte</strong> nachweisbar sind.<br />
• TD(50) (toxische Dosis 50) Dosis für das Auftreten von Vergiftungssymptomen bei<br />
50% der Versuchsindividuen.<br />
• Teratogenität - Die toxische Wirkung besteht in der Erzeugung von Missbildungen<br />
bei einem Embryo durch die Behandlung der Mutter mit der toxischen Substanz<br />
während der Schwangerschaft.<br />
• TLV: Threshold Limit Value: entspricht dem MAK-Wert.<br />
• Toleranz: Wirkungsabfall einer wiederholt eingenommenen Substanz durch<br />
Anpassung des Organismus.<br />
• Toxikologie: Wissenschaft von den Giften und ihren Wirkungen. Die Toxikologie<br />
befasst sich mit den physikalischen und chemischen Eigenschaften aller bekannten<br />
Giftstoffe sowie mit Methoden zu ihrem Nachweis, mit ihrer Wirkung auf den<br />
Organismus und mit den Befunden, die man bei der Obduktion eines Vergifteten<br />
erhält.<br />
• Toxizität: Aus dem griechischen abgeleitete Bezeichnung für Giftigkeit. Man<br />
unterscheidet akute Toxizität: Giftigkeit bei einmaligem bzw. kurzfristigem zeitlich<br />
eng begrenztem Kontakt mit einem Giftstoff, subakute bzw. subchronische Toxizität:<br />
Bei wiederholter, meist 28 bzw. 90 d dauernder Belastung und chronischer Toxizität:<br />
Bei Belastung über einen längeren Zeitraum (bis zu mehreren Jahren), der beim<br />
Versuchstier grösser ist als die halbe durchschnittliche Lebenserwartung. Die<br />
Prüfung auf fruchtschädigende Wirkung ist gleichzeitig ein Test auf gentoxische oder<br />
teratogene Wirkung.<br />
• Transmission: Ausbreitung und Transport von Schadstoffen durch Luft oder<br />
Wasser.<br />
• umweltschädigend/umweltgefährdend: Umweltgefährlich sind Stoffe oder<br />
Zubereitungen, die selbst oder deren Umwandlungsprodukte geeignet sind, die<br />
Beschaffenheit des Naturhaushaltes, von Wasser, Boden oder Luft, Klima, Tieren,<br />
Pflanzen oder Mikroorganismen derart zu verändern, dass dadurch sofort oder<br />
später Gefahren für die Umwelt herbeigeführt werden können.<br />
• Wirkung: die durch ein Wirkstoff ausgelösten Veränderungen eines biologischen<br />
Systems; quantitativ: Dosisabhängigkeit, qualitativ: Strukturabhängigkeit.<br />
• Wirkstoff: Chemische Substanz welche in einem lebenden Organismus eine<br />
biologische Wirkung hervorruft, die sich als qualitative und quantitative<br />
Veränderungen zu erkennen geben.<br />
• Zubereitungen sind Gemenge, Gemische und Lösungen, die aus zwei oder<br />
mehreren Stoffen bestehen.<br />
Chemie Bützer
Chemie Bützer<br />
125
126<br />
12 Risiko-, Sicherheits-, Entsorgungs-Sätze<br />
12.1 R-Sätze<br />
1 Im trockenem Zustand explosionsgefährlich.<br />
2 Durch Schlag, Reibung, Feuer oder andere Zündquellen explosionsgefährlich.<br />
3 Durch Schlag, Reibung, Feuer oder andere Zündquellen besonders explosionsgefährlich.<br />
4 Bildet hochempfindliche explosionsgefährliche Metallverbindungen.<br />
5 Beim Erwärmen explosionsfähig.<br />
6 Mit und ohne Luft explosionsfähig.<br />
7 Kann Brand verursachen.<br />
8 Feuergefahr bei Berührung mit brennbaren Stoffen.<br />
9 Explosionsgefahr bei Mischung mit brennbaren Stoffen.<br />
10 Entzündlich.<br />
11 Leichtentzündlich.<br />
12 Hochentzündlich.<br />
13 (veraltet) Hochentzündliches Flüssiggas.<br />
14 Reagiert heftig mit Wasser.<br />
15 Reagiert mit Wasser unter Bildung hochentzündlicher Gase.<br />
16 Explosionsgefährlich in Mischung mit brandfördernden Stoffen.<br />
17 Selbstentzündlich an der Luft.<br />
18 Bei Gebrauch Bildung explosionsfähiger/leichtentzündlicher Dampf-Luft-Gemische möglich.<br />
19 Kann explosionsfähige Peroxide bilden.<br />
20 Gesundheitsschädlich beim Einatmen.<br />
21 Gesundheitsschädlich bei Berührung mit der Haut.<br />
22 Gesundheitsschädlich beim Verschlucken.<br />
23 Giftig beim Einatmen.<br />
24 Giftig bei Berührung mit der Haut.<br />
25 Giftig beim Verschlucken.<br />
26 Sehr giftig beim Einatmen.<br />
27 Sehr giftig bei Berührung mit der Haut.<br />
28 Sehr giftig beim Verschlucken.<br />
29 Entwickelt bei Berührung mit Wasser giftige Gase.<br />
30 Kann bei Gebrauch leicht entzündlich werden.<br />
31 Entwickelt bei Berührung mit Säure giftige Gase.<br />
32 Entwickelt bei Berührung mit Säure sehr giftige Gase.<br />
33 Gefahr kumulativer Wirkungen.<br />
34 Verursacht Verätzungen.<br />
35 Verursacht schwere Verätzungen.<br />
36 Reizt die Augen.<br />
37 Reizt die Atmungsorgane.<br />
38 Reizt die Haut.<br />
39 Ernste Gefahr irreversiblen Schadens.<br />
40 Irreversibler Schaden möglich.<br />
41 Gefahr ernster Augenschäden.<br />
42 Sensibilisierung durch Einatmen möglich.<br />
43 Sensibilisierung durch Hautkontakt möglich.<br />
44 Explosionsgefahr bei Erhitzen unter Einschluss.<br />
45 Kann Krebs erzeugen.<br />
46 Kann vererbbare Schäden verursachen.<br />
47 (veraltet) Kann Missbildungen verursachen.<br />
48 Gefahr ernster Gesundheitsschäden bei längerer Exposition.<br />
49 Kann Krebs erzeugen beim Einatmen.<br />
50 Sehr giftig für Wasserorganismen.<br />
51 Giftig für Wasserorganismen.<br />
52 Schädlich für Wasserorganismen.<br />
53 Kann in Gewässer längerfristig schädliche Wirkung haben.<br />
54 Giftig für Pflanzen.<br />
55 Giftig für Tiere.<br />
56 Giftig für Bodenorganismen.<br />
57 Giftig für Bienen.<br />
Chemie Bützer
Chemie Bützer<br />
127<br />
58 Kann längerfristig schädliche Wirkung auf die Umwelt haben.<br />
59 Gefährlich für die Ozonschicht.<br />
60 Kann die Fortpflanzungsfähigkeit beeinträchtigen.<br />
61 Kann das Kind im Mutterleib schädigen.<br />
62 Kann möglicherweise die Fortpflanzungsfähigkeit beeinträchtigen.<br />
63 Kann das Kind im Mutterleib möglicherweise schädigen.<br />
64 Kann Säuglinge über die Muttermilch schädigen.<br />
Kombinationen der R-Sätze<br />
14/15 Reagiert heftig mit Wasser unter Bildung hochentzündlicher Gase.<br />
15/29 Reagiert mit Wasser unter Bildung giftiger und hochentzündlicher Gase.<br />
20/21 Gesundheitsschädlich beim Einatmen und bei Berührung mit der Haut.<br />
20/21/22 Gesundheitsschädlich beim Einatmen, Verschlucken und bei Berührung mit der Haut.<br />
20/22 Gesundheitsschädlich beim Einatmen und Verschlucken.<br />
21/22 Gesundheitsschädlich bei Berührung mit der Haut und beim Verschlucken.<br />
23/24 Giftig beim Einatmen und bei Berührung mit der Haut.<br />
23/24/25 Giftig beim Einatmen, Verschlucken und bei Berührung mit der Haut.<br />
23/25 Giftig beim Einatmen und Verschlucken.<br />
24/25 Giftig bei Berührung mit der Haut und beim Verschlucken.<br />
26/27 Sehr giftig beim Einatmen und bei Berührung der Haut.<br />
26/27/28 Sehr giftig beim Einatmen, Verschlucken und Berührung mit der Haut.<br />
26/28 Sehr giftig beim Einatmen und Verschlucken.<br />
27/28 Sehr giftig bei Berührung mit der Haut und beim Verschlucken.<br />
36/37 Reizt die Augen und die Atmungsorgane.<br />
36/37/38 Reizt die Augen, Atmungsorgane und die Haut.<br />
36/38 Reizt die Augen und die Haut.<br />
37/38 Reizt die Atmungsorgane und die Haut.<br />
39/23 Giftig: ernste Gefahr irreversiblen Schadens durch Einatmen.<br />
39/23/24 Giftig: ernste Gefahr irreversiblen Schadens durch Einatmen und bei Berührung mit der<br />
Haut.<br />
39/23/24/25 Giftig: ernste Gefahr irreversiblen Schadens durch Einatmen, Berührung mit der Haut und<br />
durch Verschlucken.<br />
39/23/25 Giftig: ernste Gefahr irreversiblen Schadens durch Einatmen und durch Verschlucken.<br />
39/24 Giftig: ernste Gefahr irreversiblen Schadens bei Berührung mit der Haut.<br />
39/24/25 Giftig: ernste Gefahr irreversiblen Schadens bei Berührung mit der Haut und durch<br />
Verschlucken.<br />
39/25 Giftig: ernste Gefahr irreversiblen Schadens durch Verschlucken.<br />
39/26 Sehr giftig: ernste Gefahr irreversiblen Schadens durch Einatmen.<br />
39/26/27 Sehr giftig: ernste Gefahr irreversiblen Schadens durch Einatmen und bei Berührung mit der<br />
Haut.<br />
39/26/27/28 Sehr giftig: ernste Gefahr irreversiblen Schadens durch Einatmen, Berührung mit der Haut<br />
und durch Verschlucken.<br />
39/26/28 Sehr giftig: ernste Gefahr irreversiblen Schadens durch Einatmen und durch Verschlucken.<br />
39/27 Sehr giftig: ernste Gefahr irreversiblen Schadens bei Berührung mit der Haut.<br />
39/27/28 Sehr giftig: ernste Gefahr irreversiblen Schadens bei Berührung mit der Haut und durch<br />
Verschlucken.<br />
39/28 Sehr giftig: ernste Gefahr irreversiblen Schadens durch Verschlucken.<br />
40/20 Gesundheitsschädlich: Möglichkeit irreversiblen Schadens durch Einatmen.<br />
40/20/21 Gesundheitsschädlich: Möglichkeit irreversiblen Schadens durch Einatmen und bei<br />
Berührung mit der Haut.<br />
40/20/21/22 Gesundheitsschädlich: Möglichkeit irreversiblen Schadens durch Einatmen, Berührung mit<br />
der Haut und durch Verschlucken.<br />
40/20/22 Gesundheitsschädlich: Möglichkeit irreversiblen Schadens durch Einatmen und durch<br />
Verschlucken.<br />
40/21 Gesundheitsschädlich: Möglichkeit irreversiblen Schadens bei Berührung mit der Haut.<br />
40/21/22 Gesundheitsschädlich: Möglichkeit irreversiblen Schadens bei Berührung mit der Haut und<br />
durch Verschlucken.<br />
40/22 Gesundheitsschädlich: Möglichkeit irreversiblen Schadens durch Verschlucken.<br />
42/43 Sensibilisierung durch Einatmen und Hautkontakt möglich.
Chemie Bützer<br />
128<br />
48/20 Gesundheitsschädlich: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch<br />
Einatmen.<br />
48/20/21 Gesundheitsschädlich: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch<br />
Einatmen und durch Berührung mit der Haut.<br />
48/20/21/22 Gesundheitsschädlich: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch<br />
Einatmen, Berührung mit der Haut und durch Verschlucken.<br />
48/20/22 Gesundheitsschädlich: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch<br />
Einatmen und durch Verschlucken.<br />
48/21 Gesundheitsschädlich: Gefahr bei ernster Gesundheitsschäden bei längerer Exposition<br />
durch Berührung mit der Haut.<br />
48/21/22 Gesundheitsschädlich: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch<br />
Berührung mit der Haut und durch Verschlucken.<br />
48/22 Gesundheitsschädlich: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch<br />
Verschlucken.<br />
48/23 Giftig: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch Einatmen.<br />
48/23/24 Giftig: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch Einatmen und<br />
durch Berührung mit der Haut.<br />
48/23/24/25 Giftig: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch Einatmen,<br />
Berührung mit der Haut und durch Verschlucken.<br />
48/23/25 Giftig: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch Einatmen und<br />
durch Verschlucken.<br />
48/24 Giftig: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch Berührung mit der<br />
Haut.<br />
48/24/25 Giftig: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch Berührung mit der<br />
Haut und durch Verschlucken.<br />
48/25 Giftig: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch Verschlucken.<br />
50/53 Sehr giftig für Wasserorganismen, kann in Gewässern längerfristig schädliche Wirkungen<br />
haben.<br />
51/53 Giftig für Wasserorganismen, kann in Gewässern längerfristig schädliche Wirkungen haben.<br />
52/53 Schädlich für Wasserorganismen, kann in Gewässern längerfristig schädliche Wirkungen<br />
haben.
12.2 S-Sätze<br />
Chemie Bützer<br />
129<br />
1 Unter Verschluss aufbewahren.<br />
2 Darf nicht in die Hände von Kindern gelangen.<br />
3 Kühl aufbewahren.<br />
4 Von Wohnplätzen fernhalten.<br />
5 Unter ... aufbewahren (geeignete Flüssigkeit vom Hersteller anzugeben).<br />
6 Unter ... aufbewahren (inertes Gas vom Hersteller anzugeben).<br />
7 Behälter dicht geschlossen halten.<br />
8 Behälter trocken halten.<br />
9 Behälter an einem gut gelüfteten Ort aufbewahren.<br />
10 (veraltet) Inhalt feucht halten.<br />
11 (veraltet) Zutritt von Luft verhindern.<br />
12 Behälter nicht gasdicht verschliessen.<br />
13 Von Nahrungsmitteln, Getränken und Futtermitteln fernhalten.<br />
14 Von ... fernhalten (inkompatible Substanzen vom Hersteller anzugeben).<br />
15 Vor Hitze schützen.<br />
16 Von Zündquellen fernhalten - Nicht rauchen.<br />
17 Von brennbaren Stoffen fernhalten.<br />
18 Behälter mit Vorsicht öffnen und handhaben.<br />
20 Bei der Arbeit nicht essen und trinken.<br />
21 Bei der Arbeit nicht rauchen.<br />
22 Staub nicht einatmen.<br />
23 Gas/Rauch/Dampf/Aerosol nicht einatmen (geeignete Bezeichnung[en] vom Hersteller<br />
anzugeben).<br />
24 Berührung mit der Haut vermeiden.<br />
25 Berührung mit den Augen vermeiden.<br />
26 Bei Berührung mit den Augen gründlich mit Wasser abspülen und Arzt konsultieren.<br />
27 Beschmutzte, getränkte Kleidung sofort ausziehen.<br />
28 Bei Berührung mit der Haut sofort abwaschen mit viel ... (vom Hersteller anzugeben).<br />
29 Nicht in die Kanalisation gelangen lassen.<br />
30 Niemals Wasser hinzugiessen.<br />
31 (veraltet) Von explosionsfähigen Stoffen fernhalten.<br />
33 Massnahmen gegen elektrostatische Aufladungen treffen.<br />
34 (veraltet) Schlag und Reibung vermeiden.<br />
35 Abfälle und Behälter müssen in gesicherter Weise beseitigt werden.<br />
36 Bei der Arbeit geeignete Schutzkleidung tragen.<br />
37 Geeignete Schutzhandschuhe tragen.<br />
38 Bei unzureichender Belüftung Atemschutzgerät anlegen.<br />
39 Schutzbrille/Gesichtsschutz tragen.<br />
40 Fussboden und verunreinigte Gegenstände mit ... reinigen (Material vom Hersteller anzugeben).<br />
41 Explosions- und Brandgase nicht einatmen.<br />
42 Beim Räuchern/Versprühen geeignetes Atemschutzgerät anlegen (geeignete Bezeichnung[en]<br />
vom Hersteller anzugeben).<br />
43 Zum Löschen ... (vom Hersteller anzugeben) verwenden (wenn Wasser die Gefahr erhöht,<br />
anfügen: "Kein Wasser verwenden").<br />
45 Bei Unfall oder Unwohlsein sofort Arzt zuziehen (wenn möglich dieses Etikett vorzeigen).<br />
46 Bei Verschlucken sofort ärztlichen Rat einholen und Verpackung oder Etikett vorzeigen.<br />
47 Nicht bei Temperaturen über ... C aufbewahren (vom Hersteller anzugeben).<br />
48 Feucht halten mit ... (geeignetes Mittel vom Hersteller anzugeben).<br />
49 Nur im Originalbehälter aufbewahren.<br />
50 Nicht mischen mit ... (vom Hersteller anzugeben).<br />
51 Nur in gut gelüfteten Bereichen verwenden.<br />
52 Nicht grossflächig für Wohn- und Aufenthaltsräume zu verwenden.<br />
53 Exposition vermeiden - vor Gebrauch besondere Anweisungen einholen.<br />
56 Diesen Stoff und seinen Behälter auf entsprechend genehmigter Sondermülldeponie entsorgen.<br />
57 Zur Vermeidung einer Kontamination der Umwelt geeigneten Behälter verwenden.<br />
59 Informationen zur Wiederverwendung/Wiederverwertung beim Hersteller/Lieferanten erfragen.<br />
60 Dieser Stoff und sein Behälter sind als gefährlicher Abfall zu entsorgen.<br />
61 Freisetzung in die Umwelt vermeiden. Besondere Anweisungen einholen / Sicherheitsdatenblatt<br />
zu Rate ziehen.
Chemie Bützer<br />
130<br />
62 Bei Verschlucken kein Erbrechen herbeiführen. Sofort ärztlichen Rat einholen und Verpackung<br />
oder dieses Etikett vorzeigen.<br />
Kombination der S-Sätze<br />
1/2 Unter Verschluss und für Kinder unzugänglich aufbewahren.<br />
3/7 Behälter dicht geschlossen halten und an einem kühlen Ort aufbewahren<br />
3/7/9 (veraltet) Behälter dicht geschlossen halten und an einem kühlen, gut gelüfteten Ort<br />
aufbewahren.<br />
3/9 Behälter an einem kühlen, gut gelüfteten Ort aufbewahren.<br />
3/9/14 An einem kühlen, gut gelüfteten Ort, entfernt von ... aufbewahren (die Stoffe, mit denen<br />
Kontakt vermieden werden muss, sind vom Hersteller anzugeben).<br />
3/9/14/49 Nur im Originalbehälter an einem kühlen, gut gelüfteten Ort, entfernt von ... aufbewahren<br />
(die Stoffe, mit denen Kontakt vermieden werden muss, sind vom Hersteller anzugeben).<br />
3/9/49 Nur im Originalbehälter an einem kühlen, gut gelüfteten Ort aufbewahren.<br />
3/14 An einem kühlen, von ... entfernten Ort aufbewahren (die Stoffe, mit denen Kontakt<br />
vermieden werden muss, sind vom Hersteller anzugeben).<br />
7/8 Behälter trocken und dicht geschlossen halten.<br />
7/9 Behälter dicht geschlossen an einem gut gelüfteten Ort aufbewahren.<br />
7/47 Behälter dicht geschlossen und nicht bei Temperaturen über ... C aufbewahren.<br />
20/21 Bei der Arbeit nicht essen, trinken, rauchen.<br />
24/25 Berührung mit den Augen und der Haut vermeiden.<br />
29/56 Nicht in die Kanalisation gelangen lassen. Diesen Stoff und seinen Behälter der<br />
Problemabfallentsorgung zuführen.<br />
36/37 Bei der Arbeit geeignete Schutzhandschuhe und Schutzkleidung tragen.<br />
36/37/39 Bei der Arbeit geeignete Schutzkleidung, Schutzhandschuhe und<br />
Schutzbrille/Gesichtsschutz tragen.<br />
36/39 Bei der Arbeit geeignete Schutzkleidung und Schutzbrille/Gesichtsschutz tragen.<br />
37/39 Bei der Arbeit geeignete Schutzhandschuhe und Schutzbrille/Gesichtsschutz tragen.<br />
47/49 Nur im Originalbehälter bei einer Temperatur von nicht über ... C (vom Hersteller<br />
anzugeben) aufbewahren.
12.3 E-Sätze<br />
E-<br />
Satz -<br />
Nr.<br />
Chemie Bützer<br />
131<br />
Entsorgungsratschläge - E-Sätze Anzuwenden z.B. auf<br />
E 1 Verdünnen, in den Ausguss geben (WGK 0<br />
bzw. 1)<br />
kleinste Portionen reizender,<br />
gesundheitsschädlicher, brandfördernder<br />
Stoffe; - soweit wasserlöslich<br />
E 2 Neutralisieren, in den Ausguss geben saure und basische Stoffe<br />
E 3<br />
In den Hausmüll geben, gegebenenfalls in PE-<br />
Beutel (Stäube)<br />
Feststoffe, soweit nicht andere Ratschläge<br />
gegeben sind<br />
E 4 Als Sulfid fällen Schwermetallsalze<br />
E 5 Mit Calcium-Ionen fällen, dann E1 oder E3 lösliche Fluoride, Oxalate<br />
E 6 Nicht in den Hausmüll geben<br />
brandfördernde Stoffe;<br />
explosionsgefährliche Stoffe<br />
E 7 Im Abzug entsorgen; wenn möglich verbrennen<br />
absorbier- oder brennbare gasförmige<br />
Stoffe<br />
E 8<br />
Der Sondermüllbeseitigung zuführen (Adresse<br />
zu erfragen bei der Kreis- oder Stadtverwaltung)<br />
Unter grösster Vorsicht in kleinsten Portionen<br />
Laborabfälle im Sinne der TA Abfall<br />
E 9 reagieren lassen (z.B. offen im Freien<br />
verbrennen)<br />
explosionsgefährliche Stoffe und Gemische<br />
In gekennzeichneten Glasbehältern sammeln: organische Verbindungen<br />
E 10 1. "Organische Abfälle - halogenhaltig"<br />
- halogenhaltig<br />
2. "Organische Abfälle - halogenfrei"<br />
- halogenfrei<br />
E 11<br />
Als Hydroxid fällen (pH 8), den Niederschlag zu<br />
E8<br />
gelöste Schwermetallsalze<br />
E 12<br />
Nicht in die Kanalisation gelangen lassen (S-<br />
Satz 29)<br />
brennbare nicht wasserlösliche Stoffe, sehr<br />
giftige Stoffe<br />
E 13<br />
Aus der Lösung mit unedlerem Metall (z.B.<br />
Eisen) als Metall abscheiden (E14, E3)<br />
z.B. Verbindungen von Chrom oder Kupfer<br />
E 14<br />
Recycling-geeignet (Redestillation oder einem<br />
Recyclingunternehmen zuführen)<br />
Mit Wasser vorsichtig umsetzen, evtl.<br />
z.B. Verbindungen von Aceton,<br />
Quecksilber, Blei<br />
E 15 freiwerdende Gase verbrennen oder<br />
absorbieren oder stark verdünnt ableiten<br />
Carbide, Phosphide, Hydride<br />
E 16<br />
Entsprechend spezifischen Ratschlägen<br />
beseitigen
132<br />
13 Anhang: Sicherheitsdatenblatt: Nicotin<br />
L-Nicotine, 99+%<br />
**** Abschnitt 1 - Chemisches Präparat und Firmenidentifikation ****<br />
Produktname: L-Nicotine, 99+%<br />
Katalognummern:<br />
18142-0000, 18142-0050, 18142-0250, 18142-1000, 18.142.03<br />
Synonym: S-(-)-Nicotine, beta-Pyridyl-alpha-n-methylpyrrolidine.<br />
Firmenidentifikation (EU): Acros Organics BVBA<br />
Janssen Pharmaceuticalaan 3a<br />
2440 Geel, Belgium<br />
Firmenidentifikation (US): Acros Organics N.V.<br />
One Reagent Lane<br />
Fairlawn, NJ 07410<br />
Firmentelefonnummer: 0032(0) 14575211<br />
Notruf: 0032(0)14575299<br />
**** Abschnitt 2 - Zusammensetzung, Information zu Inhaltsstoffen ****<br />
CAS# 54-11-5, EINECS# 84 200-193-3<br />
Chemischer Name: L-Nicotine, % 99+%<br />
Gefahrensymbole: T+ N<br />
R-Sätze: 25 27 51/53<br />
**** Abschnitt 3 - Gefahrenhinweise ****<br />
Übersicht für den Notfall<br />
Giftig beim Verschlucken. Sehr giftig bei Berührung mit der Haut.Giftig für Wasserorganismen;<br />
kann in Gewässern längerfristig schädliche Wirkungen haben. Hygroskopisch.<br />
Mögliche Gesundheitseffekte<br />
Auge:<br />
Verursacht Augenreizungen. Verursacht Rötungen und Schmerzen.<br />
Haut:<br />
Verursacht Hautreizungen. Kann tödlich sein bei der Aufnahme durch die Haut. Kann<br />
Hautentzündungen verursachen.<br />
Einnahme:<br />
Giftig bei Aufnahme. Kann schädliche Wirkungen auf die Muskulatur haben. Kann schwere<br />
Reizungen des Verdauungstrakts mit Unterleibsschmerzen, Übelkeit, Erbrechen und Diarrhöe<br />
(Durchfall) hervorrufen. Kann Zittern und Krämpfe erzeugen. Kann Muskellähmung,<br />
Atemversagen und eventuell den Tod verursachen.<br />
Einatmung:<br />
Kann Wirkungen haben, die ähnlich wie bei der Aufnahme sind.<br />
Chronisch:<br />
Bei längerem oder wiederholtem Hautkontakt sind Hautentzündungen möglich. Kann<br />
Verdauungstrakt-und Herzstörungen erzeugen. Bei längerer oder wiederholter Exposition sind<br />
Übelkeit, Schwindel und Kopfschmerzen möglich.<br />
**** Abschnitt 4 - Erste Hilfe Massnahmen ****<br />
Augen:<br />
Augen sofort mit viel Wasser spülen, mindestens 15 Minuten, gelegentlich das untere und obere<br />
Augenlid anheben. Medizinische Hilfe holen.<br />
Haut:<br />
Die Haut gründlich mit Seife und Wasser abwaschen, mindestens 15 Minuten, und beschmutzte<br />
Kleidung und Schuhe ablegen. Medizinische Hilfe holen bei fortschreitender oder anhaltender<br />
84 Hinter der Abkürzung EINECS verbirgt sich das Europäische Altstoffverzeichnis (European Inventory<br />
of Existing Commercial Chemical Substances)<br />
Chemie Bützer
Chemie Bützer<br />
133<br />
Reizung. Beschmutzte Kleidung in der Art und Weise entsorgen, dass weitere Expositionen<br />
eingeschränkt sind. Beschmutzte Schuhe vernichten.<br />
Einnahme:<br />
Erbrechen herbeiführen. Falls das Unfallopfer bei Bewusstsein und wach ist, 2-4 Tassen Milch<br />
oder Wasser verabreichen. Sofort medizinische Hilfe holen.<br />
Einatmung:<br />
Sofort medizinische Hilfe holen. Sofort von der Exposition weg- und an die frische Luft bringen.<br />
Bei Atemstillstand künstlich beatmen. Bei Atemnot Sauerstoff geben.<br />
Arztnotiz:<br />
Treatment should be symptomatic and supportive. Gastric lavage if the material swallowed within<br />
the last 4 hours, a cathartic such as Magnesium sulfate if longer. Diazepan to control<br />
convulsions.<br />
**** Abschnitt 5 - Brandbekämpfungsmassnahmen ****<br />
Allgemeine Information:<br />
Bei jedem Brand ein Pressluftatemgerät je nach Druckerfordernissen, NIOSH/MSHA (oder<br />
gleichwertiges), und Vollschutzausrüstung tragen.<br />
Kann bei Temperaturen oberhalb des Flammpunkts Explosivgemische bilden.<br />
Feuerlöschmittel:<br />
Im Brandfall Wassersprüher, Trockenlöschmittel, Kohlendioxidlöscher oder Schaumlöscher<br />
benutzen.<br />
**** Abschnitt 6 - Unfallmassnahmen bei Freisetzung ****<br />
Allgemeine Information: Persönliche Sicherheitsausrüstung gebrauchen (siehe unter 8).<br />
Verschüttes/Auslaufendes:<br />
Nicht in Abwasserrohre und -Kanäle gelangen lassen, die in Gewässer geleitet werden. Ein<br />
Pressluftatemgerät und geeignete Personenschutzausrüstung tragen (siehe Expositionskontrolle,<br />
Personenschutz). Alle Zündquellen entfernen. Das verschüttete Material mit einem Absorber,<br />
nichtbrennbaren Stoffen wie Erde, Sand oder Vermiculit aufsaugen.<br />
**** Abschnitt 7 - Handhabung und Lagerung ****<br />
Manutention:<br />
Nach Gebrauch gründlich waschen. Verschmutzte Kleidung ablegen und vor dem<br />
Wiedergebrauch waschen. Mit entsprechender Belüftung benutzen. Behälter beim Umfüllen von<br />
Material auf den Boden stellen und anbinden. Funkensicheres Werkzeug und explosionssichere<br />
Ausrüstung benutzen. Den Behälter nicht wiederbenutzen. Nicht auf die Haut oder in Augen<br />
gelangen lassen. Nicht einnehmen oder einatmen. Nur in einem Chemieabzug benutzen.<br />
Lagerung:<br />
Von Zündquellen fernhalten. Unter einem Stickstoffpolster halten.<br />
Vor Kontakt mit brandfördernden Stoffen bewahren. An einem kühlen, trockenen und gut<br />
belüfteten Ort abseits von unverträglichen Substanzen lagern. Von starken Säuren fernhalten.<br />
**** Abschnitt 8 - Expositionskontrolle, Personenschutz ****<br />
Technische Kontrolle:<br />
Eine ausreichende Saugbelüftung benutzen, um die Luftschadstoffwerte unter dem erlaubten<br />
Expositionslimit zu halten.<br />
Personenschutzausrüstung<br />
Augen:<br />
Geeignete Schutzaugengläser oder Laborschutzbrillen tragen, wie bei OSHA's Augen-<br />
und Gesichtsschutz Vorschriften in 29 CFR 1910.133 beschrieben.<br />
Haut:<br />
Undurchlässige Handschuhe tragen.<br />
Kleidung:<br />
Geeignete Schutzkleidung tragen, um eine Exposition durch die Haut zu vemeiden.<br />
Atemschutzgeräte:<br />
Ein Pressluftatemgerät mit Überdruck nach DIN 3180 Teil 3 und DIN 58645 Teil 1 (EN<br />
250) tragen.
Chemie Bützer<br />
134<br />
**** Abschnitt 9 - Physikalische und chemische Eigenschaften ****<br />
Aggregatzustand: Klare Fluessigkeit.<br />
Aussehen: Gelb - Braun<br />
Geruch: fischartig - schwacher Geruch (rein geruchlos)<br />
pH: (8,1g /l @ 20°C) 10,2<br />
Dampfdruck: 1.3 mbar @ 62°C<br />
Rel. Dampdichte: 5.6 (Luft=1)<br />
Viscosität: Nicht verfügbar.<br />
Siedetemperatur: 246-247 °C<br />
Selbstentzündungstemperatur: 240°C (464.00°F)<br />
Flammpunkt: 101°C (213.80°F)<br />
Explosionsgrenze, Untere: 0.70 vol %<br />
Obere: 4.00 vol %<br />
Gefrier-/Schmelzpunkt: -80°C<br />
Zersetzungstemperatur: 247°C (Bp.)<br />
Löslichkeit: wasserlöslich (hygroskopisch), gut löslich in Alkohol, Chloroform, Ether und<br />
Petrolether<br />
LogPow: 1.17 (Verteilung n-Octanol/Wasser)<br />
Relative Dichte: 1.0105<br />
Molekülformel: C10H14N2<br />
Molekulargewicht: 162.23 g/mol.<br />
**** Abschnitt 10 - Stabilität und Reaktivität ****<br />
Chemische Stabilität:<br />
Stabil bei normalen Temperaturen in dicht geschlossenen Behältern unter Inertgasatmosphäre.<br />
Unter Einfluss von Licht und Luft unterliegt die Substanz einer Farbänderung.<br />
Vermeidungsbestimmungen:<br />
Unverträgliche Stoffe, Licht, Kontakt mit Luft, Kontakt mit Feuchtigkeit oder Wasser.<br />
Inkompatibilität mit anderen Stoffen:<br />
stark oxidierende Mittel, starke Säuren, starke Basen.<br />
Gefährliche Abbauprodukte:<br />
Stickoxide, Kohlenmonoxid, Kohlendioxid, Stickstoff.<br />
Gefährliche Polymerisation: tritt nicht ein<br />
**** Abschnitt 11 - Toxikologische Informationen ****<br />
RTECS#:<br />
CAS# 54-11-5 nicht aufgeführt<br />
LD50/LC50:<br />
CAS# 54-11-5:<br />
Oral, Maus: LD50 = 3340 ug/kg; Ratte: LD50 = 50 mg/kg;<br />
Haut, Kaninchen: LD50 = 50 mg/kg; Ratte: LD50 = 140 mg/kg;<br />
Karzinogenität:<br />
L-Nicotine - Not listed by ACGIH, IARC, NIOSH, NTP, or OSHA.<br />
Andere:<br />
Siehe aktueller Eintrag in RTECS für vollständige Informationen.Die toxikologischen<br />
Eigenschaften sind noch nicht vollständig erforscht.<br />
**** Abschnitt 12 - Ökologische Informationen ****<br />
Ökotoxizität:<br />
Daphnia: EC50: 0.24 mg/l; 48H;<br />
**** Abschnitt 13 - Entsorungsgesichtspunkte ****<br />
Entsorgen im Einklang mit einschlägigen Vorschriften.<br />
**** Abschnitt 14 - Transportinformation ****<br />
IMO<br />
Adressat: NICOTINE
Gefahrenklasse: 6.1<br />
UN-Nummer: 1654<br />
Verpackungsgruppe: II<br />
IATA<br />
Adressat: NICOTINE<br />
Gefahrenklasse: 6.1<br />
UN-Nummer: 1654<br />
Verpackungsgruppe: II<br />
RID/ADR<br />
Adressat: NICOTINE<br />
Gefahrenklasse: 6.1<br />
UN-Nummer: 1654<br />
Verpackungsgruppe: II<br />
Chemie Bützer<br />
135<br />
**** Abschnitt 15 - Informationen zu Vorschriften ****<br />
Europäisch/Internationale Verordnungen<br />
Gefahrensymbole: T+ N<br />
R-Sätze:<br />
R 25 Giftig beim Verschlucken.<br />
R 27 Sehr giftig bei Berührung mit der Haut.<br />
R 51/53 Giftig für Wasserorganismen; kann in Gewässern längerfristig schädliche Wirkungen<br />
haben.<br />
S-Sätze:<br />
S 36/37 Bei der Arbeit geeignete Schutzhandschuhe und Schutzkleidung tragen.<br />
S 45 Bei Unfall oder Unwohlsein sofort Arzt hinzuziehen (wenn möglich, dieses Etikett<br />
vorzeigen).<br />
S 61 Freisetzung in die Umwelt vermeiden. Besondere Anweisungen einholen /<br />
Sicherheitsdatenblatt zu Rate ziehen.<br />
WGK (Wassergefährdungsklasse): 3<br />
Technische Anleitung zur Reinhaltung der Luft (TA Luft)<br />
Organische Stoffe, Klasse I<br />
Insgesamt dürfen folgende Werte im Abgas nicht überschritten<br />
werden.<br />
Massenstrom: 0,10 kg/h oder Massenkonzentration : 20 mg/m 3<br />
Luftgrenzwerte am Arbeitsplatz: (TRGS 900)<br />
0,47 mg/m 3 ; 0,07 ml/m 3; Spitzenbegrenzung: Überschreitungsfaktor 4<br />
Die mittlere Konzentration soll in keinem 15-Minuten-Zeitraum die 4-fache<br />
Grenzwertkonzentration überschreiten.<br />
Expositionslimit:<br />
OEL-ARAB Republic of Egypt:TWA 0.5 mg/m3;Skin. OEL-AUSTRALIA:TWA 0.5 mg/m3;Skin.<br />
OEL-BELGIUM:TWA 0.5 mg/m3;Skin. OEL-DENMARK:TWA 0.5 mg/m3;Skin. OEL-<br />
FINLAND:TWA 0.5 mg/m3;STEL 1.5 mg/m3;Skin. OEL-FRANCE:TWA 0.5 mg/m3;Skin. OEL-<br />
GERMANY:TWA 0.07 ppm (0.5 mg/m3);Skin. OEL-HUNGARY:STEL 0.5 mg/m3;Skin. OEL-THE<br />
NETHERLANDS:TWA 0.07 ppm (0.5 mg/m3);Skin. OEL-THE PHILIPPINES:TWA 0.5<br />
mg/m3;Skin. OEL-POLAND:TWA 0.5 mg/m3. OEL-SWITZERLAND:TWA 0.07 ppm (0.5<br />
mg/m3);STEL 0.1 ppm;Skin. OEL-THAILAND:TWA 0.5 mg/m3. OEL-TURKEY:TWA 0.5<br />
mg/m3;Skin. OEL-UNITED KINGDOM:TWA 0.5 mg/m3;STEL 1.5 mg/m3;Skin. OEL IN<br />
BULGARIA, COLOMBIA, JORDAN, KOREA check ACGIH TLV. OEL IN NEW ZEALAND,<br />
SINGAPORE, VIETNAM check ACGI TLV US Federal TSCA<br />
CAS# 54-11-5 ist TSCA-Bestand aufgeführt.<br />
**** Abschnitt 16 - Sonstige Informationen ****<br />
Obige Informationen sind sorgfältig erstellt worden und stellen die für uns aktuell verfügbaren besten<br />
Informationen dar. Wir geben jedoch keine Garantie für die Marktfähigkeit oder irgendeine andere<br />
Garantie, ob ausgesprochen oder stillschweigend, und wir übernehmen keine Haftung für den Gebrauch.
Chemie Bützer<br />
136<br />
Der Benutzer sollte seine eigenen Ermittlungen machen, um die Eignung der Informationen für den<br />
speziellen Zweck zu bestimmen.