Ergänzende Aufgaben zu Säure-Base-Titrationen ... - laborberufe.de
Ergänzende Aufgaben zu Säure-Base-Titrationen ... - laborberufe.de
Ergänzende Aufgaben zu Säure-Base-Titrationen ... - laborberufe.de
- Keine Tags gefunden...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
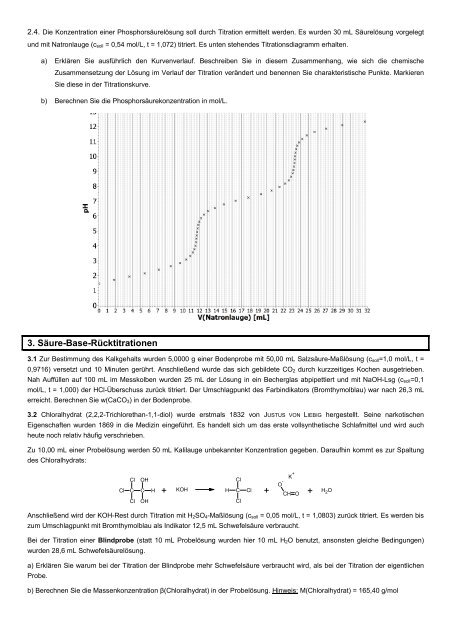
2.4. Die Konzentration einer Phosphorsäurelösung soll durch Titration ermittelt wer<strong>de</strong>n. Es wur<strong>de</strong>n 30 mL Säurelösung vorgelegtund mit Natronlauge (c soll = 0,54 mol/L, t = 1,072) titriert. Es unten stehen<strong>de</strong>s Titrationsdiagramm erhalten.a) Erklären Sie ausführlich <strong>de</strong>n Kurvenverlauf. Beschreiben Sie in diesem Zusammenhang, wie sich die chemischeZusammenset<strong>zu</strong>ng <strong>de</strong>r Lösung im Verlauf <strong>de</strong>r Titration verän<strong>de</strong>rt und benennen Sie charakteristische Punkte. MarkierenSie diese in <strong>de</strong>r Titrationskurve.b) Berechnen Sie die Phosphorsäurekonzentration in mol/L.3. Säure-<strong>Base</strong>-Rücktitrationen3.1 Zur Bestimmung <strong>de</strong>s Kalkgehalts wur<strong>de</strong>n 5,0000 g einer Bo<strong>de</strong>nprobe mit 50,00 mL Salzsäure-Maßlösung (c soll=1,0 mol/L, t =0,9716) versetzt und 10 Minuten gerührt. Anschließend wur<strong>de</strong> das sich gebil<strong>de</strong>te CO 2 durch kurzzeitiges Kochen ausgetrieben.Nah Auffüllen auf 100 mL im Messkolben wur<strong>de</strong>n 25 mL <strong>de</strong>r Lösung in ein Becherglas abpipettiert und mit NaOH-Lsg (c soll=0,1mol/L, t = 1,000) <strong>de</strong>r HCl-Überschuss <strong>zu</strong>rück titriert. Der Umschlagpunkt <strong>de</strong>s Farbindikators (Bromthymolblau) war nach 26,3 mLerreicht. Berechnen Sie w(CaCO 3) in <strong>de</strong>r Bo<strong>de</strong>nprobe.3.2 Chloralhydrat (2,2,2-Trichlorethan-1,1-diol) wur<strong>de</strong> erstmals 1832 von JUSTUS VON LIEBIG hergestellt. Seine narkotischenEigenschaften wur<strong>de</strong>n 1869 in die Medizin eingeführt. Es han<strong>de</strong>lt sich um das erste vollsynthetische Schlafmittel und wird auchheute noch relativ häufig verschrieben.Zu 10,00 mL einer Probelösung wer<strong>de</strong>n 50 mL Kalilauge unbekannter Konzentration gegeben. Daraufhin kommt es <strong>zu</strong>r Spaltung<strong>de</strong>s Chloralhydrats:ClClCClK +OHClO -C H +KOH H C Cl + CH O + H 2 OOHClAnschließend wird <strong>de</strong>r KOH-Rest durch Titration mit H 2SO 4-Maßlösung (c soll = 0,05 mol/L, t = 1,0803) <strong>zu</strong>rück titriert. Es wer<strong>de</strong>n bis<strong>zu</strong>m Umschlagpunkt mit Bromthymolblau als Indikator 12,5 mL Schwefelsäure verbraucht.Bei <strong>de</strong>r Titration einer Blindprobe (statt 10 mL Probelösung wur<strong>de</strong>n hier 10 mL H 2O benutzt, ansonsten gleiche Bedingungen)wur<strong>de</strong>n 28,6 mL Schwefelsäurelösung.a) Erklären Sie warum bei <strong>de</strong>r Titration <strong>de</strong>r Blindprobe mehr Schwefelsäure verbraucht wird, als bei <strong>de</strong>r Titration <strong>de</strong>r eigentlichenProbe.b) Berechnen Sie die Massenkonzentration β(Chloralhydrat) in <strong>de</strong>r Probelösung. Hinweis: M(Chloralhydrat) = 165,40 g/mol