AG Botanik - Fachbereich 5 Biologie - Universität Osnabrück
AG Botanik - Fachbereich 5 Biologie - Universität Osnabrück
AG Botanik - Fachbereich 5 Biologie - Universität Osnabrück
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Literaturauswahl<br />
Meissner, D., Odman-Naresh, J.,<br />
Vogelpohl, I., and Merzendorfer, H.<br />
(2010). A novel role of the yeast<br />
CaaX protease Ste24 in chitin synthesis.<br />
Mol. Biol. Cell 21, 2425-33.<br />
Broehan, G., Arakane, Y., Beeman,<br />
R.W., Kramer, K.J., Muthukrishnan,<br />
S., and Merzendorfer, H. (2010)<br />
Molecular analyses of chymotrypsin-like<br />
peptidases from Tribolium<br />
castaneum involved in digestion<br />
and molting. Insect Biochem. Mol.<br />
Biol. 40, 274-83.<br />
Merzendorfer, H. (2009) Chitin:<br />
structure, function and metabolism.<br />
In “The sugar code: fundamentals<br />
in Glycoscience” (Ed. H.-J.<br />
Gabius), Wiley-VCH, Weinheim.<br />
Maue, L., Meissner, D., and Merzendorfer,<br />
H. (2009) Purification of an<br />
active, oligomeric chitin synthase<br />
complex from the midgut of the<br />
tobacco hornworm. Insect Biochem.<br />
Mol. Biol. 39, 654-659.<br />
Broehan, G., Kemper, M., Driemeier,<br />
D., Vogelpohl, I., and Merzendorfer<br />
H. (2008) Cloning and expression<br />
analysis of midgut chymotrypsinlike<br />
proteinases in the tobacco<br />
hornworm. J. Insect Physiol. 54,<br />
1243-1252.<br />
Broehan, G., Zimoch, L., Wessels, A.,<br />
Ertas, B., and Merzendorfer, H.<br />
(2007) A chymotrypsin-like serine<br />
protease interacts with the chitin<br />
synthase from the midgut of the<br />
tobacco hornworm. J. Exp. Biol.<br />
210, 3636-3643.<br />
Kontakt<br />
apl. Prof. Dr. Hans Merzendorfer<br />
Telefon: +49 (0)541 969 3502<br />
E-Mail: merzendorfer@biologie.<br />
uni- osnabrueck.de<br />
Internet: http://www.biologie.uniosnabrueck.de<br />
36<br />
Tierphysiologie<br />
<strong>AG</strong> Tierphysiologie<br />
Chitin-Biosynthese<br />
Chitin ist ein weit verbreitetes Polymer aus N-Acetylglucosamin-Einheiten, das für die chemisch/pharmazeutische<br />
Industrie zunehmend an Bedeutung gewinnt. In der Natur findet<br />
sich dieses faserartige Molekül unter anderem in den Zellwänden von Pilzen und in mechanisch<br />
widerstandsfähigen Bioverbundstoffen wie den Panzern von Insekten. Chitin lässt sich<br />
aber auch in der peritrophischen Matrix im Verdauungstrakt von Invertebraten nachweisen.<br />
Unsere Arbeitsgruppe beschäftigt sich mit dem Metabolismus von Chitin bei Pilzen und Insekten.<br />
Dabei untersuchen wir mit molekularbiologischen und biochemischen Methoden<br />
die verschiedenen Proteine, die für die Biosynthese, Modifizierung und Degradation von<br />
Chitin benötigt werden. Daneben interessieren wir uns für die Wirkmechanismen von Inhibitoren<br />
der Chitinsynthese, die als Fungizide und Insektizide breite Verwendung finden.<br />
Ein zentrales Enzym im<br />
Chitin-Metabolismus<br />
von Pilzen und Insekten<br />
ist die Chitinsynthase,<br />
eine membrangebunde -<br />
ne Glycosyltransferase,<br />
welche die Polymerisationsreaktion<br />
katalysiert.<br />
Nachdem wir die Chitinsynthase<br />
erstmalig aus<br />
Insekten biochemisch ge -<br />
rei nigt und charakterisiert<br />
haben, untersuchen<br />
wir nun ihre Struktur und<br />
Regulation. Letztere lässt<br />
sich nicht vollends verstehen,<br />
ohne intrazelluläre<br />
Prozesse zu berücksichtigen.<br />
Deswegen ana -<br />
ly sieren wir die Prozessierung<br />
und Sortierung<br />
relevanter Proteine in der<br />
Bäckerhefe, einem zellbiologischenModellorganismus,<br />
in dem Chitin<br />
für die Zellwand produziert<br />
wird. Die Chitinsynthese<br />
ist ferner ein Angriffspunkt<br />
für Fungizide<br />
und Insektizide, die im<br />
Pflanzenschutz oder bei der Behandlung von<br />
Infektionskrankheiten eingesetzt werden können.<br />
Wir untersuchen dabei vor allem die<br />
Gruppe der Benzoylphenyl-Harnstoffe, da bislang<br />
nicht bekannt ist, wie diese seit langem<br />
eingesetzten Insektizide genau wirken. Der<br />
rostbraune Mehlkäfer, Tribolium castaneum,<br />
dessen Genom komplett sequenziert ist, dient<br />
uns dabei als Modellsystem, wobei wir genomische<br />
und proteomische Untersuchungsansätze<br />
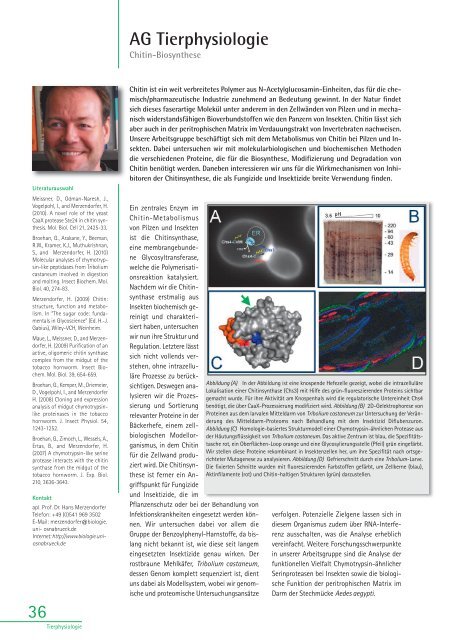
Abbildung (A) In der Abbildung ist eine knospende Hefezelle gezeigt, wobei die intrazelluläre<br />
Lokalisation einer Chitinsynthase (Chs3) mit Hilfe des grün-fluoreszierenden Proteins sichtbar<br />
gemacht wurde. Für ihre Aktivität am Knospenhals wird die regulatorische Untereinheit Chs4<br />
benötigt, die über CaaX-Prozessierung modifiziert wird. Abbildung (B) 2D-Gelektrophorese von<br />
Proteinen aus dem larvalen Mitteldarm von Tribolium castaneum zur Untersuchung der Veränderung<br />
des Mitteldarm-Proteoms nach Behandlung mit dem Insektizid Diflubenzuron.<br />
Abbildung (C) Homologie-basiertes Strukturmodell einer Chymotrypsin-ähnlichen Protease aus<br />
der Häutungsflüssigkeit von Tribolium castaneum. Das aktive Zentrum ist blau, die Spezifitätstasche<br />
rot, ein Oberflächen-Loop orange und eine Glycosylierungsstelle (Pfeil) grün eingefärbt.<br />
Wir stellen diese Proteine rekombinant in Insektenzellen her, um ihre Spezifität nach ortsgerichteter<br />
Mutagenese zu analysieren. Abbildung (D) Gefrierschnitt durch eine Tribolium-Larve.<br />
Die fixierten Schnitte wurden mit fluoreszierenden Farbstoffen gefärbt, um Zellkerne (blau),<br />
Aktinfilamente (rot) und Chitin-haltigen Strukturen (grün) darzustellen.<br />
verfolgen. Potenzielle Zielgene lassen sich in<br />
diesem Organismus zudem über RNA-Interferenz<br />
ausschalten, was die Analyse erheblich<br />
vereinfacht. Weitere Forschungsschwerpunkte<br />
in unserer Arbeitsgruppe sind die Analyse der<br />
funktionellen Vielfalt Chymotrypsin-ähnlicher<br />
Serinproteasen bei Insekten sowie die biologische<br />
Funktion der peritrophischen Matrix im<br />
Darm der Stechmücke Aedes aegypti.