GET 1 - Allgemeine und theoretische Elektrotechnik - Universität ...
GET 1 - Allgemeine und theoretische Elektrotechnik - Universität ...
GET 1 - Allgemeine und theoretische Elektrotechnik - Universität ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
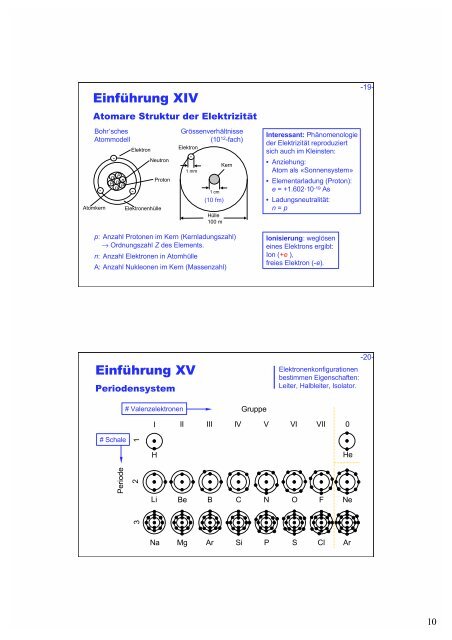
Einführung XIV<br />
Atomare Struktur der Elektrizität<br />
Bohr‘sches<br />
Atommodell<br />
-<br />
Atomkern<br />
-<br />
p n<br />
n<br />
p<br />
n<br />
p<br />
n<br />
Elektron<br />
Neutron<br />
-<br />
Elektronenhülle<br />
Proton<br />
Grössenverhältnisse<br />
(1012-fach) Elektron<br />
-<br />
1 mm<br />
1 cm<br />
(10 fm)<br />
Hülle<br />
100 m<br />
Kern<br />
p: Anzahl Protonen im Kern (Kernladungszahl)<br />
� Ordnungszahl Z des Elements.<br />
n: Anzahl Elektronen in Atomhülle<br />
A: Anzahl Nukleonen im Kern (Massenzahl)<br />
Einführung XV<br />
Periodensystem<br />
# Schale<br />
Periode<br />
# Valenzelektronen<br />
1<br />
2<br />
3<br />
I II III IV<br />
Gruppe<br />
Interessant: Phänomenologie<br />
der Elektrizität reproduziert<br />
sich auch im Kleinsten:<br />
• Anziehung:<br />
Atom als «Sonnensystem»<br />
• Elementarladung (Proton):<br />
e = +1.602·10 -19 As<br />
• Ladungsneutralität:<br />
n = p<br />
Ionisierung: weglösen<br />
eines Elektrons ergibt:<br />
Ion (+e ),<br />
freies Elektron (-e).<br />
Elektronenkonfigurationen<br />
bestimmen Eigenschaften:<br />
Leiter, Halbleiter, Isolator.<br />
V VI VII 0<br />
H He<br />
Li Be B C N O F Ne<br />
Na Mg Ar Si P S Cl Ar<br />
-19-<br />
-20-<br />
10