CAPÍTULO 4 LIGAÇÕES QUÍMICAS SUMÁRIO 4.1 ... - Unioeste
CAPÍTULO 4 LIGAÇÕES QUÍMICAS SUMÁRIO 4.1 ... - Unioeste
CAPÍTULO 4 LIGAÇÕES QUÍMICAS SUMÁRIO 4.1 ... - Unioeste
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
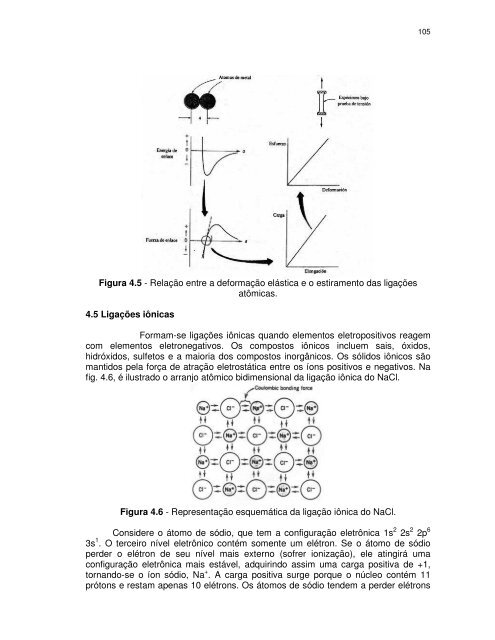
Figura 4.5 - Relação entre a deformação elástica e o estiramento das ligações<br />
atômicas.<br />
4.5 Ligações iônicas<br />
Formam-se ligações iônicas quando elementos eletropositivos reagem<br />
com elementos eletronegativos. Os compostos iônicos incluem sais, óxidos,<br />
hidróxidos, sulfetos e a maioria dos compostos inorgânicos. Os sólidos iônicos são<br />
mantidos pela força de atração eletrostática entre os íons positivos e negativos. Na<br />
fig. 4.6, é ilustrado o arranjo atômico bidimensional da ligação iônica do NaCl.<br />
Figura 4.6 - Representação esquemática da ligação iônica do NaCl.<br />
Considere o átomo de sódio, que tem a configuração eletrônica 1s 2 2s 2 2p 6<br />
3s 1 . O terceiro nível eletrônico contém somente um elétron. Se o átomo de sódio<br />
perder o elétron de seu nível mais externo (sofrer ionização), ele atingirá uma<br />
configuração eletrônica mais estável, adquirindo assim uma carga positiva de +1,<br />
tornando-se o íon sódio, Na + . A carga positiva surge porque o núcleo contém 11<br />
prótons e restam apenas 10 elétrons. Os átomos de sódio tendem a perder elétrons<br />
105