- Page 1 and 2:
117
- Page 3 and 4: 119
- Page 5 and 6: Dedicatória: A meus pais, Sebasti
- Page 7 and 8: Ao Prof. Pedro Íris, do DEMA-UFSCa
- Page 9 and 10: demonstrou a biocompatibilidade dos
- Page 11 and 12: cortical bone. The in vitro and in
- Page 13 and 14: 2.2.8. Classificação das Fibras .
- Page 15 and 16: Lista de Figuras 2.1. Aplicações
- Page 17 and 18: 4.21. Fotomicrografia eletrônica d
- Page 19 and 20: 4.54. Porosidade aparente das compo
- Page 21 and 22: composição III (10% de acrilamida
- Page 23 and 24: Lista de Tabelas 2.1. Propriedades
- Page 25 and 26: Nomenclatura Letras Latinas D.A. -
- Page 27 and 28: IL - índice de lise; porcentagem d
- Page 29 and 30: dos seres vivos. Eles são utilizad
- Page 31 and 32: A incorporação de fibras em matri
- Page 33 and 34: segundo o qual "biomateriais são t
- Page 35 and 36: Absorvíveis, materiais que, após
- Page 37 and 38: Alumina Alumina (Al 2 O 3 ) densa e
- Page 39 and 40: desuso atualmente, em virtude da ut
- Page 41 and 42: equipamentos percutâneos; reparo e
- Page 43 and 44: Carbono Três tipos de carbono são
- Page 45 and 46: quando misturado com água, não pe
- Page 47 and 48: água, sangue, solução salina ou
- Page 49 and 50: Constantino et al., 1991; Friedman
- Page 51 and 52: 2. DCPD → HA 5CaHPO 4 .2H 2 O →
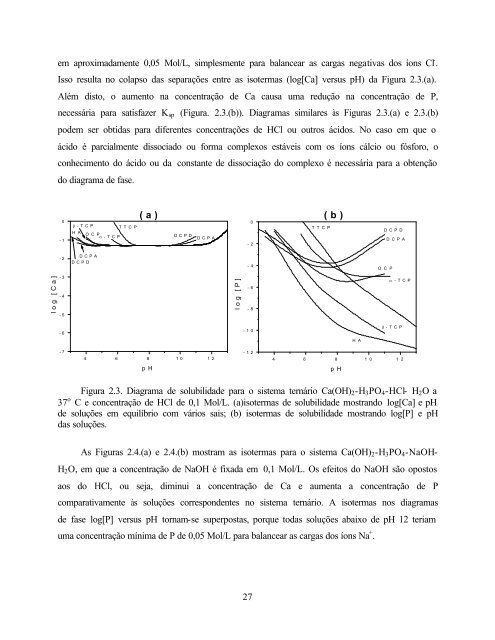
- Page 53: Os diagramas de solubilidade mostra
- Page 57 and 58: Sistema b -TCP/DCPD/CC Este sistema
- Page 59 and 60: CSH foi absorvido e substituído po
- Page 61 and 62: Resumindo-se as características do
- Page 63 and 64: • a homogeneidade ou heterogeneid
- Page 65 and 66: processamento, os polímeros parece
- Page 67 and 68: Estudos têm mostrado que, ao contr
- Page 69 and 70: 2.2.9. Propriedades Mecânicas de F
- Page 71 and 72: Modelos teóricos do reforço provo
- Page 73 and 74: Volume Crítico de Fibras Nos comp
- Page 75 and 76: e a fração volumétrica das fibra
- Page 77 and 78: 3)Determinação da quantidade óti
- Page 79 and 80: 3.1. Materiais Utilizados • α-Al
- Page 81 and 82: h, em cadinho de alumina (Al 2 O 3
- Page 83 and 84: 0,40 0,35 Y =-0,00689+0,01796 X 0,3
- Page 85 and 86: A densidade e porosidade aparente d
- Page 87 and 88: Para os ensaio de citotoxicidade fo
- Page 89 and 90: Tabela 3.2. Critérios de avaliaç
- Page 91 and 92: Tabela 3.4. Disposição dos implan
- Page 93 and 94: 300 Intensidade (cts) α-TCP β-TCP
- Page 95 and 96: 300 250 Intensidade (cts) α-TCP β
- Page 97 and 98: menos suscetível à reação de tr
- Page 99 and 100: 10mm Figura 4.5. Fotomicrografia el
- Page 101 and 102: 4.1.2. Obtenção e Caracterizaçã
- Page 103 and 104: Intensidade 1700 1600 1500 1400 130
- Page 105 and 106:
Figura 4.10. Sistema CaO-P 2 O 5 .
- Page 107 and 108:
350 TTCP 300 250 Intensidade (cts)
- Page 109 and 110:
também parece ser factível quando
- Page 111 and 112:
Tendo em vista os resultados obtido
- Page 113 and 114:
de bioatividade, ou seja, a concent
- Page 115 and 116:
10,0 9,5 9,0 8,5 pH 8,0 7,5 7,0 6,5
- Page 117 and 118:
aseado no TTCP (fosfato tetracálci
- Page 119 and 120:
5 mm Figura 4.21. Fotomicrografia e
- Page 121 and 122:
• o pH do cimento de fosfato de c
- Page 123 and 124:
desenvolvido, na década de 70, par
- Page 125 and 126:
4.2.1. Características das Fibras
- Page 127 and 128:
100 mm 10mm Figura 4.27. Fotomicrog
- Page 129 and 130:
máxima, tornando-a superior àquel
- Page 131 and 132:
2,5x10 8 2,0x10 8 Tensão (Pa) 1,5x
- Page 133 and 134:
o próprio processamento para sua o
- Page 135 and 136:
Resistência à Compressão (MPa) 4
- Page 137 and 138:
Apesar da resistência à compress
- Page 139 and 140:
O valor de resistência à tração
- Page 141 and 142:
A trinca provoca a fratura do mater
- Page 143 and 144:
Para as composições que contêm a
- Page 145 and 146:
40 38 36 Carbono Polipropileno Nái
- Page 147 and 148:
Tanahashi (Tanahashi et al., 1994)
- Page 149 and 150:
5 µm Figura 4.43. Fotomicrografia
- Page 151 and 152:
1,4 1,2 1,0 Carbono Polipropileno N
- Page 153 and 154:
uma redução do aumento da abertur
- Page 155 and 156:
•os valores de J IC das composiç
- Page 157 and 158:
moléculas destes defloculantes à
- Page 159 and 160:
cimento acrescidas de lignossulfona
- Page 161 and 162:
40 Carbono Polipropileno Náilon Ny
- Page 163 and 164:
A resistência à tração das comp
- Page 165 and 166:
1200 1000 A β α A β A AA αβ (c
- Page 167 and 168:
A) B) 20 mm 20 mm Figura 4.57. Foto
- Page 169 and 170:
O método de Abe e colaboradores (A
- Page 171 and 172:
As soluções foram preparadas pela
- Page 173 and 174:
adequados para uso clínico; 2)aume
- Page 175 and 176:
Apesar das vantagens que as composi
- Page 177 and 178:
de que a solubilização do sulfato
- Page 179 and 180:
anteriormente para a composição i
- Page 181 and 182:
2600 2400 2200 2000 1800 Intensidad
- Page 183 and 184:
Preparou-se uma composição de cim
- Page 185 and 186:
de látex. Para as composições ac
- Page 187 and 188:
35 30 24 Hs SBF 7 Dias SBF Porosida
- Page 189 and 190:
A presença do látex acrílico e p
- Page 191 and 192:
100 % do Númerlo de Colônias 50 0
- Page 193 and 194:
al., 1995), baseada no α-fosfato t
- Page 195 and 196:
Tabela 4.14. Composição e proprie
- Page 197 and 198:
pega atua contrariamente à degrada
- Page 199 and 200:
A) B) 1 mm 1 mm Figura 4.75. Fotomi
- Page 201 and 202:
Tabela 4.17. Composições utilizad
- Page 203 and 204:
obtiveram um aumento da resistênci
- Page 205 and 206:
35 30 24 Horas SBF 7 Dias SBF Poros
- Page 207 and 208:
Intensidade 1800 1600 1400 1200 100
- Page 209 and 210:
140 Transmitância 130 120 110 100
- Page 211 and 212:
sendo sua resposta ao ensaio compar
- Page 213 and 214:
As composições foram misturadas e
- Page 215 and 216:
MPa), e à tração, com aumento de
- Page 217 and 218:
mecanismo de reforço pelo qual as
- Page 219 and 220:
correlacionado à variação da por
- Page 221 and 222:
Na Figura 4.89, são apresentadas a
- Page 223 and 224:
compósito. Entretanto os valores o
- Page 225 and 226:
560 J.m -2 )(Ravaglioli & Krajewski
- Page 227 and 228:
da resistência mecânica quando o
- Page 229 and 230:
• porosidade aparente; • fases
- Page 231 and 232:
A porosidade aparente, das composi
- Page 233 and 234:
50 45 S/ Aditivos Aditivado Porosid
- Page 235 and 236:
A Figura 4.98 mostra os resultados
- Page 237 and 238:
acentuada, principalmente quando co
- Page 239 and 240:
máximos valores de resistência me
- Page 241 and 242:
(Fernández et al., 1999), para com
- Page 243 and 244:
A) B) C) D) E) 5 mm 5 mm 5 mm 5 mm
- Page 245 and 246:
9,5 S/ Aditivos Aditivada 9,0 8,5 p
- Page 247 and 248:
• A composição de cimento com a
- Page 249 and 250:
De forma análoga, as radiografias
- Page 251 and 252:
A) B) C) D) Figura 4.106. Fotomicro
- Page 253 and 254:
uma absorção de cerca de 60% apó
- Page 255 and 256:
•ocorreu aumento da tenacidade à
- Page 257 and 258:
•A adição de fibras de carbono
- Page 259 and 260:
São sugeridos, como seqüência do
- Page 261 and 262:
16. BOHNER, M. Calcium orthophospha
- Page 263 and 264:
BIOMATERIALES, 1997, La Habana/Cuba
- Page 265 and 266:
84. KHAIROUN, I.; BOLTONG, M. G.; D
- Page 267 and 268:
123.MIYAMOTO Y.; ISHIKAWA K.; TAKEC
- Page 269 and 270:
160.SARGIN, Y.; KIZILYALLI, M.; TEL
- Page 271 and 272:
Apêndice A Trabalhos Originados da
- Page 273 and 274:
17.SANTOS, L. A., L. C., RIGO, E. C