Nebelkammer - Physikalisches Projektpraktikum
Nebelkammer - Physikalisches Projektpraktikum
Nebelkammer - Physikalisches Projektpraktikum
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
3. physikalische Grundlagen<br />
3.1 Thermodynamische Grundlagen<br />
3.1.1 Zustandsgleichungen idealer Gase<br />
Die Gesetze von Boyle – Mariotte und Gay – Lussac:<br />
Boyle - Mariotte:<br />
Das Produkt aus Druck und Volumen ändert sich bei konstanter Temperatur eines Gases nicht.<br />
P·V = konstant<br />
Gay - Lussac:<br />
Die Temperatur eines Gases ist bei konstanten Volumen proportional zum Druck.<br />
P = konstant<br />
T<br />
Diese Gesetze gelten näherungsweise für alle Gase bei geringer Dichte.<br />
Aus diesen Zusammenhängen lässt sich nun die Zustandsgleichung für ideale Gase herleiten.<br />
Es ist offensichtlich, dass die Temperatur, falls P konstant ist, somit auch proportional zum Volumen<br />
eines Gases ist. Dieser Zusammenhang lässt sich mit Hilfe einer Proportionalitätskonstante C, die<br />
von der Gasmenge abhängt, folgendermaßen beschreiben:<br />
P·V = C·T<br />
Setzt man nun C = n·R, mit der Molzahl n und der Gaskonstanten R, so erhält man die<br />
Zustandsgleichung für ideale Gase:<br />
P·V = n·R·T<br />
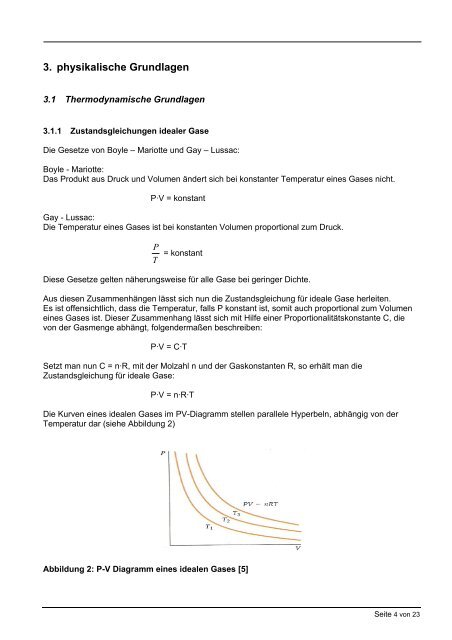
Die Kurven eines idealen Gases im PV-Diagramm stellen parallele Hyperbeln, abhängig von der<br />
Temperatur dar (siehe Abbildung 2)<br />
Abbildung 2: P-V Diagramm eines idealen Gases [5]<br />
Seite 4 von 23