Nebelkammer - Physikalisches Projektpraktikum
Nebelkammer - Physikalisches Projektpraktikum
Nebelkammer - Physikalisches Projektpraktikum
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
3.1.2 Van – der – Waals - Gleichung und Isothermen eines realen Gases<br />
Die Van-der-Waals Gleichung beschreibt das Verhalten realer Gase, d.h. von Gasen, deren Atome<br />
bzw. Moleküle eine endliche Ausdehnung haben und miteinander in Wechselwirkung treten können.<br />
Diese Effekte werden durch den Binnendruck und Eigenvolumen berücksichtigt. Über weite<br />
Druckbereiche ist diese Gleichung besser als die o.a. Zustandsgleichung für ideale Gase.<br />
⎛<br />
⎜<br />
⎝<br />
a ⋅ n<br />
Zustandsgleichung: ⎜ P ⎟ ( V − n ⋅ b)<br />
+<br />
2<br />
V<br />
2<br />
⎞<br />
⎟ ⋅<br />
⎠<br />
= n ⋅ R ⋅ T<br />
Mit:<br />
- P: äußerer Druck<br />
- a/V²: Binnendruck des Gases<br />
- V: Gasvolumen<br />
- b: Eigenvolumen der Gasmoleküle<br />
Mit zunehmendem Volumen, bzw. abnehmender Dichte nähert sich die Van-der-Waals-Gleichung<br />
immer mehr der Zustandsgleichung für ideale Gase und geht schließlich in diese über.<br />
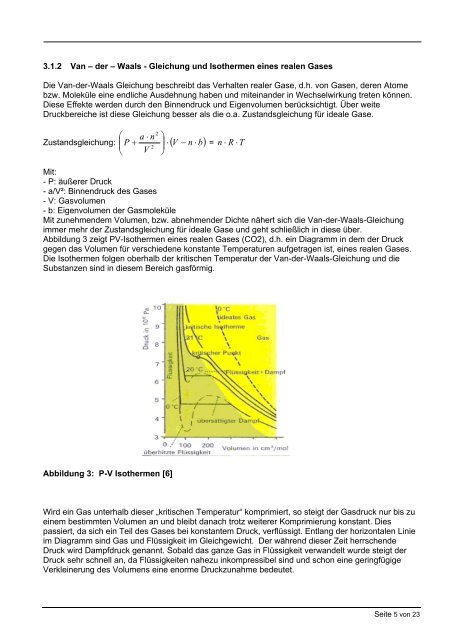
Abbildung 3 zeigt PV-Isothermen eines realen Gases (CO2), d.h. ein Diagramm in dem der Druck<br />
gegen das Volumen für verschiedene konstante Temperaturen aufgetragen ist, eines realen Gases.<br />
Die Isothermen folgen oberhalb der kritischen Temperatur der Van-der-Waals-Gleichung und die<br />
Substanzen sind in diesem Bereich gasförmig.<br />
Abbildung 3: P-V Isothermen [6]<br />
Wird ein Gas unterhalb dieser „kritischen Temperatur“ komprimiert, so steigt der Gasdruck nur bis zu<br />
einem bestimmten Volumen an und bleibt danach trotz weiterer Komprimierung konstant. Dies<br />
passiert, da sich ein Teil des Gases bei konstantem Druck, verflüssigt. Entlang der horizontalen Linie<br />
im Diagramm sind Gas und Flüssigkeit im Gleichgewicht. Der während dieser Zeit herrschende<br />
Druck wird Dampfdruck genannt. Sobald das ganze Gas in Flüssigkeit verwandelt wurde steigt der<br />
Druck sehr schnell an, da Flüssigkeiten nahezu inkompressibel sind und schon eine geringfügige<br />
Verkleinerung des Volumens eine enorme Druckzunahme bedeutet.<br />
Seite 5 von 23