Klonierung und Charakterisierung von reifungsassoziierten ...
Klonierung und Charakterisierung von reifungsassoziierten ...
Klonierung und Charakterisierung von reifungsassoziierten ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Ergebnisse<br />
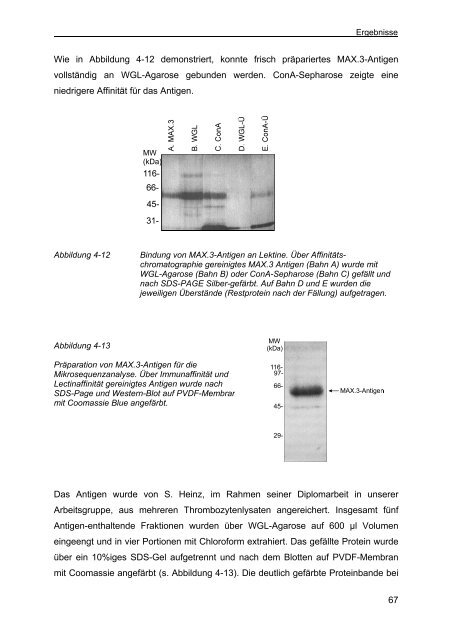
Wie in Abbildung 4-12 demonstriert, konnte frisch präpariertes MAX.3-Antigen<br />
vollständig an WGL-Agarose geb<strong>und</strong>en werden. ConA-Sepharose zeigte eine<br />
niedrigere Affinität für das Antigen.<br />
Abbildung 4-12 Bindung <strong>von</strong> MAX.3-Antigen an Lektine. Über Affinitätschromatographie<br />
gereinigtes MAX.3 Antigen (Bahn A) wurde mit<br />
WGL-Agarose (Bahn B) oder ConA-Sepharose (Bahn C) gefällt <strong>und</strong><br />
nach SDS-PAGE Silber-gefärbt. Auf Bahn D <strong>und</strong> E wurden die<br />
jeweiligen Überstände (Restprotein nach der Fällung) aufgetragen.<br />
Abbildung 4-13<br />
MW<br />
(kDa)<br />
Präparation <strong>von</strong> MAX.3-Antigen für die<br />
Mikrosequenzanalyse. Über Immunaffinität <strong>und</strong><br />
Lectinaffinität gereinigtes Antigen wurde nach<br />
SDS-Page <strong>und</strong> Western-Blot auf PVDF-Membran<br />
mit Coomassie Blue angefärbt.<br />
Das Antigen wurde <strong>von</strong> S. Heinz, im Rahmen seiner Diplomarbeit in unserer<br />
Arbeitsgruppe, aus mehreren Thrombozytenlysaten angereichert. Insgesamt fünf<br />
Antigen-enthaltende Fraktionen wurden über WGL-Agarose auf 600 µl Volumen<br />
eingeengt <strong>und</strong> in vier Portionen mit Chloroform extrahiert. Das gefällte Protein wurde<br />
über ein 10%iges SDS-Gel aufgetrennt <strong>und</strong> nach dem Blotten auf PVDF-Membran<br />
mit Coomassie angefärbt (s. Abbildung 4-13). Die deutlich gefärbte Proteinbande bei<br />
67