Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
European Society for<br />
Medical Oncology<br />
(ESMO Virtual<br />
Congress <strong>2020</strong>),<br />
19.–21.9.20<br />
signifikanter OS-Gewinn von 3,3 Monaten und auch<br />
ein PFS-Vorteil in der CPS≥5-Gruppe (siehe Tabelle). Auch<br />
für die CPS≥1-Gruppe und für alle Patienten konnte ein<br />
OS-Vorteil gezeigt werden. Weitere Biomarkerstudien wie<br />
MSI-high (MSI, Mikrosatelliteninstabilität) sind geplant,<br />
um den Wirksamkeitsvorteil über alle CPS-Scores genauer<br />
definieren zu können.<br />
Die Studie ATTRACTION (ONO-4538-37) war ähnlich<br />
konzipiert. Sie untersuchte Nivolumab in Kombination<br />
mit Chemotherapie – SOX (S1 plus Oxaliplatin) oder<br />
CapeOx (Capecitabin plus Oxaliplatin) – in der Erstlinie.<br />
Hier wurden ausschließlich asiatische GC/GEJ-Patienten<br />
ungeachtet des PD-L1-Status eingeschlossen (All-Comers).<br />
Die Studie konnte zwar einen signifikanten PFS-<br />
Vorteil für die Nivolumab-Zugabe aufzeigen, aber in der<br />
finalen Analyse war der Unterschied im OS gering und<br />
statistisch nicht signifikant.<br />
Diese beiden Studien sind praxisverändernd. Die Kombination<br />
von Nivolumab mit einem Fluorpyrimidin-Oxaliplatin-Regime<br />
wird von Experten als neuer Erstlinien-<br />
Therapiestandard angesehen.<br />
Die placebokontrollierte randomisierte globale Phase-<br />
III-Studie KEYNOTE 590 (NCT03189719) untersuchte<br />
maximal 35 Zyklen Pembrolizumab als Zugabe zu einer<br />
Erstlinien-Chemotherapie mit Cisplatin (6 Zyklen) plus<br />
5-Fluoruracil (≤35 Zyklen). Eingeschlossen waren 749<br />
Patienten mit fortgeschrittenen Speiseröhrentumoren,<br />
stratifiziert nach Adenokarzinom- oder Plattenepithelkarzinom-Histologie<br />
(EAC bzw. ESCC), sowie GEJ-Adenokarzinomen<br />
(Siewert Typ 1). Primäre Endpunkte waren<br />
das OS in der ESCC-Gruppe mit CPS≥<strong>10</strong> sowie OS<br />
und PFS in den Gruppen ESCC, CPS≥<strong>10</strong> und alle Patienten.<br />
Die Studie erreichte alle koprimären OS- und PFS-<br />
Endpunkte im Sinne einer signifikanten Verbesserung<br />
(siehe Tabelle). Die Ansprechraten waren bei allen Patienten<br />
signifikant gesteigert, von 29,3 Prozent mit Chemotherapie<br />
allein auf 45 Prozent mit zusätzlichem Pembrolizumab.<br />
Die Kombination von Pembrolizumab mit<br />
platinbasierter Chemotherapie wird für Patienten mit<br />
fortgeschrittenem Speiseröhrentumoren und CPS≥<strong>10</strong> als<br />
neuer Erstlinienstandard angesehen.<br />
Moehler M et al., Presidential Symposium III, Abstract LBA6_PR;<br />
Boku N et al., Presidential Symposium III, Abstract LBA7_PR;<br />
Kato K et al., Presidential symposium III, Abstract LBA8_PR<br />
Adjuvante Therapie mit Nivolumab erfolgreich. Bei resezierbaren<br />
lokal fortgeschrittenen Tumoren der Speiseröhre<br />
und des gastroösophagealen Übergangs gilt eine trimodale<br />
Therapie mit neoadjuvanter Chemoradiotherapie (CRT)<br />
gefolgt von Operation als Standard. Ein hoher Prozentsatz<br />
der Patienten erleidet jedoch ein Rezidiv, vor allem dann,<br />
wenn keine vollständige pathologische Remission erzielt<br />
wurde. CheckMate 577 (NCT02743494) ist die erste globale<br />
doppelblinde Phase-III-Studie, die einen Checkpoint-Inhibitor<br />
im adjuvanten Setting nach einer trimodalen Therapie<br />
untersuchte. Eingeschlossen waren Patienten mit Adenokarzinomen<br />
oder Plattenepithelkarzinomen (EC, GEJ)<br />
im Stadium II oder III. Neoadjuvante CRT und OP erfolgte<br />
vier bis 16 Wochen vor der 2:1-Randomisierung zwischen<br />
Nivolumab und Placebo für maximal ein Jahr. Es erfolgte<br />
eine Stratifizierung nach Tumorrest (≥ypT1 oder ≥ypN1).<br />
Die Studie erreichte ihren primären Endpunkt eines signifikant<br />
verbesserten krankheitsfreien Überlebens mit einer<br />
beeindruckenden Verdopplung des DFS-Medianwerts:<br />
22,4 vs. 11,0 Monate (HR 0,69; p=0,0003). In allen vordefinierten<br />
Subgruppen war das DFS mit Nivolumab besser<br />
mit HR-Werten im Bereich von 0,54 bis 0,87. Die globale<br />
Lebensqualität war mit Nivolumab und Placebo vergleichbar.<br />
Nivolumab hatte das bereits aus früheren Studien<br />
bekannte Nebenwirkungsprofil ohne weitere Sicherheitssignale.<br />
Dies ist nach der CheckMate 238 bei Melanom die zweite<br />
Studie mit Nivolumab, die im adjuvanten Setting einen<br />
klinisch relevanten Vorteil im DFS zeigen konnte. Diese<br />
Studie repräsentiert für diese Patientengruppe den ersten<br />
Fortschritt seit Jahren und etabliert eventuell einen neuen<br />
Therapiestandard.<br />
Kelly RJ et al., Presidential symposium III, Abstract LBA9_PR<br />
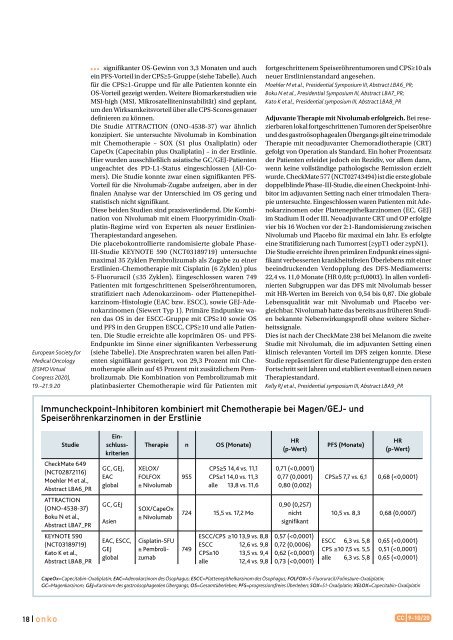
Immuncheckpoint-Inhibitoren kombiniert mit Chemotherapie bei Magen/GEJ- und<br />
Speiseröhrenkarzinomen in der Erstlinie<br />
Studie<br />
Einschlusskriterien<br />
Therapie n OS (Monate)<br />
HR<br />
(p-Wert)<br />
PFS (Monate)<br />
HR<br />
(p-Wert)<br />
CheckMate 649<br />
(NCT02872116)<br />
Moehler M et al.,<br />
Abstract LBA6_PR<br />
GC, GEJ,<br />
EAC<br />
global<br />
XELOX/<br />
FOLFOX<br />
± Nivolumab<br />
955<br />
CPS≥5 14,4 vs. 11,1<br />
CPS≥1 14,0 vs. 11,3<br />
alle 13,8 vs. 11,6<br />
0,71 (