4-2022
Fachzeitschrift für Medizintechnik-Produktion, Entwicklung, Distribution und Qualitätsmanagement
Fachzeitschrift für Medizintechnik-Produktion, Entwicklung, Distribution und Qualitätsmanagement
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Aktuelles<br />
Bestandsprodukte und MDR<br />
Weniger als zwei Jahre Zeit für neue Konformitätsbewertung<br />
Auch etwas mehr als ein Jahr<br />
nach Geltungsbeginn ist das System<br />
rund um die neue EU-Verordnung<br />
über Medizinprodukte (MDR)<br />
noch immer nicht voll funktionsfähig.<br />
Es gibt weiterhin zu wenige<br />
Benannte Stellen. Die Hersteller<br />
von Medizinprodukten haben deswegen<br />
unter anderem Probleme<br />
die erneuten Konformitätsbewertungen<br />
nach der MDR für Bestandsprodukte<br />
durchzuführen.<br />
Autor:<br />
Hans-Peter Bursig,<br />
Geschäftsführer Fachverband<br />
Elektromedizinische Technik<br />
ZVEI<br />
www.zvei.org<br />
Artikel 120 der MDR erlaubt<br />
es Herstellern zwar, ihre Medizinprodukte<br />
mit einer CE-Kennzeichnung<br />
nach der früheren<br />
Medizinprodukte-Richtlinie der<br />
EU (MDD) weiter in den Mitgliedstaaten<br />
der Europäischen Union<br />
in Verkehr zu bringen, solange<br />
die entsprechenden Zertifikate<br />
auf Basis der MDD noch gültig<br />
sind. Dies ist aber an zwei Bedingungen<br />
geknüpft: Zum einen dürfen<br />
an den Medizinprodukten seit<br />
dem Geltungsbeginn der MDR<br />
keine wesentlichen Änderungen<br />
vorgenommen worden sein und<br />
zum anderen endet die Gültigkeit<br />
dieser Zertifikate spätestens<br />
am 26. Mai 2024. Bis zu diesem<br />
Zeitpunkt müssen die Hersteller<br />
ihre Bestandsprodukte also<br />
einer erneuten Konformitätsbewertung<br />
nach der MDR unterzogen<br />
haben, wenn diese Produkte<br />
weiter in Verkehr gebracht<br />
werden sollen.<br />
Aktuelle Übersicht<br />
Nach einer aktuellen Übersicht<br />
der europäischen Arbeitsgemeinschaft<br />
der Benannten Stellen werden<br />
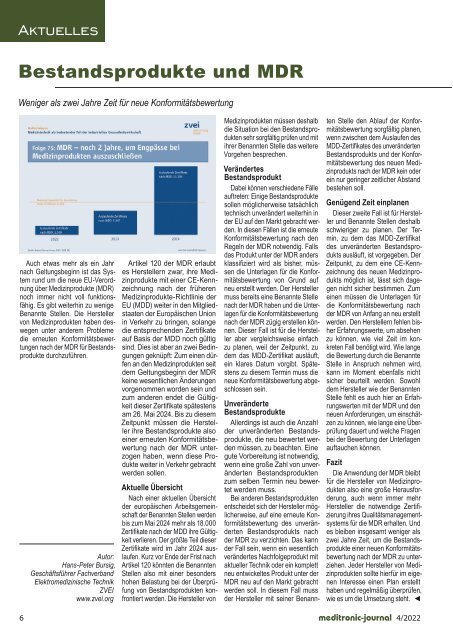
bis zum Mai 2024 mehr als 18.000<br />
Zertifikate nach der MDD ihre Gültigkeit<br />
verlieren. Der größte Teil dieser<br />
Zertifikate wird im Jahr 2024 auslaufen.<br />
Kurz vor Ende der Frist nach<br />
Artikel 120 könnten die Benannten<br />
Stellen also mit einer besonders<br />
hohen Belastung bei der Überprüfung<br />
von Bestandsprodukten konfrontiert<br />
werden. Die Hersteller von<br />
Medizinprodukten müssen deshalb<br />
die Situation bei den Bestandsprodukten<br />
sehr sorgfältig prüfen und mit<br />
ihrer Benannten Stelle das weitere<br />
Vorgehen besprechen.<br />
Verändertes<br />
Bestandsprodukt<br />
Dabei können verschiedene Fälle<br />
auftreten: Einige Bestandsprodukte<br />
sollen möglicherweise tatsächlich<br />
technisch unverändert weiterhin in<br />
der EU auf den Markt gebracht werden.<br />
In diesen Fällen ist die erneute<br />
Konformitätsbewertung nach den<br />
Regeln der MDR notwendig. Falls<br />
das Produkt unter der MDR anders<br />
klassifiziert wird als bisher, müssen<br />
die Unterlagen für die Konformitätsbewertung<br />
von Grund auf<br />
neu erstellt werden. Der Hersteller<br />
muss bereits eine Benannte Stelle<br />
nach der MDR haben und die Unterlagen<br />
für die Konformitätsbewertung<br />
nach der MDR zügig erstellen können.<br />
Dieser Fall ist für die Hersteller<br />
aber vergleichsweise einfach<br />
zu planen, weil der Zeitpunkt, zu<br />
dem das MDD-Zertifikat ausläuft,<br />
ein klares Datum vorgibt. Spätestens<br />
zu diesem Termin muss die<br />
neue Konformitätsbewertung abgeschlossen<br />
sein.<br />
Unveränderte<br />
Bestandsprodukte<br />
Allerdings ist auch die Anzahl<br />
der unveränderten Bestandsprodukte,<br />
die neu bewertet werden<br />
müssen, zu beachten. Eine<br />
gute Vorbereitung ist notwendig,<br />
wenn eine große Zahl von unveränderten<br />
Bestandsprodukten<br />
zum selben Termin neu bewertet<br />
werden muss.<br />
Bei anderen Bestandsprodukten<br />
entscheidet sich der Hersteller möglicherweise,<br />
auf eine erneute Konformitätsbewertung<br />
des unveränderten<br />
Bestandsprodukts nach<br />
der MDR zu verzichten. Das kann<br />
der Fall sein, wenn ein wesentlich<br />
verändertes Nachfolgeprodukt mit<br />
aktueller Technik oder ein komplett<br />
neu entwickeltes Produkt unter der<br />
MDR neu auf den Markt gebracht<br />
werden soll. In diesem Fall muss<br />
der Hersteller mit seiner Benannten<br />
Stelle den Ablauf der Konformitätsbewertung<br />
sorgfältig planen,<br />
wenn zwischen dem Auslaufen des<br />
MDD-Zertifikates des unveränderten<br />
Bestandsprodukts und der Konformitätsbewertung<br />
des neuen Medizinprodukts<br />
nach der MDR kein oder<br />
ein nur geringer zeitlicher Abstand<br />
bestehen soll.<br />
Genügend Zeit einplanen<br />
Dieser zweite Fall ist für Hersteller<br />
und Benannte Stellen deshalb<br />
schwieriger zu planen. Der Termin,<br />
zu dem das MDD-Zertifikat<br />
des unveränderten Bestandsprodukts<br />
ausläuft, ist vorgegeben. Der<br />
Zeitpunkt, zu dem eine CE-Kennzeichnung<br />
des neuen Medizinprodukts<br />
möglich ist, lässt sich dagegen<br />
nicht sicher bestimmen. Zum<br />
einen müssen die Unterlagen für<br />
die Konformitätsbewertung nach<br />
der MDR von Anfang an neu erstellt<br />
werden. Den Herstellern fehlen bisher<br />
Erfahrungswerte, um absehen<br />
zu können, wie viel Zeit im konkreten<br />
Fall benötigt wird. Wie lange<br />
die Bewertung durch die Benannte<br />
Stelle in Anspruch nehmen wird,<br />
kann im Moment ebenfalls nicht<br />
sicher beurteilt werden. Sowohl<br />
dem Hersteller wie der Benannten<br />
Stelle fehlt es auch hier an Erfahrungswerten<br />
mit der MDR und den<br />
neuen Anforderungen, um einschätzen<br />
zu können, wie lange eine Überprüfung<br />
dauert und welche Fragen<br />
bei der Bewertung der Unterlagen<br />
auf tauchen können.<br />
Fazit<br />
Die Anwendung der MDR bleibt<br />
für die Hersteller von Medizinprodukten<br />
also eine große Herausforderung,<br />
auch wenn immer mehr<br />
Hersteller die notwendige Zertifizierung<br />
ihres Qualitätsmanagementsystems<br />
für die MDR erhalten. Und<br />
es bleiben insgesamt weniger als<br />
zwei Jahre Zeit, um die Bestandsprodukte<br />
einer neuen Konformitätsbewertung<br />
nach der MDR zu unterziehen.<br />
Jeder Hersteller von Medizinprodukten<br />
sollte hierfür im eigenen<br />
Interesse einen Plan erstellt<br />
haben und regelmäßig überprüfen,<br />
wie es um die Umsetzung steht. ◄<br />
6 meditronic-journal 4/<strong>2022</strong>