correction exercices Précis de Physique-Chimie chapitre 5 à 9
correction exercices Précis de Physique-Chimie chapitre 5 à 9
correction exercices Précis de Physique-Chimie chapitre 5 à 9
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 5 :<br />
aci<strong>de</strong>s forts et bases fortes.<br />
Contrôle <strong>de</strong>s connaissances<br />
Exercice 1 : Équations <strong>de</strong> dissolution et effet sur le pH<br />
Soluté Équation-bilan <strong>de</strong> dissolution Évolution du pH face à la dilution<br />
HCl (g)<br />
Voir §2.5 <strong>de</strong> ce <strong>chapitre</strong><br />
Le pH augmente avec la dilution,<br />
pour une très gran<strong>de</strong> dilution il<br />
<strong>de</strong>vient égal à 7<br />
KOH (s)<br />
Voir §2.7 <strong>de</strong> ce <strong>chapitre</strong><br />
Le pH diminue avec la dilution,<br />
pour une très gran<strong>de</strong> dilution il<br />
<strong>de</strong>vient égal à 7<br />
NH 3(g)<br />
Voir §2.8 <strong>de</strong> ce <strong>chapitre</strong><br />
Le pH diminue avec la dilution,<br />
pour une très gran<strong>de</strong> dilution il<br />
<strong>de</strong>vient égal à 7<br />
HNO 3(l)<br />
Voir §2.5 <strong>de</strong> ce <strong>chapitre</strong><br />
Le pH augmente avec la dilution,<br />
pour une très gran<strong>de</strong> dilution il<br />
<strong>de</strong>vient égal à 7<br />
NaOH (s)<br />
Voir §2.7 <strong>de</strong> ce <strong>chapitre</strong><br />
Le pH diminue avec la dilution,<br />
pour une très gran<strong>de</strong> dilution il<br />
<strong>de</strong>vient égal à 7<br />
CH 3 COOH (l)<br />
Voir §2.6 <strong>de</strong> ce <strong>chapitre</strong><br />
Le pH augmente avec la dilution,<br />
pour une très gran<strong>de</strong> dilution il<br />
<strong>de</strong>vient égal à 7<br />
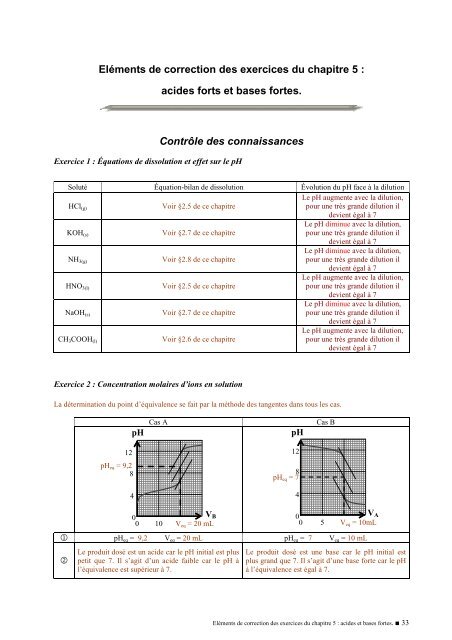
Exercice 2 : Concentration molaires d’ions en solution<br />
La détermination du point d’équivalence se fait par la métho<strong>de</strong> <strong>de</strong>s tangentes dans tous les cas.<br />
pH<br />
Cas A<br />
pH<br />
Cas B<br />
12<br />
12<br />
pH eq = 9,2<br />
8<br />
8<br />
pH eq = 7<br />
4<br />
4<br />
0<br />
V B<br />
0 10 V eq = 20 mL<br />
0<br />
V A<br />
0 5 V eq = 10mL<br />
1 pH eq = 9,2 V eq = 20 mL pH eq = 7 V eq = 10 mL<br />
2<br />
Le produit dosé est un aci<strong>de</strong> car le pH initial est plus<br />
petit que 7. Il s’agit d’un aci<strong>de</strong> faible car le pH à<br />
l’équivalence est supérieur à 7.<br />
Le produit dosé est une base car le pH initial est<br />
plus grand que 7. Il s’agit d’une base forte car le pH<br />
à l’équivalence est égal à 7.<br />
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 5 : aci<strong>de</strong>s et bases fortes. ■ 33
3<br />
Les solutions titrantes sont toujours fortes. dans<br />
notre cas, il s’agit d’une base forte puisque l’on dose<br />
un aci<strong>de</strong>.<br />
Les solutions titrantes sont toujours fortes. dans<br />
notre cas, il s’agit d’un aci<strong>de</strong> fort puisque l’on dose<br />
une base.<br />
pH<br />
Cas C<br />
pH<br />
Cas D<br />
12<br />
12<br />
8<br />
pH eq = 7<br />
4<br />
8<br />
pH eq = 5<br />
4<br />
0<br />
V B<br />
0 15 V eq = 30 mL<br />
0<br />
V A<br />
0 15 V eq = 30 mL<br />
1 pH eq = 7 V eq = 30 mL pH eq = 5 V eq = 30 mL<br />
2<br />
Le produit dosé est un aci<strong>de</strong> car le pH initial est plus<br />
petit que 7. Il s’agit d’un aci<strong>de</strong> fort car le pH à<br />
l’équivalence est égal à 7.<br />
Le produit dosé est une base car le pH initial est<br />
plus grand que 7. Il s’agit d’une base faible car le<br />
pH à l’équivalence est inférieur à 7.<br />
3<br />
Les solutions titrantes sont toujours fortes. dans<br />
notre cas, il s’agit d’une base forte puisque l’on dose<br />
un aci<strong>de</strong>.<br />
Les solutions titrantes sont toujours fortes. dans<br />
notre cas, il s’agit d’un aci<strong>de</strong> fort puisque l’on dose<br />
une base.<br />
La lecture <strong>de</strong>s pH initiaux permet <strong>de</strong> calculer la concentration molaire <strong>de</strong> la solution dosée. Le comportement<br />
asymptotique <strong>de</strong> la courbe <strong>de</strong> dosage permet <strong>de</strong> déterminer la concentration molaire <strong>de</strong> la solution titrante.<br />
C A C B C A C B<br />
Cas B C A = 0,05 mol.L -1 C B = 0,1 mol.L -1 Cas C C A = 1 mol.L -1 C B = 0,5 mol.L -1<br />
Exercice 3 : Réactions acido-basiques<br />
réactifs Équation-bilan Ions spectateurs<br />
solution d’aci<strong>de</strong> chlorhydrique +<br />
+ −<br />
H3O ( aq) + OH ( aq)<br />
= 2H 2<br />
O( l)<br />
solution <strong>de</strong> sou<strong>de</strong><br />
Na + et Cl -<br />
solution d’aci<strong>de</strong> chlorhydrique +<br />
+<br />
+<br />
H3O ( aq)<br />
+ NH3 = NH<br />
( aq)<br />
4( aq)<br />
+ H<br />
2<br />
O( l)<br />
solution d’ammoniaque<br />
Cl -<br />
solution <strong>de</strong> potasse + solution<br />
+ −<br />
H3O ( aq) + OH ( aq)<br />
= 2H 2<br />
O( l)<br />
d’aci<strong>de</strong> nitrique<br />
K + -<br />
et NO 3<br />
solution <strong>de</strong> sou<strong>de</strong> + solution d’aci<strong>de</strong><br />
−<br />
−<br />
CH3 COOH( aq) + OH ( aq)<br />
= CH3 COO( aq) + H<br />
2<br />
O( l)<br />
acétique : CH 3 COOH<br />
Na +<br />
Exercice 4 : Calculs <strong>de</strong> pH lors d’un dosage<br />
Les formules §4.3, §4.4 et §4.5 <strong>de</strong> ce <strong>chapitre</strong> permettent <strong>de</strong> réaliser les calculs.<br />
V 1 5 10 15 19 20 21 25<br />
pH 1,1 1,3 1,6 2 2,8 7 11,2 11,9<br />
34 ■ Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 5 : aci<strong>de</strong>s et bases fortes.
Exercices et extraits d’annales<br />
Exercice 5 : Extrait du BTS Travaux Publics 1997<br />
1.<br />
1.1 Voir §2.5 <strong>de</strong> ce <strong>chapitre</strong>.<br />
1.2 Voir §2.5 <strong>de</strong> ce <strong>chapitre</strong>.<br />
1.3 Voir §3.5 du <strong>chapitre</strong> 4 pour résoudre cette question. On supposera que le mélange est idéal.<br />
Veau ajoutée<br />
= 52,5 mL<br />
1.4 La formule §3.4 <strong>de</strong> ce <strong>chapitre</strong> permet <strong>de</strong> réaliser les <strong>de</strong>ux calculs :<br />
Pour S 1 : pH = 1,9<br />
Pour S 2 : pH = 2,7<br />
2.<br />
2.1 Voir §4.4.1. <strong>de</strong> ce <strong>chapitre</strong>.<br />
2.2<br />
C2 = 1,9.10 mol.<br />
L<br />
−3 −1<br />
Exercice 6 : Extrait du BTS Bâtiment 1998<br />
1.<br />
1.1. La solution d’aci<strong>de</strong> chlorhydrique contient <strong>de</strong>s ions oxonium, <strong>de</strong>s ions chlorure ainsi que <strong>de</strong>s ions<br />
hydroxy<strong>de</strong> très minoritaires dont nous ne calculerons pas la concentration molaire (il manque le produit<br />
ionique <strong>de</strong> l’eau). Voir §3.5 du <strong>chapitre</strong> 4 et §2.5 <strong>de</strong> ce <strong>chapitre</strong>.<br />
[ H O ] = 60.10 mol.<br />
L<br />
+ −3 −1<br />
3 ( aq)<br />
[ Cl ] = 60.10 mol.<br />
L<br />
− −3 −1<br />
( aq)<br />
1.2. Voir § 3.4 <strong>de</strong> ce <strong>chapitre</strong> : pH = 1, 2<br />
1.3. Voir §3.4 du <strong>chapitre</strong> 4 : d<br />
Solution commerciale<br />
= 1, 2<br />
Exercice 7 : Extrait du BTS Étu<strong>de</strong> et Économie <strong>de</strong> la construction 1994<br />
1. Le schéma doit comporter une burette graduée et son support, un bécher <strong>de</strong> dosage, un pH-mètre et son<br />
électro<strong>de</strong>. Le schéma doit comporter les légen<strong>de</strong>s (nom et concentration molaire) <strong>de</strong> la solution titrante et <strong>de</strong> la<br />
solution à titrer.<br />
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 5 : aci<strong>de</strong>s et bases fortes. ■ 35
2. Voir § 4.3 <strong>de</strong> ce <strong>chapitre</strong>.<br />
3. Voir §3.4 <strong>de</strong> ce <strong>chapitre</strong> :<br />
C1 = 10 mol.<br />
L<br />
−2 −1<br />
4. Voir §4.4.1 <strong>de</strong> ce <strong>chapitre</strong> : V1 = 10 mL<br />
5. Il reste <strong>de</strong>s ions oxonium et hydroxy<strong>de</strong> provenant <strong>de</strong> l’autoprotolyse <strong>de</strong> l’eau (voir §2.1 et §2.2 <strong>de</strong> ce <strong>chapitre</strong>),<br />
mais leurs concentrations respectives sont petites (10 -7 mol.L -1 ). Les autres ions présents sont les ions<br />
spectateurs présents dans l’aci<strong>de</strong> et la base. Il faut tenir compte <strong>de</strong> la dilution pour calculer leurs concentrations<br />
respectives à l’équivalence.<br />
[ Na ] = 0,33.10 mol.<br />
L<br />
+ −2 −1<br />
( aq)<br />
[ Cl ] = 0,33.10 mol.<br />
L<br />
− −2 −1<br />
( aq )<br />
Si on évapore le mélange à l’équivalence, on obtiendra du chlorure <strong>de</strong> sodium soli<strong>de</strong> : NaCl<br />
( s)<br />
Exercice 8 : Extrait du BTS Cira 1993<br />
1. Voir §3.1 et §2.2 <strong>de</strong> ce <strong>chapitre</strong> :<br />
[ H O ] = 12,6.10 mol.<br />
L<br />
+ −12 −1<br />
3 ( aq)<br />
[ HO ] = 794.10 mol.<br />
L<br />
− −6 −1<br />
( aq)<br />
2. Voir § 2.8 <strong>de</strong> ce <strong>chapitre</strong>.<br />
⎡ ⎤ ⎡<br />
⎣<br />
⎤<br />
⎦<br />
⎡<br />
⎣<br />
⎤<br />
⎣ ⎦ ⎦ ; application numérique :<br />
3. NH + 4 ( aq) + H3O + ( aq) = OH<br />
−<br />
( aq)<br />
+ −6 −1<br />
= mol L<br />
4( aq)<br />
[ NH ] 794.10 .<br />
4. La relation <strong>de</strong>s proportions stœchiométriques à l’équivalence permet <strong>de</strong> calculer la concentration initiale en<br />
−<br />
ammoniac : C = 40,6.10 mol.<br />
L<br />
3 −1<br />
Exercice 9 : Extrait du BTS Cira 1994<br />
1. Le schéma doit comporter une burette graduée et son support, un bécher <strong>de</strong> dosage, un pH-mètre et son<br />
électro<strong>de</strong>. Le schéma doit comporter les légen<strong>de</strong>s (nom et concentration molaire) <strong>de</strong> la solution titrante et <strong>de</strong> la<br />
solution à titrer.<br />
36 ■ Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 5 : aci<strong>de</strong>s et bases fortes.
2. Pour l'aci<strong>de</strong> HA 1 : pour <strong>de</strong>s raisons <strong>de</strong> lisibilité <strong>de</strong>s résultats, les courbes sont traces sur <strong>de</strong>ux graphes différents.<br />
pH<br />
14<br />
13<br />
12<br />
11<br />
10<br />
9<br />
8<br />
7<br />
6<br />
5<br />
4<br />
3<br />
2<br />
1<br />
0 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 V b [mL]<br />
16<br />
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 5 : aci<strong>de</strong>s et bases fortes. ■ 37
Pour l'aci<strong>de</strong> HA 2 :<br />
pH<br />
14<br />
13<br />
12<br />
11<br />
10<br />
9<br />
8<br />
7<br />
6<br />
5<br />
4<br />
3<br />
2<br />
1<br />
0<br />
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Vb [mL]<br />
3. La lecture <strong>de</strong>s coordonnées <strong>de</strong>s <strong>de</strong>ux points équivalents permet <strong>de</strong> calculer la concentration molaire <strong>de</strong> chacun<br />
<strong>de</strong>s <strong>de</strong>ux aci<strong>de</strong>s.<br />
Pour l'aci<strong>de</strong> HA 1 :<br />
C1 = 0,1 mol.<br />
L −<br />
1<br />
Pour l'aci<strong>de</strong> HA 2 :<br />
C2 = 0,1 mol.<br />
L −<br />
1<br />
Le pH à l’équivalence <strong>de</strong> chacune <strong>de</strong>s <strong>de</strong>ux courbes permet <strong>de</strong> conclure sur la nature <strong>de</strong> chaque aci<strong>de</strong>. HA 1 est<br />
un aci<strong>de</strong> fort. AH 2 est un aci<strong>de</strong> faible (voir §4.4.1 <strong>de</strong> ce <strong>chapitre</strong>).<br />
Exercice 10 : Extrait du BTS Travaux Publics 2002<br />
1. Le calcul <strong>de</strong> la quantité <strong>de</strong> matière permet ensuite <strong>de</strong> calculer la concentration molaire <strong>de</strong> la sou<strong>de</strong>. On en déduit<br />
ensuite le pH par la formule classique pour les monobases fortes :<br />
Cb<br />
= 0,15 mol.<br />
L −<br />
1<br />
pH = 13, 2<br />
2.<br />
2.1. Voir §4.3 <strong>de</strong> ce <strong>chapitre</strong>.<br />
38 ■ Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 5 : aci<strong>de</strong>s et bases fortes.
2.2. La relation <strong>de</strong>s proportions stœchiométriques à l’équivalence permet <strong>de</strong> calculer la concentration molaire<br />
<strong>de</strong> l’aci<strong>de</strong> dosé :<br />
Ca<br />
= 0,11 mol.<br />
L −<br />
1<br />
2.3. Pour le point initial : V = 0 mL ; pH = 0,96<br />
b<br />
initial<br />
Pour le point à l’équivalence : V = 0 mL ; pH = 7<br />
beq<br />
eq<br />
Pour un volume <strong>de</strong> base infini, la courbe tend vers une asymptote horizontale: V = ∞ ; pH = 13, 2<br />
b∞<br />
∞<br />
pH<br />
14<br />
12<br />
10<br />
8<br />
6<br />
4<br />
2<br />
0<br />
Vb [mL]<br />
0 2 4 6 8 10 12 14 16 18 20 22 24<br />
3. Le résidu obtenu est du chlorure <strong>de</strong> sodium soli<strong>de</strong> : NaCl<br />
( s)<br />
La masse formée vaut :<br />
m = 0,128 g<br />
NaCl<br />
Exercice 11 : Extrait du BTS Travaux Publics 2005<br />
1. Voir §2.4 du <strong>chapitre</strong> 4.<br />
2. n = 0,30 mol<br />
A<br />
3. n = 1,0 mol<br />
A<br />
4. L’équation bilan est i<strong>de</strong>ntique à celle du dosage. la base étant en excès par rapport à l’aci<strong>de</strong> la formule du §5.4<br />
permet <strong>de</strong> calculer le pH :<br />
pH = 13,7<br />
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 5 : aci<strong>de</strong>s et bases fortes. ■ 39
Exercice 12 : Extrait du BTS Bâtiment 2002<br />
1.<br />
1.1. Voir §1.3.1 <strong>de</strong> ce <strong>chapitre</strong> pour le nom et la formule <strong>de</strong> cet ion.<br />
[ H O ] = 10 mol.<br />
L<br />
+ −2 −1<br />
3 ( aq)<br />
n<br />
+ =<br />
H3 O( aq )<br />
14 mol<br />
1.2. Voir §2.2 <strong>de</strong> ce <strong>chapitre</strong> :<br />
[ OH ] = 10 mol.<br />
L<br />
− −12 −1<br />
( aq)<br />
1.3.<br />
[ Cl ] = 10 mol.<br />
L<br />
− −2 −1<br />
( aq)<br />
2. Pour neutraliser l’aci<strong>de</strong>, il faut ajouter une quantité <strong>de</strong> base permettant d’atteindre exactement l’équivalence.<br />
l’équation bilan est donnée §4.3 <strong>de</strong> ce <strong>chapitre</strong> :<br />
n<br />
− =<br />
HO( aq )<br />
14 mol<br />
3.<br />
3.1.<br />
Ca<br />
= 12,6.10 mol.<br />
L<br />
−3 −1<br />
pH = 1,9<br />
3.2. n<br />
NaOH<br />
= 17,7 mol<br />
m = 710 g<br />
NaOH<br />
Exercice 13 : Extrait du BTS Bâtiment 1997<br />
Question 1 2 3 4<br />
Réponse B A B D<br />
Exercice 14 : Extrait du BTS Bâtiment 2001<br />
Question 1 2 3a 3b<br />
Réponse B D A C<br />
Exercice 15 : Extrait du BTS Travaux Publics 1992<br />
1.<br />
1.1.<br />
Cb<br />
= 0,02 mol.<br />
L −<br />
1<br />
40 ■ Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 5 : aci<strong>de</strong>s et bases fortes.
1.2.<br />
[ OH ] = 0,02 mol.<br />
L<br />
−<br />
( aq )<br />
−1<br />
[ Na ] = 0,02 mol.<br />
L<br />
+ −1<br />
( aq)<br />
[ H O ] = 5.10 mol.<br />
L<br />
+ −13 −1<br />
3 ( aq)<br />
1.3. pH = 12,3<br />
2.<br />
2.1. A l’équivalence, les proportions sont stœchiométriques, la seule réaction est alors celle <strong>de</strong> l’autoprotolyse<br />
<strong>de</strong> l’eau : H<br />
2<br />
O( )<br />
= H3 O + ( )<br />
+ OH<br />
−<br />
( )<br />
2<br />
l aq aq<br />
2.2.<br />
c1 = 0,0201 mol.<br />
L −<br />
1<br />
3. v = 1 L<br />
Exercice 16 : Extrait du BTS Étu<strong>de</strong> et Économie <strong>de</strong> la construction 2003<br />
1. Voir §2.7 <strong>de</strong> ce <strong>chapitre</strong>.<br />
2. m<br />
NaOH<br />
= 16 kg<br />
3.<br />
3.1. pH<br />
aci<strong>de</strong><br />
= 2<br />
3.2. Pour l’équation bilan voir §4.3 <strong>de</strong> ce <strong>chapitre</strong>.<br />
[ OH ] = 9,5.10 mol.<br />
L<br />
− −3 −1<br />
( aq)<br />
3.3.<br />
[ OH ]' = 0,95 mol.<br />
L<br />
−<br />
( aq)<br />
−1<br />
Cette concentration est inférieure à 1 mol.L -1 . La solution n’est donc plus utilisable.<br />
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 5 : aci<strong>de</strong>s et bases fortes. ■ 41
42 ■ Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 5 : aci<strong>de</strong>s et bases fortes.
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 6 :<br />
Oxydoréduction : application à la protection contre la corrosion et<br />
aux dosages rédox.<br />
Contrôle <strong>de</strong>s connaissances<br />
Exercice 1 : écriture <strong>de</strong> ½ équations rédox<br />
Voir § 1.5 <strong>de</strong> ce <strong>chapitre</strong>.<br />
Couple rédox ½ équation rédox Couple rédox ½ équation rédox<br />
2<br />
Fe<br />
+ / Fe<br />
Fe 2+<br />
2e −<br />
3 2<br />
+ = Fe<br />
Fe<br />
+ / Fe<br />
+ 3 + −<br />
Fe e Fe<br />
2 +<br />
+ =<br />
O / H O O<br />
2 2<br />
2<br />
+4H + ( ) ( )<br />
4 2<br />
g aq<br />
e − H<br />
2<br />
O( l)<br />
Cl / Cl − 2 ( g )<br />
+ = O / OH − O<br />
2 2<br />
+2H ( ) 2<br />
O( )<br />
4 4<br />
g<br />
l<br />
+ e − = HO<br />
− −<br />
+<br />
Cl2 + 2e = 2Cl<br />
H / H<br />
( aq ) 2<br />
+ −<br />
( aq) + =<br />
2 ( )<br />
2H 2e H<br />
g<br />
−<br />
( aq)<br />
Exercice 2 : Applications <strong>de</strong> la règle du gamma<br />
L’application <strong>de</strong> la règle du gamma permet <strong>de</strong> connaître la possibilité ou non d’une réaction :<br />
Métal + solution ionique Réaction : oui/non Équation-bilan<br />
Lame <strong>de</strong> fer + sulfate <strong>de</strong> cuivre (II) Oui<br />
Cu + Fe = Cu + Fe<br />
Lame <strong>de</strong> cuivre + sulfate <strong>de</strong> fer (II) Non<br />
Lame <strong>de</strong> zinc + chlorure <strong>de</strong> fer (II) Oui<br />
Lame <strong>de</strong> cuivre + chlorure d’étain Non<br />
2+ 2+<br />
( aq) ( s) ( s) ( aq)<br />
Fe + Zn = Fe + Zn<br />
2+ 2+<br />
( aq) ( s) ( s) ( aq)<br />
Exercice 3 : Association <strong>de</strong> <strong>de</strong>mi-pile<br />
Voir §5.2 <strong>de</strong> ce <strong>chapitre</strong> :<br />
On suppose pH = 0 et<br />
que toutes les solutions<br />
dans lesquelles plongent<br />
les lames métalliques<br />
sont à la concentration :<br />
C = 1 mol.L -1<br />
U<br />
V<br />
e - I<br />
+<br />
Ano<strong>de</strong> Catho<strong>de</strong><br />
+<br />
Catho<strong>de</strong><br />
U<br />
V<br />
I e -<br />
Ano<strong>de</strong><br />
Compartiment <strong>de</strong> gauche Lame <strong>de</strong> fer + sulfate <strong>de</strong> fer (II) Lame <strong>de</strong> fer + chlorure <strong>de</strong> fer (II)<br />
Compartiment <strong>de</strong> droite Lame <strong>de</strong> cuivre + sulfate <strong>de</strong> cuivre (II) Lame <strong>de</strong> zinc + chlorure <strong>de</strong> zinc (II)<br />
Ano<strong>de</strong> Lame <strong>de</strong> fer (côté oxydation) Lame <strong>de</strong> zinc (côté oxydation)<br />
Catho<strong>de</strong> Lame <strong>de</strong> cuivre (côté réduction) Lame <strong>de</strong> fer (côté réduction)<br />
Équation-bilan<br />
2+ Cu + Fe = Cu<br />
2+<br />
+ Fe<br />
2+ Fe + Zn = Fe<br />
2+<br />
+ Zn<br />
( aq) ( s) ( s) ( aq)<br />
( aq) ( s) ( s) ( aq)<br />
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 6 : Oxydoréduction : application à la protection contre la corrosion et aux dosages rédox ■ 43
0 0<br />
Valeur <strong>de</strong> la tension U U = E 2+ − E 2+<br />
= 0 78 V<br />
,<br />
Cu( aq ) / Cu( s ) Fe( aq ) / Fe( s )<br />
U = E − E = −0 32 V<br />
0 0<br />
2+ 2+<br />
,<br />
Zn( aq ) / Zn( s ) Fe( aq ) / Fe( s )<br />
La tension est ici négative car elle est<br />
orientée du + vers le -<br />
Exercice 4 : Immunité d’un métal<br />
Voir §5.3 <strong>de</strong> ce <strong>chapitre</strong> :<br />
E ( V)<br />
E ( V)<br />
O 2(g)<br />
H 2 O (l)<br />
1,23 V<br />
O 2(g)<br />
H 2 O (l)<br />
1,23 V<br />
Cu 2+ (aq)<br />
Cu (S)<br />
0,34 V<br />
Fe 2+ (aq)<br />
Fe (S)<br />
-0,44 V<br />
Fe 2+ (aq)<br />
Fe (S)<br />
- 0,44 V<br />
Sn 2+ (aq)<br />
Sn (S)<br />
- 0,76 V<br />
Revêtement Cuivre Etain<br />
Métal<br />
corrodé<br />
Fer<br />
Etain<br />
Métal<br />
immunisé<br />
Cuivre<br />
Fer<br />
Protection<br />
assurée<br />
Oui, le fer est plongé dans son<br />
Non, le fer est corrodé<br />
après<br />
domaine d’immunité<br />
rayure ?<br />
E ( V)<br />
E (V)<br />
O 2(g)<br />
Fe 2+ (aq)<br />
Ni 2+ (aq)<br />
H 2 O (l)<br />
Fe (S)<br />
Ni (S)<br />
1,23 V<br />
- 0,44 V<br />
- 2,38 V<br />
O<br />
H O<br />
l<br />
2( g)<br />
2 ( )<br />
2<br />
Fe + Fe<br />
( aq)<br />
( s)<br />
2<br />
Zn + Zn<br />
( aq)<br />
( s)<br />
1,23 V<br />
-0,44 V<br />
-0,76 V<br />
Remarque : l’application <strong>de</strong> la règle<br />
du gamma montre que le fer <strong>de</strong>vrait<br />
être immunisé. Dans la réalité, le<br />
nickel est passivé ce qui le rend<br />
moins réducteur que le fer. Les<br />
résultats ci-<strong>de</strong>ssous tiennent compte<br />
<strong>de</strong> ce fait.<br />
Revêtement Nickel Zinc<br />
Métal<br />
corrodé<br />
Fer<br />
Zinc<br />
Métal<br />
Nickel passivé<br />
Fer<br />
immunisé<br />
Protection<br />
assurée<br />
après<br />
rayure ?<br />
Non, le fer est corrodé<br />
Oui, le fer est plongé dans son<br />
domaine d’immunité<br />
44 ■ Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 6 : Oxydoréduction : application à la protection contre la corrosion et aux dosages rédox.
Exercices et extraits d’annales<br />
Exercice 5 : Extrait du BTS Travaux Publics 2003<br />
1. Il s’agit d’une erreur, cette question est à supprimer.<br />
2.<br />
2.1. Le sens <strong>de</strong> la réaction est justifié à l’ai<strong>de</strong> <strong>de</strong> la règle du gamma. L’ion permanganate joue le rôle<br />
d’oxydant.<br />
2.2. Voir §6 <strong>de</strong> ce <strong>chapitre</strong>.<br />
2.3.<br />
- 2+ 2- +<br />
4<br />
+<br />
2<br />
+<br />
2<br />
= +<br />
4<br />
+<br />
2 MnO 5 SO 2 H O 2 Mn 5 SO 4 H<br />
2.4. A l’équivalence, la relation <strong>de</strong>s proportions stœchiométriques permet <strong>de</strong> trouver le facteur 5/2.<br />
3.<br />
3.1. Voir §6 <strong>de</strong> ce <strong>chapitre</strong>.<br />
3.2. CSO<br />
2<br />
= 5,0.10 mol.<br />
L<br />
−2 −1<br />
Exercice 6 : Extrait du BTS Travaux Publics 1995<br />
1. L’application <strong>de</strong> la règle du gamma permet <strong>de</strong> montrer que l’oxydant est l’ion permanganate tandis que le<br />
réducteur est le dioxy<strong>de</strong> <strong>de</strong> soufre. Voir §6 <strong>de</strong> ce <strong>chapitre</strong> pour le repérage <strong>de</strong> la fin <strong>de</strong> réaction.<br />
2. La relation <strong>de</strong>s proportions stœchiométriques à l’équivalence permet <strong>de</strong> trouver la relation entre les <strong>de</strong>ux<br />
quantités <strong>de</strong> matière.<br />
n<br />
−<br />
MnO4<br />
= 62,5.10<br />
−6<br />
mol<br />
3. nSO<br />
2<br />
= 156.10<br />
−6<br />
mol<br />
4. nSO<br />
' = 7,81.10<br />
2<br />
−3<br />
mol<br />
5. m<br />
S<br />
= 0, 25 g<br />
Cette masse est inférieure au 0,3 g requis par la législation. La teneur en soufre est donc conforme à la loi.<br />
Exercice 7 : Extrait du BTS Bâtiment 2004<br />
1. La donnée <strong>de</strong>s potentiels (qui en fait ne sont pas standards pour le couple O 2 /OH - ) montre que l’oxydant le plus<br />
fort est O 2 .<br />
2.<br />
3<br />
Al + + 3e − = Al<br />
O +2H O + 4e − = 4HO<br />
3. 2( g ) 2 ( l )<br />
−<br />
( aq)<br />
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 6 : Oxydoréduction : application à la protection contre la corrosion et aux dosages rédox ■ 45
Pour le rôle joué par O 2 voir §1.5 <strong>de</strong> ce <strong>chapitre</strong>.<br />
4. Voir § 1.6 <strong>de</strong> ce <strong>chapitre</strong>.<br />
5. L’équation bilan à prendre en compte pour la résolution <strong>de</strong> cette question est la suivante :<br />
3 O +6H O + 4Al = 4 Al( OH )<br />
2( g ) 2 ( l) ( s) 3( s )<br />
En supposant la réaction totale et dans les proportions stœchiométriques, le bilan chimique donne :<br />
m = 5,5 g<br />
Al<br />
Exercice 8 : Extrait du BTS Travaux Publics 1993<br />
1.1.<br />
2<br />
Fe + 2e − Fe<br />
+ = et<br />
2<br />
Zn = Zn + + 2e<br />
−<br />
Pour préciser la nature <strong>de</strong>s réactions ayant lieu sur chacune <strong>de</strong>s <strong>de</strong>ux électro<strong>de</strong>s, voir §2.5 <strong>de</strong> ce <strong>chapitre</strong>.<br />
1.2.<br />
Fe + Zn = Fe + Zn<br />
2+ 2+<br />
( aq) ( s) ( s) ( aq)<br />
Pour la notion <strong>de</strong> protection par le zinc, voir §5.4 <strong>de</strong> ce <strong>chapitre</strong>.<br />
1.3. Pour la polarité <strong>de</strong> la pile voir §2.5 <strong>de</strong> ce <strong>chapitre</strong>.<br />
U = E − E = 0 32 V<br />
0 0<br />
2+ 2+<br />
,<br />
Fe( aq ) / Fe( s ) Zn( aq ) / Zn( s )<br />
2. Voir §3.2 <strong>de</strong> ce <strong>chapitre</strong> pour le bilan molaire dans les proportions stœchiométriques. Il faut ensuite tenir<br />
compte du % <strong>de</strong> zinc effectivement consommé. On obtient ainsi : m = 4,5 kg<br />
Zn<br />
Exercice 9 : Extrait du BTS Travaux Publics 1990<br />
1. Voir §5.4 <strong>de</strong> ce <strong>chapitre</strong><br />
2<br />
Zn = Zn + + 2e<br />
−<br />
2. Voir 3.2 <strong>de</strong> ce <strong>chapitre</strong> :<br />
6<br />
Q = 15.10 C<br />
3. Voir §3.1 <strong>de</strong> ce <strong>chapitre</strong> : τ<br />
Pr otection<br />
= 10 ans et 145 jours<br />
Exercice 10 : Extrait du BTS Bâtiment 1998<br />
1. Voir §5.4 <strong>de</strong> ce <strong>chapitre</strong>.<br />
2. Voir §5.4 <strong>de</strong> ce <strong>chapitre</strong>.<br />
2<br />
Mg = Mg + + 2e<br />
−<br />
3. La canalisation joue le rôle <strong>de</strong> catho<strong>de</strong>.<br />
4. Voir §3.2 <strong>de</strong> ce <strong>chapitre</strong> pour le bilan molaire dans les proportions stœchiométriques. Il faut ensuite tenir<br />
compte du % <strong>de</strong> zinc effectivement consommé. On obtient ainsi : m = 150 g<br />
Mg<br />
46 ■ Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 6 : Oxydoréduction : application à la protection contre la corrosion et aux dosages rédox.
Exercice 11 : Extrait du BTS Bâtiment 2002<br />
1. L’application <strong>de</strong> la règle du gamma permet d’expliquer pourquoi le zinc est attaqué par les pluies aci<strong>de</strong>s et<br />
pourquoi le cuivre ne l’est pas.<br />
2. L’application <strong>de</strong> la formule fournie par l’énoncé donne : m = 16,5 g<br />
Cette masse correspond à une épaisseur :<br />
e = 4,8 µ m<br />
La consommation totale <strong>de</strong> la plaque permet <strong>de</strong> calculer la durée <strong>de</strong> vie maximale :<br />
τ<br />
Max<br />
=<br />
208 ans<br />
+ 2+<br />
3. H3 O( aq) + Zn( s) = H<br />
2<br />
O( l) + H<br />
2<br />
+ Zn<br />
( ) ( aq)<br />
2 2<br />
g<br />
4. Le bilan chimique <strong>de</strong> la réaction dans les proportions stœchiométriques permet <strong>de</strong> montrer :<br />
n + = 0,50 mol<br />
H3O<br />
Vpluie<br />
= 0,51 m<br />
3<br />
Exercice 12 : Extrait du BTS Étu<strong>de</strong> et Économie <strong>de</strong> la construction 1998<br />
1.1. L’application <strong>de</strong> la règle du gamma permet <strong>de</strong> montrer que la seule réaction possible est :<br />
Cu + Fe = Cu + Fe<br />
2+ 2+<br />
( aq) ( s) ( s) ( aq )<br />
Remarque : les ions sulfate sont spectateurs, ils ne participent pas à la réaction.<br />
1.2. L’application <strong>de</strong> la règle du gamma permet <strong>de</strong> montrer qu’aucune réaction ne se produit.<br />
2.<br />
2.1. Cette question comporte une grosse erreur car les <strong>de</strong>ux possibilités sont envisageables (voir §5.5 <strong>de</strong> ce<br />
<strong>chapitre</strong>)<br />
2.2. Voir §5.4 <strong>de</strong> ce <strong>chapitre</strong>.<br />
Le magnésium est également envisageable comme ano<strong>de</strong> sacrificielle. Par contre le cuivre ne l’est pas.<br />
3.<br />
3.1. Voir §5.4 <strong>de</strong> ce <strong>chapitre</strong> :<br />
2<br />
Zn = Zn + + 2e<br />
−<br />
3.2. Voir §3.2 <strong>de</strong> ce <strong>chapitre</strong> :<br />
τ = 14 ans<br />
Max<br />
6<br />
Q = 15.10 C<br />
Exercice 13 : Extrait du BTS Étu<strong>de</strong> et Économie <strong>de</strong> la construction 2005<br />
La relecture <strong>de</strong>s <strong>chapitre</strong>s 5 et 6 permet <strong>de</strong> trouver dans le cours toutes les justifications aux réponses citées ci<strong>de</strong>ssous<br />
:<br />
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 6 : Oxydoréduction : application à la protection contre la corrosion et aux dosages rédox ■ 47
48 ■ Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 6 : Oxydoréduction : application à la protection contre la corrosion et aux dosages rédox.
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 7 :<br />
chimie organique ; synthèse <strong>de</strong> polymères.<br />
Contrôle <strong>de</strong>s connaissances<br />
Exercice 1 : Nomenclature et formules moléculaires<br />
Formule<br />
semidéveloppée<br />
CH 3 C<br />
CH 3<br />
CH 2<br />
CH 3 CH 2 CH 3<br />
CH 2 CH 2<br />
Formule<br />
brute<br />
C 4 H 8 C 3 H 8 C 2n H 4n<br />
Nom méthylpropène propane polyéthylène<br />
n<br />
CH<br />
CH 2<br />
Formule<br />
semidéveloppée<br />
Remarque : le<br />
noyau<br />
benzénique a<br />
été laissé sous<br />
forme<br />
topologique<br />
pour ne pas<br />
surcharger<br />
l’écriture.<br />
CH 2 CH CH 3<br />
CH 2 CH 3<br />
Formule<br />
brute<br />
C 8 H 8 C 3 H 6 C 2 H 3 Cl<br />
Nom Styrène propène chloroéthane<br />
Cl<br />
Exercice 2 : Equations-bilans<br />
Réaction<br />
Équation-bilan<br />
Combustion complète du méthylpropane<br />
13<br />
C<br />
Voir §3.3.1 <strong>de</strong> ce <strong>chapitre</strong><br />
4H10 + O2 = 4CO2 + 5H 2O<br />
2<br />
Combustion complète <strong>de</strong> l’acétylène<br />
5<br />
C H + O = 2CO + H O<br />
Voir §3.3.1 <strong>de</strong> ce <strong>chapitre</strong> ( g )<br />
( )<br />
2 2 2 2 g 2 ( g )<br />
2<br />
Addition <strong>de</strong> chlorure d’hydrogène sur l’éthylène<br />
C H + HCl = C H Cl<br />
2 4 2 5<br />
Voir §5.3 <strong>de</strong> ce <strong>chapitre</strong><br />
Polymérisation du chlorure <strong>de</strong> vinyle :<br />
n CH CH 2 =<br />
CH CH 2<br />
Voir §7.4.1 et §7.4.2 <strong>de</strong> ce <strong>chapitre</strong><br />
Cl<br />
Cl<br />
n<br />
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 7 : chimie organique ; synthèse <strong>de</strong> polymères ■ 49
Exercice 3 : Obtention <strong>de</strong>s hydrocarbures<br />
1. Les alcanes sont obtenus par distillation <strong>de</strong>s pétroles.<br />
2. Voir §5.1 <strong>de</strong> ce <strong>chapitre</strong>.<br />
Exercice 4 : Extrait BTS Bâtiment 2001<br />
Il manque un cœfficient stœchiométrique 2 <strong>de</strong>vant C 8 H 18 pour la réponse A.<br />
Question n° 1 2<br />
Réponse A C<br />
Exercice 5 : Combustion complète d’alcanes<br />
1. La combustion complète d’un alcane (dans l’air ou le dioxygène) libère comme seuls produits du dioxy<strong>de</strong> <strong>de</strong><br />
carbone et <strong>de</strong> l’eau :<br />
méthane CH4 + 2O2 = CO2 + 2H 2O<br />
octane<br />
25<br />
C8 H18 + O2 = 8CO2 + 9H2O<br />
2<br />
pentadécane C15 H32 + 23O2 = 15CO2 + 16H 2O<br />
2. Il est nécessaire <strong>de</strong> commencer par calculer la masse puis la quantité <strong>de</strong> matière comprise dans 1L <strong>de</strong> chacun <strong>de</strong><br />
ces composés :<br />
méthane octane pentadécane<br />
Masse d’alcane brûlé 424 g 703 g 769 g<br />
Masse molaire M(CH 4 ) = 16 g.mol -1 M(C 8 H 18 ) = 114 g.mol -1 M(C 15 H 32 ) = 212 g.mol -1<br />
n Alcane 26,5 mol 6,17 mol 3,63 mol<br />
Il faut ensuite écrire la relation <strong>de</strong>s proportions stœchiométriques :<br />
méthane octane pentadécane<br />
Relation <strong>de</strong>s proportions<br />
nCO<br />
= n<br />
2 CH<br />
n<br />
4<br />
CO<br />
8n<br />
2 C8H<br />
n 15<br />
18<br />
CO<br />
= nC H<br />
stœchiométriques<br />
On peut ainsi en déduire la quantité <strong>de</strong> matière <strong>de</strong> CO 2 formée dans chacun <strong>de</strong>s trois cas :<br />
=<br />
2 15 32<br />
méthane octane pentadécane<br />
n(CO 2 ) 26,5 mol 49,3 mol 54,4 mol<br />
Il ne reste plus qu’à multiplier les résultats précé<strong>de</strong>nts par le volume molaire <strong>de</strong>s gaz parfaits pour trouver les<br />
résultats recherchés :<br />
méthane octane pentadécane<br />
V(CO 2 ) 663 L 1,23 m 3 1,36 m 3<br />
50 ■ Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 7 : chimie organique ; synthèse <strong>de</strong> polymères.
Exercices et extraits d’annales<br />
Exercice 6 : Extrait du BTS Cira 1994<br />
1. Voir §2.4.1 <strong>de</strong> ce <strong>chapitre</strong>.<br />
2. La formule du §1.4 du <strong>chapitre</strong> 10 (également présente dans les données <strong>de</strong> l’exercice) permet <strong>de</strong> calculer la<br />
3.<br />
4.<br />
masse molaire recherchée :<br />
M = 56 g.mol<br />
Alcène<br />
-1<br />
La masse molaire <strong>de</strong>s alcènes peut s’exprimer en fonction du nombre n d’atome <strong>de</strong> carbone présents dans cette<br />
molécule (voir question 3 <strong>de</strong> l’exercice 7 du <strong>chapitre</strong> 2). On peut ainsi en déduire n puis la formule brute <strong>de</strong><br />
l’alcène recherché : C4H<br />
8<br />
H<br />
H<br />
Priv<br />
C<br />
H<br />
Priv<br />
H<br />
H<br />
H<br />
H<br />
H<br />
Priv<br />
H<br />
Priv<br />
C<br />
C<br />
H<br />
Priv<br />
C<br />
H<br />
H<br />
Priv<br />
H<br />
Priv<br />
C<br />
H<br />
Priv<br />
C<br />
H<br />
Priv<br />
C<br />
H<br />
Priv<br />
C<br />
H<br />
Priv<br />
H<br />
Priv<br />
H<br />
Priv<br />
H<br />
Priv<br />
H<br />
Priv<br />
C<br />
C<br />
H<br />
Priv<br />
C<br />
H<br />
Priv<br />
C<br />
H<br />
(E)-but-2-ène (Z)-but-2-ène but-1-ène<br />
Remarque : un autre isomère est possible, il s‘agit du méthylpropène :<br />
H<br />
H<br />
C<br />
H<br />
Priv<br />
C<br />
C<br />
H<br />
Priv<br />
H<br />
Priv<br />
H<br />
Priv<br />
C<br />
H<br />
Priv<br />
H<br />
Priv<br />
5. C H + Cl = C H Cl<br />
4 8 2 4 8 2<br />
En partant <strong>de</strong> l’un <strong>de</strong>s <strong>de</strong>ux diastéréo-isomères du but-2-ène on obtient le 2,3-dichlorobutane.<br />
En partant du but-1-ène on obtient le 1,2-dichlorobutane.<br />
Exercice 7 : Extrait du BTS Travaux Publics 1996<br />
1.<br />
1.1. Ces <strong>de</strong>ux molécules font partie <strong>de</strong> la famille <strong>de</strong>s hydrocarbures. Pour leurs noms systématiques voir §2.3.1<br />
<strong>de</strong> ce <strong>chapitre</strong>.<br />
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 7 : chimie organique ; synthèse <strong>de</strong> polymères ■ 51
1.2. Voir 1.1 et 1.2 <strong>de</strong> ce <strong>chapitre</strong>.<br />
2. Voir §3.2.1 <strong>de</strong> ce <strong>chapitre</strong>.<br />
3.<br />
3.1. m = 504 g<br />
7 6<br />
C H l<br />
mC 216<br />
8H l<br />
= g<br />
8<br />
3.2. On suppose une combustion complète dans les proportions stœchiométriques. Il faut alors réaliser <strong>de</strong>ux<br />
bilans chimiques (un pour chacun <strong>de</strong>s composés). Le volume <strong>de</strong> dioxygène nécessaire est alors la somme<br />
<strong>de</strong>s <strong>de</strong>ux résultats obtenus pour chaque bilan : V<br />
O<br />
= 1,8 m<br />
2<br />
3<br />
3.3. Voir § 3.1 <strong>de</strong> ce <strong>chapitre</strong> :<br />
V = 8,9 m<br />
Air<br />
3<br />
4.<br />
4.1. Voir §7.4.1 <strong>de</strong> ce <strong>chapitre</strong>.<br />
4.2. Voir §7.4.2 <strong>de</strong> ce <strong>chapitre</strong>.<br />
4.3. Voir §7.3.1 <strong>de</strong> ce <strong>chapitre</strong> : n = 1430<br />
Exercice 8 : Extrait du BTS Bâtiment 1997<br />
1.<br />
CH 3<br />
CH 3 CH 2 CH 2 CH 2 CH 2 CH 3<br />
CH 3 CH CH 2 CH 2 CH 3<br />
CH 3 C CH 2 CH 3<br />
CH 3<br />
CH 3<br />
n-hexane 2-méthylpentane 2,2-diméthylbutane<br />
Pour la notion d’isomérie voir 2.2 <strong>de</strong> ce <strong>chapitre</strong>.<br />
2. Voir §3.2.1 <strong>de</strong> ce <strong>chapitre</strong>.<br />
3.<br />
3.1. Après calcule <strong>de</strong> la quantité <strong>de</strong> matière <strong>de</strong> carburant utilisé, la donnée du PCI permet d’obtenir :<br />
Q =<br />
8<br />
2,93.10<br />
J<br />
3.2. Un bilan chimique <strong>de</strong> la combustion complète dans les proportions stœchiométriques permet <strong>de</strong> montrer<br />
que : V<br />
CO<br />
= 10 m<br />
2<br />
3<br />
52 ■ Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 7 : chimie organique ; synthèse <strong>de</strong> polymères.
Exercice 9 : Extrait du BTS Bâtiment 1999<br />
1. Voir §2.1.2 <strong>de</strong> ce <strong>chapitre</strong>.<br />
2. Voir §7.4.1 et §7.4.2 <strong>de</strong> ce <strong>chapitre</strong>.<br />
3. Voir §7.3.1 <strong>de</strong> ce <strong>chapitre</strong> : n = 250<br />
4. Voir §3.2.1 <strong>de</strong> ce <strong>chapitre</strong>.<br />
5. Le calcul préalable <strong>de</strong> la quantité <strong>de</strong> matière consommée permet <strong>de</strong> calculer l’énergie libérée par la<br />
combustion : Q = 218 kJ<br />
6. W = 65,5 kJ<br />
élec<br />
7. Voir §1.8 du <strong>chapitre</strong> 9 : t = 18 min<br />
Une combustion n’est jamais totalement complète. D’autre part, les ren<strong>de</strong>ments sont toujours connus avec une<br />
précision assez faible. Enfin, le fabriquant a très certainement pris une marge <strong>de</strong> sécurité sur le résultat fourni<br />
afin <strong>de</strong> ne pas être attaqué pour publicité mensongère.<br />
Exercice 10 : Extrait du BTS Travaux Publics 1998<br />
1. Voir §2.3.1 <strong>de</strong> ce <strong>chapitre</strong>.<br />
2. Voir §2.3.2 <strong>de</strong> ce <strong>chapitre</strong>.<br />
3. Les <strong>de</strong>ux mol écules sont le butane et le méthylpropane. Les formules développées sont simples à trouver après<br />
lecture du §2.3.3 <strong>de</strong> ce <strong>chapitre</strong>. Voir §2.2 pour la <strong>de</strong>rnière partie <strong>de</strong> la question.<br />
4.<br />
4.1. L’équation squelette (non équilibrée) est la suivante : C6H12O6 = CO2 + CH<br />
4<br />
4.2. Un bilan chimique dans les proportions stœchiométriques permet <strong>de</strong> montrer : mC6 Hl<br />
2O6<br />
=<br />
3<br />
1,58.10 k<br />
g<br />
4.3. mCO<br />
2<br />
=<br />
3<br />
1,15.10 k<br />
g<br />
V<br />
CO2<br />
= 630.10 m<br />
3 3<br />
5. L’effet <strong>de</strong> serre est du à l’absorption par les gaz situés dans l’atmosphère (CH 4 , CO 2 , H 2 O…) du rayonnement<br />
infrarouge émis par la Terre. L’augmentation <strong>de</strong>s quantités <strong>de</strong> ces gaz dans l’atmosphère tend à diminuer<br />
l’albédo pour la Terre (l’albédo est le rapport entre l’énergie reçue et celle émise par a Terre). l’augmentation <strong>de</strong><br />
l’effet <strong>de</strong> serre a pour conséquence une augmentation <strong>de</strong>s températures moyennes.<br />
Exercice 11 : Extrait du BTS Bâtiment 2000<br />
Question n° 1 2 3 4 5 6<br />
Réponse C B A B D D<br />
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 7 : chimie organique ; synthèse <strong>de</strong> polymères ■ 53
Exercice 12 : Extrait du BTS Bâtiment 1997<br />
1. Le bilan chimique dans les proportions stœchiométriques permet d’obtenir :<br />
mH 2,3 k<br />
2O<br />
= g<br />
Q = 56 MJ<br />
2. Voir §3.3 <strong>de</strong> ce <strong>chapitre</strong> : Qsup = 5,1 MJ<br />
Cette technique permet donc <strong>de</strong> « récupérer » environ 9% d’énergie en plus.<br />
Exercice 13 : Extrait du BTS Travaux Publics 1999<br />
1.<br />
1.1. Voir §3.2.1 <strong>de</strong> ce <strong>chapitre</strong>.<br />
1.2. .Le bilan chimique dans les proportions stœchiométriques permet <strong>de</strong> trouver : VCO<br />
2<br />
= 35,0 m<br />
3<br />
2.<br />
2.1. Q = 642 kJ<br />
2.2. Voir §1.8 du <strong>chapitre</strong> 9 : t = 57 heures 11 min<br />
2.3. Il faut avoir étudié le <strong>chapitre</strong> 9 pour répondre à cette question :<br />
meau<br />
=<br />
3<br />
2,19.10 k<br />
g<br />
Exercice 14 : Extrait du BTS Bâtiment 2001<br />
1. La formule brute est donnée par : C20H<br />
42<br />
La masse molaire se calcule comme au §4.2 du <strong>chapitre</strong> 2.<br />
Voir §3.2.1 pour l’équation bilan <strong>de</strong> la réaction.<br />
2. n = 0,566 mol<br />
20 42<br />
C<br />
H<br />
3. Le bilan molaire dans les conditions stœchiométriques donne : m = 1,13 kg<br />
2<br />
CO<br />
54 ■ Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 7 : chimie organique ; synthèse <strong>de</strong> polymères.
Exercice 15 : Extrait du BTS Étu<strong>de</strong> et Économie <strong>de</strong> la Construction 2000<br />
1.1.<br />
CH 3 CH 2 CH 2 CH 2 CH 3<br />
CH 3<br />
CH 3 CH CH 2 CH 3<br />
CH 3 C CH 2 CH 3<br />
CH 3<br />
CH 3<br />
n-pentane 2-méthylbutane 2,2-diméthylpropane<br />
Les trois formules brutes sont i<strong>de</strong>ntiques.<br />
1.2. Voir §2.2 <strong>de</strong> ce <strong>chapitre</strong>.<br />
2.<br />
2.1. Voir §3.2.1 <strong>de</strong> ce <strong>chapitre</strong>.<br />
2.2. Le bilan chimique dans les proportions stœchiométriques permet <strong>de</strong> trouver : V<br />
CO<br />
= 300 L<br />
2<br />
3.<br />
3.1. Voir §7.4.1 <strong>de</strong> ce <strong>chapitre</strong>.<br />
3.2. Voir §7.4.1 <strong>de</strong> ce <strong>chapitre</strong>.<br />
3.3.<br />
M<br />
polymère<br />
= 156 k g.<br />
mol −<br />
1<br />
Exercice 16 : Extrait du BTS Bâtiment 2000<br />
1.<br />
1.1.<br />
F<br />
F<br />
C<br />
C<br />
F<br />
F<br />
Remarque : les doublets non liants sur les atomes <strong>de</strong> fluor n’ont pas été représentés.<br />
1.2. Voir §7.4.1 <strong>de</strong> ce <strong>chapitre</strong>.<br />
1.3.<br />
H<br />
F<br />
C<br />
C<br />
F<br />
Cl<br />
Remarque : les doublets non liants sur les atomes <strong>de</strong> fluor et l’atome <strong>de</strong> chlore n’ont pas été représentés.<br />
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 7 : chimie organique ; synthèse <strong>de</strong> polymères ■ 55
1.4. 2CHF2Cl = C2F4<br />
+ HCl<br />
1.5. On suppose la réaction totale et dans les proportions stœchiométriques : m<br />
2<br />
CHF Cl<br />
= 1,7.10<br />
3<br />
kg<br />
2.<br />
2.1. M<br />
2 4<br />
C F C<br />
= 100 g.<br />
mol −<br />
1<br />
2.2. Voir §7.3.1 <strong>de</strong> ce <strong>chapitre</strong>.<br />
2.3. n = 10000<br />
56 ■ Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 7 : chimie organique ; synthèse <strong>de</strong> polymères.
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 8 :<br />
transfert thermique en régime permanent.<br />
Contrôle <strong>de</strong>s connaissances<br />
Exercice 1 : Calcul <strong>de</strong> la résistance thermique surfacique d’un mur composite<br />
M 1 M 2<br />
M 3<br />
M 4 M 6 M 7<br />
M 5<br />
Intérieur<br />
e3<br />
4<br />
Extérieur<br />
r<br />
r<br />
r<br />
M1M<br />
4<br />
M1M<br />
6<br />
M1M<br />
3<br />
ep<br />
= ri<br />
+<br />
λ<br />
p<br />
p<br />
ep<br />
e<br />
= ri<br />
+ +<br />
λ λ<br />
ps<br />
ps<br />
ep eps eb<br />
= ri<br />
+ + +<br />
λ λ λ<br />
p ps b<br />
e e e<br />
p ps b<br />
M1M<br />
= r<br />
5 i + + +<br />
λp λps 4λb<br />
r<br />
r<br />
M M<br />
5 7<br />
3eb<br />
= + r<br />
4λ<br />
e e e<br />
r r r<br />
p ps b<br />
M1M =<br />
7 i + + + + e<br />
λp λps λb<br />
b<br />
e<br />
Exercice 2 : Puissance et énergie <strong>de</strong>s pertes thermiques d’un bâtiment<br />
Φ = { K [0,75(2L + 2 l) H + Ll] + 0,25 K (2L + 2 l) H + K Ll}{ θ − θ }<br />
1. 1 1 2 3 int<br />
ext<br />
Application numérique : Φ<br />
1<br />
= 90 kW<br />
2. Compte tenu <strong>de</strong> l’unité du tarif, la puissance doit être exprimée en kW et le temps en heures :<br />
Pr ix = Φ × t × tarif ; application numérique : Pr ix = 27397,44 €<br />
Exercice 3 : Tracé d’un diagramme <strong>de</strong> température<br />
On suppose la même paroi que dans l’exercice 1<br />
1.<br />
2.<br />
θ −θ<br />
ϕ = ; application numérique :<br />
1<br />
int ext<br />
r M 1 M 7<br />
ϕ = 7,82 W.<br />
m<br />
−2<br />
M 2 M 3 M 4 M 5 M 6<br />
ep<br />
e<br />
θM<br />
= θ<br />
2 int − ϕ.<br />
r<br />
b<br />
3 eb<br />
i θM<br />
= θ<br />
3 int − ϕ( ri<br />
+ ) θM = θ ( )<br />
4 ext + ϕ re<br />
+ θM = θ ( )<br />
5 ext + ϕ re<br />
+ × θM = θ .<br />
6 ext + ϕ re<br />
λ<br />
λ<br />
4 λ<br />
θ = 19,1°<br />
C<br />
M<br />
2<br />
θ = 18,9°<br />
C<br />
M<br />
3<br />
p<br />
θ = − 3,4°<br />
C<br />
M<br />
4<br />
b<br />
θ = − 3,7°<br />
C<br />
M<br />
5<br />
b<br />
θ = − 4,5°<br />
C<br />
M<br />
6<br />
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 8 : transfert thermique en régime permanent ■ 57
3. Choix possible pour les échelles : 1 cm en abscisse représente 2<br />
cm d’épaisseur réelle <strong>de</strong> cloison ; 1 cm en ordonnée représente<br />
5°C. Pour le détail du tracé voir §5.4 <strong>de</strong> ce <strong>chapitre</strong>.<br />
θ M1<br />
θ M2<br />
θ M3<br />
θ [ °C]<br />
θ M4<br />
θ M6<br />
θ M7<br />
x[ m ]<br />
Exercices et extraits d’annales<br />
Exercice 4 : Extrait du BTS Bâtiment 2000<br />
1. L’expression littérale <strong>de</strong> K est obtenue par application <strong>de</strong>s formules §5.1 et §5.2 <strong>de</strong> ce <strong>chapitre</strong>.<br />
−2 −1<br />
K = 0,265 W. m . K<br />
2. Attention, dans le cas présent θ int
Pour le double vitrage : θ si = 14,6°<br />
C<br />
2<br />
5. Pour le simple vitrage : θ se = 10,0°<br />
C<br />
1<br />
Pour le double vitrage : θ 1 = 14,5°<br />
C<br />
Pour le double vitrage : θ 2 = 8,1°<br />
C<br />
Pour le double vitrage : θ se = 7,9°<br />
C<br />
2<br />
L’allure <strong>de</strong>s diagrammes <strong>de</strong> température pour le simple et le double vitrage est donnée page suivante.<br />
θ [ °C]<br />
θ [ °C]<br />
θ int<br />
θ int<br />
θ si<br />
θ se<br />
θ si<br />
θ 1<br />
θ 2<br />
θ se<br />
θ ext<br />
θ ext<br />
x[ m ]<br />
x[ m ]<br />
Exercice 6 : Extrait <strong>de</strong> BTS<br />
1.1. L’énoncé ne donne aucune indication sur les résistances thermiques surfaciques. Nous supposerons donc<br />
que la différence <strong>de</strong> température ∆θ correspond à la différence entre les températures superficielles :<br />
∆ θ = θ − θ<br />
si<br />
se<br />
λ<br />
On en déduit l’expression du flux en ne tenant compte que du seul terme <strong>de</strong> conduction : Φ = ∆θ.S<br />
e<br />
1.2. Φ = K∆θ<br />
S<br />
∆θ<br />
Φ = S<br />
R<br />
2. Pour toutes ces parois, la température <strong>de</strong> l’air est i<strong>de</strong>ntique <strong>de</strong>s <strong>de</strong>ux côtés, il n’y a donc aucun transfert<br />
thermique.<br />
3.<br />
SF<br />
= 0,77 m<br />
2<br />
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 8 : transfert thermique en régime permanent ■ 59
SM<br />
= 24,2 m<br />
2<br />
4. L’expression littérale <strong>de</strong> R m s’obtient en appliquant la formule du §5.1 <strong>de</strong> ce <strong>chapitre</strong>.<br />
RM<br />
2 1<br />
= 0,526 m . K.<br />
W −<br />
5. L’expression littérale <strong>de</strong> ϕ m s’obtient en appliquant la formule du §5.1 <strong>de</strong> ce <strong>chapitre</strong>.<br />
ϕ m = 28,5 W.<br />
m<br />
−2<br />
6. L’expression littérale s’obtient en appliquant la formule du §1.7 <strong>de</strong> ce <strong>chapitre</strong>.<br />
Φ = 691 W<br />
m<br />
7.<br />
7.1. l’expression littérale s’obtient en appliquant les relations <strong>de</strong>s §1.6 et §1.9 <strong>de</strong> ce <strong>chapitre</strong>.<br />
7.2.<br />
ϕ m = 63,6 W.<br />
m<br />
−2<br />
Exercice 7 : Extrait du BTS Bâtiment 1981<br />
1. Pour l’isolation intérieure :<br />
rA<br />
2 1<br />
= 1,7 m . K.<br />
W −<br />
−2 −1<br />
K = 0,58 W. m . K<br />
A<br />
Pour l’isolation extérieure :<br />
rB<br />
2 1<br />
= 1,7 m . K.<br />
W −<br />
−2 −1<br />
K = 0,58 W. m . K<br />
B<br />
2. Pour l’isolation intérieure :<br />
θ = 18,4°<br />
C<br />
si<br />
θ 1 = 18, 2°<br />
C<br />
θ 2 = − 2,0°<br />
C<br />
θ = − 4,1°<br />
C<br />
se<br />
Pour l’isolation extérieure :<br />
θ = 18,4°<br />
C<br />
si<br />
θ 1 = 16,3°<br />
C<br />
60 ■ Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 8 : transfert thermique en régime permanent.
θ 2 = − 3,9°<br />
C<br />
θ = − 4,1°<br />
C<br />
se<br />
L’allure <strong>de</strong>s <strong>de</strong>ux diagrammes <strong>de</strong> températures est classique et ne présente aucune difficulté.<br />
3. Avec la précision retenue pour les résultats <strong>de</strong> la question 1, les <strong>de</strong>ux solutions sont équivalentes au niveau <strong>de</strong> la<br />
puissance <strong>de</strong>s pertes aux travers <strong>de</strong>s murs.<br />
4.<br />
4.1. Dans le cas <strong>de</strong> l’isolation thermique par l’extérieur, les murs en béton sont plus chauds que dans le cas <strong>de</strong><br />
l’isolation thermique par l’intérieur. L’inertie thermique est ainsi plus gran<strong>de</strong> dans le cas <strong>de</strong> l’isolation par<br />
l’extérieur. Pour une même puissance <strong>de</strong> chauffage, il faudra ainsi davantage <strong>de</strong> temps dans le cas <strong>de</strong><br />
l’isolation thermique par l’extérieur pour atteindre le régime permanent que dans le cas <strong>de</strong> l’isolation par<br />
l’intérieur. De même, en cas <strong>de</strong> coupure du chauffage, l’équilibre thermique <strong>de</strong> l’ensemble <strong>de</strong> la maison<br />
avec l’extérieur sera obtenu plus rapi<strong>de</strong>ment dans le cas <strong>de</strong> l’isolation thermique par l’intérieur que dans le<br />
cas <strong>de</strong> l’isolation thermique par l’extérieur. Le « volant thermique » est donc meilleur dans le cas <strong>de</strong><br />
l’isolation thermique par l’extérieur (ce principe se retrouve dans les radiateurs à accumulation).<br />
4.2. La con<strong>de</strong>nsation <strong>de</strong> la vapeur d’eau se produit dès que la température du point <strong>de</strong> rosée est atteinte (voir<br />
§5.4 du <strong>chapitre</strong> 9). La solution <strong>de</strong> l’isolation thermique par l’extérieur permet d’obtenir <strong>de</strong>s températures<br />
plus élevées dans le béton, les risques <strong>de</strong> con<strong>de</strong>nsation seront donc moins importants que dans le cas <strong>de</strong><br />
l’isolation thermique par l’intérieur.<br />
Exercice 8 : Extrait du BTS Bâtiment 1996<br />
1. Il existe trois mo<strong>de</strong>s <strong>de</strong> transmission <strong>de</strong> l’énergie sous forme <strong>de</strong> chaleur (§2, §3 et §4 <strong>de</strong> ce <strong>chapitre</strong>).<br />
2. En utilisant les relations §3.3 et §5.2, on peut montrer que<br />
<strong>chapitre</strong>.<br />
∆θ<br />
Φ = . L’unité <strong>de</strong> R est donnée §3.3 <strong>de</strong> ce<br />
R<br />
3.<br />
3.1. L’énoncé ne fourni aucune indication sur les cœfficients <strong>de</strong> transfert h i et h e ou sur les résistances<br />
thermiques <strong>de</strong> surface. Ces termes ne peuvent donc être pris en charge pour la suite <strong>de</strong> la résolution. Seuls<br />
les termes <strong>de</strong> conduction seront retenus pour les calculs.<br />
2 1<br />
r = 0,42 m . K.<br />
W −<br />
3.2. L’expression littérale du flux est obtenu en remplaçant la surface par son expression littérale dans les<br />
relations §1.7 et §5.3.<br />
Φ = 8,6 kW<br />
3.3. Avec les mêmes remarques que pour la question 2 <strong>de</strong> l’exercice 2, on trouve : Pr ix = 2448,32 €<br />
4.<br />
4.1. L’expression littérale <strong>de</strong> la résistance thermique pour 1 m 2 <strong>de</strong> surface ne contient que les trois termes <strong>de</strong><br />
conduction.<br />
2 1<br />
r ' = 1,7 m . K.<br />
W −<br />
4.2. Economie réalisée : Pr ix − Pr ix ' = 1821,96 €<br />
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 8 : transfert thermique en régime permanent ■ 61
Exercice 9 : Extrait du BTS Bâtiment 2001<br />
La question 2 du livre ne fournit que <strong>de</strong>s données. La question 3 du livre est à supprimer totalement. La vraie<br />
question 2 correspond donc à la question 4 du livre.<br />
Φ = ( K S + K S + K S )( θ − θ ) ; application numérique : Φ<br />
1<br />
= 5,37 kW<br />
1. 1 1 M 2 F 3 P i e<br />
2.<br />
r<br />
1<br />
e<br />
e<br />
1 2<br />
ci<br />
= + + ; application numérique :<br />
h λ1 λ2<br />
rci<br />
= 0,147 m . K.<br />
W −<br />
2 1<br />
3.<br />
r<br />
cf<br />
e<br />
λ<br />
e<br />
λ<br />
= 3 + 4<br />
; application numérique :<br />
3 4<br />
rcf<br />
= 2,64 m . K.<br />
W −<br />
2 1<br />
4.<br />
Φ<br />
S<br />
1<br />
ϕ<br />
1<br />
= ; application numérique :<br />
ϕ1 = 44,8 kW . m<br />
−2<br />
1<br />
θs<br />
= θi<br />
+ ϕ1.<br />
; application numérique : θ<br />
s<br />
= 24,5 ° C<br />
h<br />
θ = θ + ϕ ; application numérique : θ = 26,6 ° C<br />
.<br />
c i 1<br />
rci<br />
s<br />
θc<br />
−θF<br />
5. Φ<br />
2<br />
= . S ; application numérique : Φ<br />
2<br />
= 1,12 kW<br />
r<br />
cf<br />
6. Compte tenu <strong>de</strong> l’unité du tarif, les puissances doivent être exprimées en kW et le temps en heures :<br />
Pr<br />
Φ + Φ<br />
= × × ; application numérique : Pr ix = 4,15 €<br />
0,8<br />
1 2<br />
ix t tarif<br />
Exercice 10 : Extrait du BTS Travaux Publics 1982 (corps noir et photométrie)<br />
1. La loi <strong>de</strong> Bouguer (§1.8 du <strong>chapitre</strong> 13) est applicable à condition <strong>de</strong> remplacer l’éclairement par la constante<br />
solaire recherchée.<br />
ϕ = 1,3 kW.<br />
m<br />
−2<br />
2. La température d’équilibre du corps noir est donnée par :<br />
numériquement : T = 364 K ou encore : θ = 91 °C<br />
CN<br />
CN<br />
T CN<br />
⎛ ϕ ⎞<br />
= ⎜ ⎟<br />
⎝ σ ⎠<br />
1<br />
4<br />
3. La première loi <strong>de</strong> Wien permet <strong>de</strong> calculer la longueur d’on<strong>de</strong> du maximum d’émission : λ = 8,0 µ m . La<br />
comparaison <strong>de</strong> cette valeur avec le spectre <strong>de</strong>s on<strong>de</strong>s électromagnétiques §4.2 <strong>de</strong> ce <strong>chapitre</strong> permet <strong>de</strong><br />
conclure sur le nom du rayonnement émis.<br />
4. La lame <strong>de</strong> verre doit être considérée comme un corps noir vis-à-vis du rayonnement infrarouge et totalement<br />
transparente pour la lumière visible. Cette vitre absorbe intégralement le rayonnement émis par le corps noir et<br />
réémet suivant ses <strong>de</strong>ux faces extérieures. En appelant T V sa température son bilan énergétique exprimé en<br />
terme <strong>de</strong> puissances pour un régime permanent est donc donné par :<br />
62 ■ Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 8 : transfert thermique en régime permanent.
4 4<br />
2σ<br />
TV = σTCN<br />
Pour le corps noir, il absorbe totalement le rayonnement solaire traversant la vitre, mais également la totalité du<br />
rayonnement infrarouge provenant <strong>de</strong> la surface inférieure <strong>de</strong> la vitre. En régime permanent, le bilan <strong>de</strong>s<br />
puissances s’écrit donc :<br />
ϕ + σT<br />
= σT<br />
4 4<br />
V CN<br />
La résolution <strong>de</strong> ce système <strong>de</strong> <strong>de</strong>ux équations à <strong>de</strong>ux inconnues permet <strong>de</strong> connaître T V et T CN.<br />
TCN<br />
= 433 K<br />
TV<br />
= 364 K<br />
Exercice 11 : Extrait du BTS Travaux Publics 1986<br />
1. Psup = 9,8 kW<br />
lémentaire<br />
2. Le panneau ne reçoit du rayonnement que par une seule surface tandis qu’il rayonne comme un corps noir sur<br />
ses <strong>de</strong>ux surfaces :<br />
T CN<br />
⎛ 0,4ϕ<br />
⎞<br />
= ⎜ ⎟<br />
⎝ 2σ<br />
⎠<br />
Numériquement : T = 265 K<br />
CN<br />
1<br />
4<br />
Pour les essais sur Terre, on peut supposer que l’air rayonne également suivant un corps noir à la température<br />
T 1 = 291, 15 K. Le bilan en puissance pour le régime permanent permet alors d’écrire :<br />
TCN<br />
= 313 K<br />
ϕ σ σ<br />
4 4<br />
0, 4 ' + 2 T1<br />
= 2 TCN<br />
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 8 : transfert thermique en régime permanent ■ 63
64 ■ Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 8 : transfert thermique en régime permanent.
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 9 :<br />
thermodynamique.<br />
Contrôle <strong>de</strong>s connaissances<br />
Exercice 1 : Freinage d’un véhicule<br />
1. Prenons comme système la voiture munie <strong>de</strong> ses quatre freins à disque. En supposant la transformation<br />
adiabatique, nous pouvons écrire : ∆E<br />
+ ∆H<br />
= 0<br />
C<br />
1 2 2<br />
En développant cette expression, nous obtenons : (0 − mv ) + 4× π r eρc p<br />
∆θ = 0<br />
2<br />
En isolant ∆θ, on obtient finalement :<br />
∆θ =<br />
2<br />
mv<br />
π ρ<br />
2<br />
8 r e cp<br />
Attention car c p doit être converti si on laisse la masse exprimée en kg : ∆θ = 38,4°<br />
C<br />
2. Prenons comme système la voiture munie <strong>de</strong> ses quatre freins à disque. Les vitesses initiale et finale sont<br />
i<strong>de</strong>ntiques, la variation d’énergie cinétique du système est donc nulle. En supposant la transformation<br />
adiabatique, nous pouvons écrire : ∆E<br />
+ ∆H<br />
= 0<br />
P<br />
2<br />
En développant cette expression, nous obtenons : ( mgh − mgh ) + 4× π r eρc<br />
∆θ = 0<br />
mghinitiale<br />
− mgh<br />
En isolant ∆θ, on obtient finalement : ∆θ =<br />
2<br />
8π<br />
r eρc<br />
finale initiale p<br />
Attention car c p doit être converti si on laisse la masse exprimée en kg :<br />
p<br />
finale<br />
∆θ = 4377°<br />
C<br />
Ce résultat montre clairement qu’un autre type <strong>de</strong> freinage doit venir en complément (frein moteur, frein<br />
électromagnétiques…). Pour mémoire, la température <strong>de</strong> fusion du tungstène est <strong>de</strong> 3482°C et c’est l’un <strong>de</strong>s<br />
métaux dont la température <strong>de</strong> fusion est la plus élevée (c’est d’ailleurs pour cette raison que les filaments<br />
d’ampoules à incan<strong>de</strong>scence sont en tungstène).<br />
Exercice 2 : Calcul <strong>de</strong> PCI<br />
Données : capacité thermique massique <strong>de</strong> l’eau : c = 4,19 kJ.kg -1 .K -1 , masse volumique <strong>de</strong> l’eau : 1000 kg.m -3 .<br />
Raisonnons sur le système « eau ». Exprimons le premier principe en ne supposant aucune perte thermique (toute<br />
l’énergie sert effectivement à chauffer l’eau) : ∆ H = mPCI . A pression constante et en l’absence d’échange<br />
d’énergie sous forme <strong>de</strong> travail, on obtient : ρVc<br />
( θ − θ ) = mPCI<br />
eau<br />
p finale initiale<br />
D’où :<br />
ρVc p<br />
( θ finale<br />
−θ<br />
initiale<br />
)<br />
PCI =<br />
m<br />
Numériquement (attention aux conversions !) :<br />
PCI = 30 MJ.<br />
kg −<br />
1<br />
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 9 : thermodynamique ■ 65
Exercice 3 : Puissance d’un radiateur à eau<br />
Pour cet exercice, il est nécessaire <strong>de</strong> connaître la relation :<br />
V<br />
t<br />
= D (voir §2.1 <strong>chapitre</strong> 12). Raisonnons sur le<br />
système « eau ». Exprimons le premier principe : ∆ Heau = Pchauffage<br />
t . A pression constante et en l’absence d’échange<br />
d’énergie sous forme <strong>de</strong> travail, on obtient : ρVc ( θ − θ ) = P t .<br />
p E S chauffage<br />
V<br />
D’où :<br />
P<br />
ρVcp ( θE −θS<br />
)<br />
= = ρD c ( θ − θ ) ; application numérique : Pchauffage<br />
= 2,8 kW<br />
t<br />
chauffage V p E S<br />
Exercice 4 : Équivalence entre différentes énergies<br />
Système Sac <strong>de</strong> ciment Gaz<br />
Récepteur<br />
électrique<br />
Voiture<br />
Eau<br />
Formule<br />
E<br />
h =<br />
mg<br />
E<br />
ER<br />
∆ V = − t =<br />
2<br />
P<br />
U<br />
v =<br />
2E<br />
m<br />
E<br />
m = c ∆θ<br />
p<br />
AN<br />
h = 10 km<br />
Remarque : la valeur <strong>de</strong> g diminue<br />
avec l’altitu<strong>de</strong>.<br />
2<br />
∆ V = − 18 m<br />
diminution <strong>de</strong><br />
volume<br />
t = 12 min v = 98 m.s-1<br />
m = 9,5 kg<br />
Exercice 5 : Calcul <strong>de</strong> mélanges<br />
Le système envisagé est pour chaque ligne l’ensemble <strong>de</strong>s constituants présent dans l’état initial. En appliquant le<br />
premier principe nous obtenons : ∆H + ∆H + ∆H = O<br />
On supposera : θ = 0 ° C ; θ = 100 ° C<br />
fusion<br />
initialement glace initialement eau liqui<strong>de</strong> initialement eau vapeur<br />
ébullition<br />
Il n’est peut être pas inutile <strong>de</strong> rappeler : LLiquéfaction ou con<strong>de</strong>nsation<br />
= − L<br />
vaporisation<br />
Pour résoudre l’exercice, il est nécessaire <strong>de</strong> faire une hypothèse : l’état final est constitué d’eau entièrement sous<br />
forme liqui<strong>de</strong>. Les quatre expressions algébriques du premier principe correspondant aux quatre lignes sont les<br />
suivantes :<br />
⇒ Pour la 1 ère ligne :<br />
( θ θ ) ( θ θ ) ( θ θ )<br />
m c − + m L + m c − + + m c − = O<br />
1 glace fusion g 1 F 1 eau liqui<strong>de</strong> Finale fusion 2 eau liqui<strong>de</strong> Finale l<br />
Cette équation permet <strong>de</strong> trouver la valeur <strong>de</strong> θ Finale .<br />
⇒ Pour la 2 ème ligne :<br />
Si on suppose que toute l’eau est sous forme liqui<strong>de</strong> dans l’état final alors :<br />
( θ θ ) ( θ θ ) ( θ θ )<br />
m c − + m c − − m L + m c − = O<br />
2 eau liqui<strong>de</strong> Finale l 3 eau vapeur ébullition v 3 V 3 eau liqui<strong>de</strong> Finale ébullition<br />
66 ■ Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 9 : thermodynamique.
La solution pour θ Finale est supérieure à 100°C, cette solution n’étant pas acceptable, il faut supposer que la vapeur<br />
d’eau ne se con<strong>de</strong>nse pas entièrement. L’état final contiendra donc <strong>de</strong> l’eau liqui<strong>de</strong> ainsi que <strong>de</strong> l’eau vapeur. En<br />
appelant m 3 ’ la masse <strong>de</strong> vapeur qui va réellement se con<strong>de</strong>nser, on obtient :<br />
( θ θ ) ( θ θ )<br />
m c − + m c − − m ' L = O<br />
2 eau liqui<strong>de</strong> ébullition l 3 eau vapeur ébullition g 3 V<br />
On peut ainsi en déduire la valeur <strong>de</strong> m 3 ’.<br />
⇒ Pour la 3 ème ligne : la situation est i<strong>de</strong>ntique au cas <strong>de</strong> la secon<strong>de</strong> ligne, il est donc nécessaire <strong>de</strong> supposer que<br />
toute la vapeur d’eau ne se con<strong>de</strong>nse pas.<br />
( θ θ ) ( θ θ ) ( θ θ ) ( θ θ )<br />
m c − + m L + m c − + m c − + m c − − m ' L = O<br />
1 glace fusion g 1 F 1 liqui<strong>de</strong> ébullition fusion 2 liqui<strong>de</strong> ébullition l 3 vapeur ébullition v 3 V<br />
On peut ainsi en déduire la valeur <strong>de</strong> m 3 ’.<br />
⇒ Pour la 4 ème ligne : l’état final est supposé ne contenir que <strong>de</strong> l’eau liqui<strong>de</strong>.<br />
( θ θ ) ( θ θ ) ( θ θ ) ( θ θ ) ' ( θ θ )<br />
m c − + m L + m c − + m c − + m c − − m L + m c − = O<br />
1 glace fusion g 1 F 1 liq Finale fusion 2 liq Finale l 3 vap ébul v 3 V 3 liq Finale ébul<br />
On obtient ainsi le tableau <strong>de</strong> résultats suivant :<br />
État initial<br />
Glace θ g<br />
Eau<br />
liqui<strong>de</strong><br />
θ l<br />
Eau<br />
vapeur<br />
État final<br />
θ v m Glace m Liqui<strong>de</strong> m Vapeur<br />
Température<br />
Finale θ F<br />
m 1 = 50 g - 20°C m 2 = 100 g 100°C m 3 = 0 0 150 g 36,7°C<br />
m 1 = 0 m 2 = 250 g 0 °C m 3 = 100 g 150°C 292 g 58 g 100 °C<br />
m 1 = 100 g -20°C m 2 = 0 m 3 = 100 g 120°C 0 133 g 67 g 100 °C<br />
m 1 = 300 g - 40°C m 2 = 250 g 50 °C m 3 = 100 g 200°C 0 650 g 0 79 °C<br />
Exercices et extraits d’annales<br />
Exercice 6 : Extrait du BTS Travaux Publics 2000<br />
1. Voir §4 <strong>de</strong> ce <strong>chapitre</strong> : Q = 2,51 GJ<br />
p<br />
2.<br />
2.1. Voir §1.8 <strong>de</strong> ce <strong>chapitre</strong> (il faut également tenir compte du ren<strong>de</strong>ment) : Q1 = 1,30 GJ<br />
2.2. Voir §4 <strong>de</strong> ce <strong>chapitre</strong> : ∆θ<br />
1<br />
= 0,52 °C<br />
3.<br />
3.1. Voir §4.4 du <strong>chapitre</strong> 8 :<br />
l’extérieur.<br />
-1<br />
P<br />
2<br />
= − 447 W.m<br />
, le signe négatif provient du fait que l’énergie est cédée à<br />
3.2. Voir §1.6 et §1.7 du <strong>chapitre</strong> 8 :<br />
9<br />
Q<br />
2<br />
= − 3,86.10 J , même remarque que précé<strong>de</strong>mment pour le signe.<br />
3.3. Voir §4 <strong>de</strong> ce <strong>chapitre</strong> : ∆θ<br />
2<br />
= − 1,54 °C<br />
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 9 : thermodynamique ■ 67
3.4. Il faut utiliser une bâche flottante qui soit un bon isolant thermique vis-à-vis du rayonnement (du type <strong>de</strong>s<br />
couvertures <strong>de</strong> survie).<br />
4. L’application du 1 er principe à l’eau <strong>de</strong> la piscine conduit à :<br />
∆ H = − 2,59.10<br />
eau<br />
9<br />
J<br />
5. L’exercice 10 du <strong>chapitre</strong> 8 présente le principe d’un capteur à effet <strong>de</strong> serre.<br />
Exercice 7 : Extrait du BTS Travaux Publics 1993<br />
1. Voir §2.5 <strong>de</strong> ce <strong>chapitre</strong>.<br />
2. Voir §2.7 <strong>de</strong> ce <strong>chapitre</strong>.<br />
3. Voir §2.7 <strong>de</strong> ce <strong>chapitre</strong>.<br />
4. Voir §5.3 <strong>de</strong> ce <strong>chapitre</strong>.<br />
5. Le système pour appliquer le 1 er principe sera le cylindre d’aluminium soumis au rayonnement laser.<br />
5.1. L’application du 1 er principe <strong>de</strong> la thermodynamique donne : ∆ H1 = 155 µ J<br />
5.2. L’application du 1 er principe <strong>de</strong> la thermodynamique donne : ∆ H<br />
2<br />
= 263 µ J<br />
5.3. L’application du 1 er principe <strong>de</strong> la thermodynamique donne : ∆ H3 = 3,63 mJ<br />
6. Voir §1.8 <strong>de</strong> ce <strong>chapitre</strong> : P = 3,63 W<br />
laser<br />
Exercice 8 : Extrait du BTS Bâtiment 2005<br />
1. Voir §4 <strong>de</strong> ce <strong>chapitre</strong> et §1.4 du <strong>chapitre</strong> 11.<br />
2. Q = 1,1 MJ<br />
3. Voir §1.8 <strong>de</strong> ce <strong>chapitre</strong> : P = 0,31 kW<br />
A<br />
4.<br />
4.1. Voir §5.2 du <strong>chapitre</strong> 8.<br />
4.2. P = [ K S + K S ]( θ − θ )<br />
f<br />
1 1 2 2 2 1<br />
4.3. P = 0,17 kW<br />
f<br />
4.4. P = 0,49 kW<br />
TH<br />
5. PE<br />
miniumu<br />
= 0,57 kW , il faut donc choisir un modèle dont la puissance électrique est supérieure à cette valeur. Il<br />
en résultera un fonctionnement par intermittence.<br />
68 ■ Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 9 : thermodynamique.
Exercice 9 : Extrait du BTS bâtiment 2003<br />
1. Voir §2.6 <strong>de</strong> ce <strong>chapitre</strong> :<br />
−3<br />
∆L = 1,8.10 m<br />
2. L’application <strong>de</strong> la loi <strong>de</strong> Hooke donne : F30 = 36 kN<br />
3. Voir §4.1.1 du <strong>chapitre</strong> 11 :<br />
p30 = 36.10<br />
6<br />
Pa<br />
4. p30 360 p atmos<br />
5. Les joints <strong>de</strong> dilatation permettent d’éviter les contraintes dues aux dilatations et responsables <strong>de</strong> fissures voire<br />
<strong>de</strong> rupture <strong>de</strong>s matériaux.<br />
Exercice 10 : Extrait du BTS Bâtiment 2002<br />
1. Après calcul <strong>de</strong> la surface, on peut montrer : P1 = 5,3 kW<br />
2. P2 = 1,6 kW<br />
3. m = 225 kg<br />
eau<br />
Voir §4 <strong>de</strong> ce <strong>chapitre</strong> : Q = 11 MJ<br />
4. Voir §1.8 <strong>de</strong> ce <strong>chapitre</strong> : t = 2 heures<br />
5. Voir §2.1 et §2.2 du <strong>chapitre</strong>12 :<br />
Dm<br />
= 31.10 kg.<br />
s<br />
−3 -1<br />
Dm<br />
= 113 L.<br />
h<br />
-1<br />
Exercice 11 : Extrait du BTS Bâtiment 2002<br />
1. Voir §2.5 du <strong>chapitre</strong> 1.<br />
2.<br />
2.1. Voir §4 <strong>de</strong> ce <strong>chapitre</strong> : Q = 5,8 MJ<br />
a<br />
2.2. Voir §4 <strong>de</strong> ce <strong>chapitre</strong> : Q = 1,0 GJ<br />
b<br />
3.<br />
3.1. Voir §2, §3 et§4 du <strong>chapitre</strong> 8.<br />
3.2. Voir §5.1 du <strong>chapitre</strong> 8 :<br />
R = 0,95 m . K.<br />
W −<br />
2 1<br />
Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 9 : thermodynamique ■ 69
3.3. Voir §5.2 du <strong>chapitre</strong> 8 :<br />
ϕ = 57 W.<br />
m<br />
−2<br />
3.4. Voir §1.7 du <strong>chapitre</strong> 8 : Φ = 6,1 kW<br />
4.<br />
4.1. Voir §4.6 du <strong>chapitre</strong> 12 : P = 2,5 kW<br />
th<br />
4.2. Voir §1.7 du <strong>chapitre</strong> 8 : n = 3<br />
Exercice 12 : Extrait du BTS Étu<strong>de</strong> et Économie <strong>de</strong> la construction 2000<br />
1. Voir §4 <strong>de</strong> ce <strong>chapitre</strong> : Q = 75 MJ<br />
2. Voir §1.8 <strong>de</strong> ce <strong>chapitre</strong> : P = 2,6 kW<br />
3. Voir §1.9 <strong>de</strong> ce <strong>chapitre</strong> : Pr ix = 1,22 €<br />
b<br />
4. En appliquant le 1 er principe <strong>de</strong> la thermodynamique à l’ensemble eau chau<strong>de</strong> + eau froi<strong>de</strong>, on peut montrer :<br />
θ<br />
2<br />
= 60 ° C<br />
5. En appliquant le 1 er principe <strong>de</strong> la thermodynamique à l’ensemble eau chau<strong>de</strong> + eau froi<strong>de</strong>, on peut montrer :<br />
= 140 W<br />
Ppertes<br />
Exercice 13 : Extrait du BTS Étu<strong>de</strong> et Économie <strong>de</strong> la construction 1994<br />
1. Voir §4.4 <strong>de</strong> ce <strong>chapitre</strong> en prenant ∆H calorimètre = 0 :<br />
θ ⎛<br />
1 1 2 2 1 1 2 2<br />
3<br />
1 m c + m c ⎞ m c m c<br />
1<br />
m3c<br />
θ +<br />
= ⎜ + ⎟ −<br />
3<br />
m3c<br />
θ<br />
⎝<br />
⎠<br />
3<br />
θ<br />
3<br />
= 52 ° C<br />
2. Q ( m c m c )( θ θ ) m c ( θ θ )<br />
perdue<br />
= + − + − ; application numérique : Q = − 5,67 MJ<br />
1 1 2 2 1 3 3 4<br />
perdue<br />
3.<br />
3.1.<br />
c3 ( θ4 −θ1<br />
)<br />
( θ − θ ) +<br />
m5 = m3<br />
c<br />
3 5 1 L<br />
vap<br />
3.2. m5 = 15,5 kg<br />
70 ■ Eléments <strong>de</strong> <strong>correction</strong> <strong>de</strong>s <strong>exercices</strong> du <strong>chapitre</strong> 9 : thermodynamique.