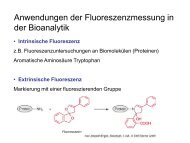
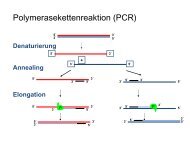
Teil 2 - Institut für Analytische Chemie
Teil 2 - Institut für Analytische Chemie
Teil 2 - Institut für Analytische Chemie
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Der pH-Wert<br />
• Der pH-Wert wird als negativer dekadischer Logarithmus der H 3O + -Ionenkonzentration definiert.<br />
pH = - log [H3O + ]<br />
• Auf dieser Definition basiert die pH-Skala. Ihre Anwendung <strong>für</strong> wässrige Lösungen reicht von pH = 0<br />
([H 3O + ] = 1 mol/l = 10 0 mol/l) bis pH = 14 ([H 3O + ] = 10 -14 mol/l).<br />
• Sinkt der pH-Wert in einer Lösung um eine Einheit (um 1,0), bedeutet das aufgrund der<br />
logarithmischen Skala, dass sich die Hydronium-Ionenkonzentration um den Faktor 10 erhöht hat<br />
und umgekehrt.<br />
• Der pOH-Wert ist analog als negativer dekadischer Logarithmus der OH – -Ionenkonzentration<br />
definiert.<br />
pOH = - log [OH – ]<br />
• pH und pOH hängen über das Ionenprodukt des Wassers zusammen. Bildet man den negativen<br />
Logarithmus des Ionenprodukts, erhält man<br />
- log K W = - log ([H 3O + ]·[OH – ]) = - log 10 -14 , pH + pOH = 14<br />
(aus: Goldenberg, SOL)