GA HÓA HỌC 11 CB 3 CỘT HK2 THEO ĐỊNH HƯỚNG NĂNG LỰC GV SOẠN PHAN DƯ TÚ TRƯỜNG THPT PHONG ĐIỀN
https://app.box.com/s/pf4ffdx2rqpy20kmy7r7465eaqyqk1dk
https://app.box.com/s/pf4ffdx2rqpy20kmy7r7465eaqyqk1dk
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Trường <strong>THPT</strong> Phong Điền Tổ Hóa – Sinh – CN Hóa học <strong>11</strong> – <strong>CB</strong><br />
Hoạt động của giáo viên Hoạt động của học sinh Nội dung ghi bảng<br />
Hoạt động 1: (10ph) Tính chất hóa học<br />
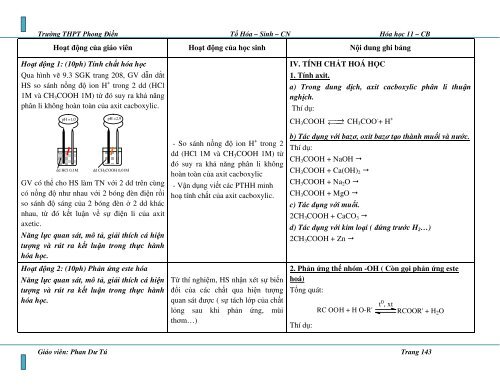
Qua hình vẽ 9.3 SGK trang 208, <strong>GV</strong> dẫn dắt<br />
HS so sánh nồng độ ion H + trong 2 dd (HCl<br />
1M và CH 3 COOH 1M) từ đó suy ra khả năng<br />
phân li không hoàn toàn của axit cacboxylic.<br />
pH =1,0 pH =2,9<br />
dd HCl 0,1M dd CH 3 COOH 0,01M<br />
<strong>GV</strong> có thể cho HS làm TN với 2 dd trên cùng<br />
có nồng độ như nhau với 2 bóng đèn điện rồi<br />
so sánh độ sáng của 2 bóng đèn ở 2 dd khác<br />
nhau, từ đó kết luận về sự điện li của axit<br />
axetic.<br />
Năng lực quan sát, mô tả, giải thích cá hiện<br />
tượng và rút ra kết luận trong thực hành<br />
hóa học.<br />
Hoạt động 2: (10ph) Phản ứng este hóa<br />
Năng lực quan sát, mô tả, giải thích cá hiện<br />
tượng và rút ra kết luận trong thực hành<br />
hóa học.<br />
- So sánh nồng độ ion H + trong 2<br />
dd (HCl 1M và CH 3 COOH 1M) từ<br />
đó suy ra khả năng phân li không<br />
hoàn toàn của axit cacboxylic<br />
- Vận dụng viết các PTHH minh<br />
hoạ tính chất của axit cacboxylic.<br />
Từ thí nghiệm, HS nhận xét sự biến<br />
đổi của các chất qua hiện tượng<br />
quan sát được ( sự tách lớp của chất<br />
lỏng sau khi phản ứng, mùi<br />
thơm…)<br />
IV. TÍNH CHẤT HOÁ <strong>HỌC</strong><br />
1. Tính axit.<br />
a) Trong dung dịch, axit cacboxylic phân li thuận<br />
nghịch.<br />
Thí dụ:<br />
CH 3 COOH ⎯⎯→ ← ⎯ CH 3 COO - + H +<br />
b) Tác dụng với bazơ, oxit bazơ tạo thành muối và nước.<br />
Thí dụ:<br />
CH 3 COOH + NaOH <br />
CH 3 COOH + Ca(OH) 2 <br />
CH 3 COOH + Na 2 O <br />
CH 3 COOH + MgO <br />
c) Tác dụng với muối.<br />
2CH 3 COOH + CaCO 3 <br />
d) Tác dụng với kim loại ( đứng trước H 2 …)<br />
2CH 3 COOH + Zn <br />
2. Phản ứng thế nhóm -OH ( Còn gọi phản ứng este<br />
hoá)<br />
Tổng quát:<br />
Thí dụ:<br />
RC OOH + H O-R'<br />
t 0 , xt<br />
RCOOR' + H 2 O<br />
Giáo viên: Phan Dư Tú Trang 143