4. Das System O/H/H2O auf Pt(111)
4. Das System O/H/H2O auf Pt(111)
4. Das System O/H/H2O auf Pt(111)
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
dem sämtliche Geschwindigkeitskonstanten gleich sind. Außerdem wird angenommen,<br />
daß Wasserstoff in großem Überschuß vorhanden ist, so daß die<br />
Konzentration von H in den Differentialgleichungen, die sich aus dem obigen<br />
Reaktionsmodell ergeben, nicht explizit <strong>auf</strong>tritt, sondern in die Konstanten einbezogen<br />
wird. Der Ausgangszustand ist eine Fläche, die ausschließlich mit<br />
Sauerstoff bedeckt ist. Diese maximale Menge an Sauerstoff wird gleich eins<br />
gesetzt. Der Sauerstoff reagiert nach den Gleichungen I und III ab, wobei sich OH<br />
und nach Gleichung II schließlich <strong>H2O</strong> bildet. Die zeitlich variierenden Mengen<br />
an OH und <strong>H2O</strong> werden dabei <strong>auf</strong> die anfängliche Menge an Sauerstoff normiert,<br />
so daß bei einem vollständigem Umsatz aus jedem O ein <strong>H2O</strong> gebildet wird und<br />
der Endzustand dann aus einer mit Wasser bedeckten Fläche der Menge eins<br />
besteht.<br />
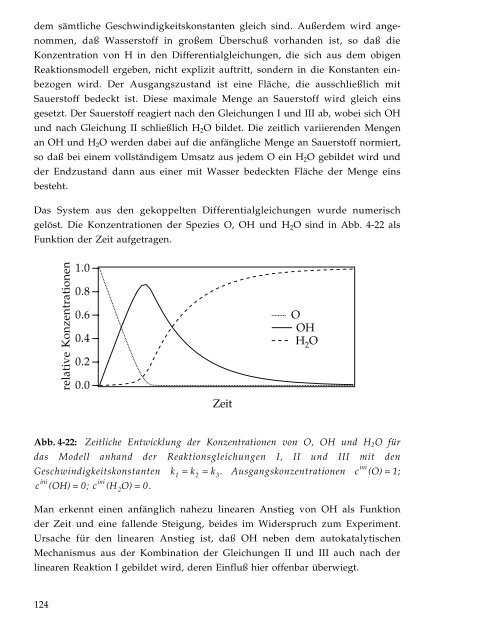
<strong>Das</strong> <strong>System</strong> aus den gekoppelten Differentialgleichungen wurde numerisch<br />
gelöst. Die Konzentrationen der Spezies O, OH und <strong>H2O</strong> sind in Abb. 4-22 als<br />
Funktion der Zeit <strong>auf</strong>getragen.<br />
124<br />
relative Konzentrationen<br />
1.0<br />
0.8<br />
0.6<br />
0.4<br />
0.2<br />
0.0<br />
Zeit<br />
O<br />
OH<br />
H 2 O<br />
Abb. 4-22: Zeitliche Entwicklung der Konzentrationen von O, OH und <strong>H2O</strong> für<br />
das Modell anhand der Reaktionsgleichungen I, II und III mit den<br />
Geschwindigkeitskonstanten k ini<br />
1 = k2 = k 3.<br />
Ausgangskonzentrationen c (O) = 1;<br />
ini<br />
ini<br />
c (OH) = 0;<br />
c (H2 O) = 0.<br />
Man erkennt einen anfänglich nahezu linearen Anstieg von OH als Funktion<br />
der Zeit und eine fallende Steigung, beides im Widerspruch zum Experiment.<br />
Ursache für den linearen Anstieg ist, daß OH neben dem autokatalytischen<br />
Mechanismus aus der Kombination der Gleichungen II und III auch nach der<br />
linearen Reaktion I gebildet wird, deren Einfluß hier offenbar überwiegt.