PDF Download - Laborwelt
PDF Download - Laborwelt
PDF Download - Laborwelt
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
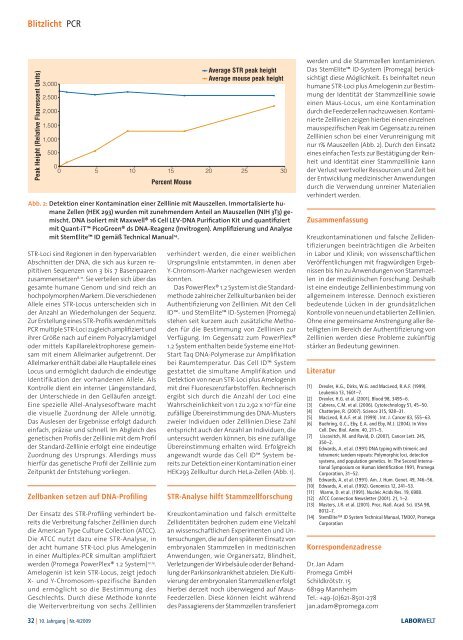
Blitzlicht PCRPeak Height (Relative Fluorescent Units)3,0002,5002,0001,5001,0005000 0 5 10 15 20 25 30STR-Loci sind Regionen in den hypervariablenAbschnitten der DNA, die sich aus kurzen repititivenSequenzen von 3 bis 7 Basenpaarenzusammensetzen 8-11 . Sie verteilen sich über dasgesamte humane Genom und sind reich anhochpolymorphen Markern. Die verschiedenenAllele eines STR-Locus unterscheiden sich inder Anzahl an Wiederholungen der Sequenz.Zur Erstellung eines STR-Profils werden mittelsPCR multiple STR-Loci zugleich amplifiziert undihrer Größe nach auf einem Polyacrylamidgeloder mittels Kapillarelektrophorese gemeinsammit einem Allelmarker aufgetrennt. DerAllelmarker enthält dabei alle Hauptallele einesLocus und ermöglicht dadurch die eindeutigeIdentifikation der vorhandenen Allele. AlsKontrolle dient ein interner Längenstandard,der Unterschiede in den Gelläufen anzeigt.Eine spezielle Allel-Analysesoftware machtdie visuelle Zuordnung der Allele unnötig.Das Auslesen der Ergebnisse erfolgt dadurcheinfach, präzise und schnell. Im Abgleich desgenetischen Profils der Zelllinie mit dem Profilder Standard-Zelllinie erfolgt eine eindeutigeZuordnung des Ursprungs. Allerdings musshierfür das genetische Profil der Zelllinie zumZeitpunkt der Entstehung vorliegen.Zellbanken setzen auf DNA-ProfilingDer Einsatz des STR-Profiling verhindert bereitsdie Verbreitung falscher Zelllinien durchdie American Type Culture Collection (ATCC).Die ATCC nutzt dazu eine STR-Analyse, inder acht humane STR-Loci plus Amelogeninin einer Multiplex-PCR simultan amplifiziertwerden (Promega PowerPlex® 1.2 System) 12,13 .Amelogenin ist kein STR-Locus, zeigt jedochX- und Y-Chromosom-spezifische Bandenund ermöglicht so die Bestimmung desGeschlechts. Durch diese Methode konntedie Weiterverbreitung von sechs ZelllinienPercent MouseAverage STR peak heightAverage mouse peak heightAbb. 2: Detektion einer Kontamination einer Zelllinie mit Mauszellen. Immortalisierte humaneZellen (HEK 293) wurden mit zunehmendem Anteil an Mauszellen (NIH 3T3) gemischt.DNA isoliert mit Maxwell® 16 Cell LEV-DNA Purification Kit und quantifiziertmit Quant-iT PicoGreen® ds DNA-Reagenz (Invitrogen). Amplifizierung und Analysemit StemElite ID gemäß Technical Manual 14 .verhindert werden, die einer weiblichenUrsprungslinie entstammten, in denen aberY-Chromsom-Marker nachgewiesen werdenkonnten.Das PowerPlex® 1.2 System ist die Standardmethodezahlreicher Zellkulturbanken bei derAuthentifizierung von Zelllinien. Mit den CellID- und StemElite ID-Systemen (Promega)stehen seit kurzem auch zusätzliche Methodenfür die Bestimmung von Zelllinien zurVerfügung. Im Gegensatz zum PowerPlex®1.2 System enthalten beide Systeme eine Hot-Start Taq DNA-Polymerase zur Amplifikationbei Raumtemperatur. Das Cell ID Systemgestattet die simultane Amplifikation undDetektion von neun STR-Loci plus Amelogeninmit drei Fluoreszenzfarbstoffen. Rechnerischergibt sich durch die Anzahl der Loci eineWahrscheinlichkeit von 1 zu 2,92 x 10 9 für einezufällige Übereinstimmung des DNA-Musterszweier Individuen oder Zelllinien.Diese Zahlentspricht auch der Anzahl an Individuen, dieuntersucht werden können, bis eine zufälligeÜbereinstimmung erhalten wird. Erfolgreichangewandt wurde das Cell ID System bereitszur Detektion einer Kontamination einerHEK293 Zellkultur durch HeLa-Zellen (Abb. 1).STR-Analyse hilft StammzellforschungKreuzkontamination und falsch ermittelteZellidentitäten bedrohen zudem eine Vielzahlan wissenschaftlichen Experimenten und Untersuchungen,die auf den späteren Einsatz vonembryonalen Stammzellen in medizinischenAnwendungen, wie Organersatz, Blindheit,Verletzungen der Wirbelsäule oder der Behandlungder Parkinsonkrankheit abzielen. Die Kultivierungder embryonalen Stammzellen erfolgthierbei derzeit noch überwiegend auf Maus-Feederzellen. Diese können leicht währenddes Passagierens der Stammzellen transferiertwerden und die Stammzellen kontaminieren.Das StemElite ID-System (Promega) berücksichtigtdiese Möglichkeit. Es beinhaltet neunhumane STR-Loci plus Amelogenin zur Bestimmungder Identität der Stammzelllinie sowieeinen Maus-Locus, um eine Kontaminationdurch die Feederzellen nachzuweisen. KontaminierteZelllinien zeigen hierbei einen einzelnenmausspezifischen Peak im Gegensatz zu reinenZelllinien schon bei einer Verunreinigung mitnur 1% Mauszellen (Abb. 2). Durch den Einsatzeines einfachen Tests zur Bestätigung der Reinheitund Identität einer Stammzelllinie kannder Verlust wertvoller Ressourcen und Zeit beider Entwicklung medizinischer Anwendungendurch die Verwendung unreiner Materialienverhindert werden.ZusammenfassungKreuzkontaminationen und falsche Zellidentifizierungenbeeinträchtigen die Arbeitenin Labor und Klinik; von wissenschaftlichenVeröffentlichungen mit fragwürdigen Ergebnissenbis hin zu Anwendungen von Stammzellenin der medizinischen Forschung. Deshalbist eine eindeutige Zelllinienbestimmung vonallgemeinem Interesse. Dennoch existierenbedeutende Lücken in der grundsätzlichenKontrolle von neuen und etablierten Zelllinien.Ohne eine gemeinsame Anstrengung aller Beteiligtenim Bereich der Authentifizierung vonZelllinien werden diese Probleme zukünftigstärker an Bedeutung gewinnen.Literatur[1] Drexler, H.G., Dirks, W.G. and MacLeod, R.A.F. (1999).Leukemia 13, 1601–7.[2] Drexler, H.G. et al. (2001). Blood 98, 3495–6.[3] Cabrera, C.M. et al. (2006). Cytotechnology 51, 45–50.[4] Chatterjee, R. (2007). Science 315, 928–31.[5] MacLeod, R.A.F. et al. (1999) . Int. J. Cancer 83, 555–63.[6] Buehring, G.C., Eby, E.A. and Eby, M.J. (2004). In VitroCell. Dev. Biol. Anim. 40, 211–5.[7] Liscovitch, M. and Ravid, D. (2007). Cancer Lett. 245,350–2.[8] Edwards, A. et al. (1991) DNA typing with trimeric andtetrameric tandem repeats: Polymorphic loci, detectionsystems, and population genetics. In: The Second InternationalSymposium on Human Identification 1991, PromegaCorporation, 31–52.[9] Edwards, A. et al. (1991). Am. J. Hum. Genet. 49, 746–56.[10] Edwards, A. et al. (1992). Genomics 12, 241–53.[11] Warne, D. et al. (1991). Nucleic Acids Res. 19, 6980.[12] ATCC Connection Newsletter (2001). 21, 1–2.[13] Masters, J.R. et al. (2001). Proc. Natl. Acad. Sci. USA 98,8012–7.[14] StemElite ID System Technical Manual, TM307, PromegaCorporationKorrespondenzadresseDr. Jan AdamPromega GmbHSchildkrötstr. 1568199 MannheimTel.: +49-(0)621-8501-278jan.adam@promega.com32 | 10. Jahrgang | Nr. 4/2009 LABORWELT