PDF Download - Laborwelt
PDF Download - Laborwelt
PDF Download - Laborwelt
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
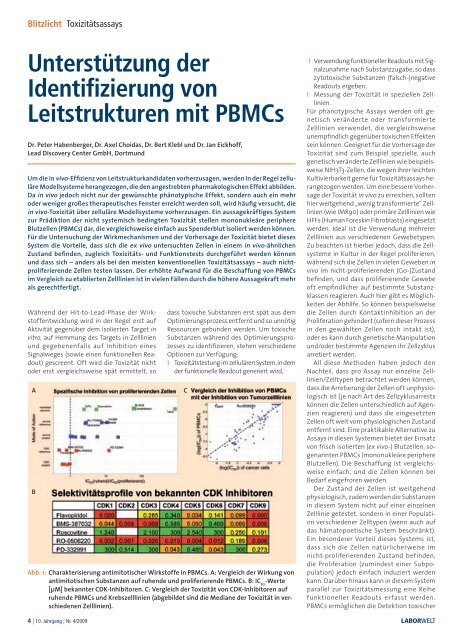
Blitzlicht ToxizitätsassaysUnterstützung derIdentifizierung vonLeitstrukturen mit PBMCsDr. Peter Habenberger, Dr. Axel Choidas, Dr. Bert Klebl und Dr. Jan Eickhoff,Lead Discovery Center GmbH, DortmundUm die in vivo-Effizienz von Leitstrukturkandidaten vorherzusagen, werden in der Regel zelluläreModellsysteme herangezogen, die den angestrebten pharmakologischen Effekt abbilden.Da in vivo jedoch nicht nur der gewünschte phänotypische Effekt, sondern auch ein mehroder weniger großes therapeutisches Fenster erreicht werden soll, wird häufig versucht, diein vivo-Toxizität über zelluläre Modellsysteme vorherzusagen. Ein aussagekräftiges Systemzur Prädiktion der nicht systemisch bedingten Toxizität stellen mononukleäre periphereBlutzellen (PBMCs) dar, die vergleichsweise einfach aus Spenderblut isoliert werden können.Für die Untersuchung der Wirkmechanismen und der Vorhersage der Toxizität bietet diesesSystem die Vorteile, dass sich die ex vivo untersuchten Zellen in einem in vivo-ähnlichenZustand befinden, zugleich Toxizitäts- und Funktionstests durchgeführt werden könnenund dass sich – anders als bei den meisten konventionellen Toxizitätsassays – auch nichtproliferierendeZellen testen lassen. Der erhöhte Aufwand für die Beschaffung von PBMCsim Vergleich zu etablierten Zelllinien ist in vielen Fällen durch die höhere Aussagekraft mehrals gerechtfertigt.Während der Hit-to-Lead-Phase der Wirkstoffentwicklungwird in der Regel erst aufAktivität gegenüber dem isolierten Target invitro, auf Hemmung des Targets in Zelllinienund gegebenenfalls auf Inhibition einesSignalweges (sowie einen funktionellen Readout)gescreent. Oft wird die Toxizität nichtoder erst vergleichsweise spät ermittelt, soABdass toxische Substanzen erst spät aus demOptimierungsprozess entfernt und so unnötigRessourcen gebunden werden. Um toxischeSubstanzen während des Optimierungsprozesseszu identifizieren, stehen verschiedeneOptionen zur Verfügung:I Toxizitätstestung im zellulären System, in demder funktionelle Readout generiert wird,Abb. 1: Charakterisierung antimitotischer Wirkstoffe in PBMCs. A: Vergleich der Wirkung vonantimitotischen Substanzen auf ruhende und proliferierende PBMCs. B: IC 50-Werte[µM] bekannter CDK-Inhibitoren. C: Vergleich der Toxizität von CDK-Inhibitoren aufruhende PBMCs und Krebszelllinien (abgebildet sind die Mediane der Toxizität in verschiedenenZelllinien).CI Verwendung funktioneller Readouts mit Signalzunahmenach Substanzzugabe, so dasszytotoxische Substanzen (falsch-)negativeReadouts ergeben,I Messung der Toxizität in speziellen Zelllinien.Für phänotypische Assays werden oft genetischveränderte oder transformierteZelllinien verwendet, die vergleichsweiseunempfindlich gegenüber toxischen Effektensein können. Geeignet für die Vorhersage derToxizität sind zum Beispiel spezielle, auchgenetisch veränderte Zelllinien wie beispielsweiseNIH3T3-Zellen, die wegen ihrer leichtenKultivierbarkeit gerne für Toxizitätsassays herangezogenwerden. Um eine bessere Vorhersageder Toxizität in vivo zu erreichen, solltenhier weitgehend „wenig transformierte“ Zelllinien(wie IMR90) oder primäre Zelllinien wieHFFs (Human Foreskin Fibroblasts) eingesetztwerden. Ideal ist die Verwendung mehrererZelllinien aus verschiedenen Gewebetypen.Zu beachten ist hierbei jedoch, dass die Zellsystemein Kultur in der Regel proliferieren,während sich die Zellen in vielen Geweben invivo im nicht-proliferierenden (G0-)Zustandbefinden, und dass proliferierende Gewebeoft empfindlicher auf bestimmte Substanzklassenreagieren. Auch hier gibt es Möglichkeitender Abhilfe. So können beispielsweisedie Zellen durch Kontaktinhibition an derProliferation gehindert (sofern dieser Prozessin den gewählten Zellen noch intakt ist),oder es kann durch genetische Manipulationund/oder bestimmte Agenzien ihr Zellzyklusarretiert werden.All diese Methoden haben jedoch denNachteil, dass pro Assay nur einzelne Zelllinien/Zelltypenbetrachtet werden können,dass die Arretierung der Zellen oft unphysiologischist (je nach Art des Zellzyklusarrestskönnen die Zellen unterschiedlich auf Agenzienreagieren) und dass die eingesetztenZellen oft weit vom physiologischen Zustandentfernt sind. Eine praktikable Alternative zuAssays in diesen Systemen bietet der Einsatzvon frisch isolierten (ex vivo-) Blutzellen, sogenanntenPBMCs (mononukleäre periphereBlutzellen). Die Beschaffung ist vergleichsweiseeinfach, und die Zellen können beiBedarf eingefroren werden.Der Zustand der Zellen ist weitgehendphysiologisch, zudem werden die Substanzenin diesem System nicht auf einer einzelnenZelllinie getestet, sondern in einer Populationverschiedener Zelltypen (wenn auch aufdas hämatopoetische System beschränkt).Ein besonderer Vorteil dieses Systems ist,dass sich die Zellen natürlicherweise imnicht-proliferierenden Zustand befinden,die Proliferation (zumindest einer Subpopulation)jedoch einfach induziert werdenkann. Darüber hinaus kann in diesem Systemparallel zur Toxizitätsmessung eine Reihefunktioneller Readouts erfasst werden.PBMCs ermöglichen die Detektion toxischer4 | 10. Jahrgang | Nr. 4/2009 LABORWELT