Jahresbericht SPh 2011 - Universitätsspital Basel
Jahresbericht SPh 2011 - Universitätsspital Basel
Jahresbericht SPh 2011 - Universitätsspital Basel
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
15<br />
Spital-Pharmazie<br />
<strong>Jahresbericht</strong><br />
1.5 Qualitätssicherung<br />
(Leitung: Dr. Stefanie Deuster)<br />
Die Spital-Pharmazie verfügt über ein umfassendes, etabliertes Qualitätsmanagement entsprechend<br />
der GMP-Vorgaben und die entsprechenden Swissmedic-Bewilligungen. Das machte es möglich, dass<br />
die Spital-Pharmazie in <strong>2011</strong> erstmals als Lohnhersteller Formula-Arzneimittel für andere Spitalapotheken<br />
in der Nordwestschweiz hergestellt hat. Damit leisten wir einen Beitrag zur Sicherstellung der<br />
Arzneimittelversorgung auch in anderen Schweizer Spitälern, deren Apotheken nicht über die aufwändige<br />
Infrastruktur für eine umfassende Arzneimittelherstellung verfügen.<br />
1.5.1 Dokumentenmanagement<br />
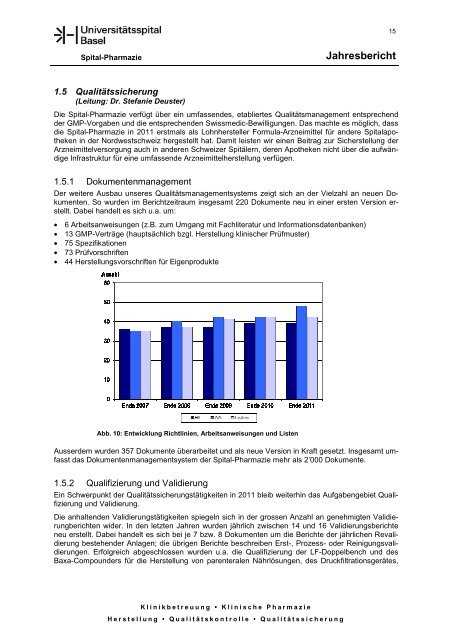
Der weitere Ausbau unseres Qualitätsmanagementsystems zeigt sich an der Vielzahl an neuen Dokumenten.<br />
So wurden im Berichtzeitraum insgesamt 220 Dokumente neu in einer ersten Version erstellt.<br />
Dabei handelt es sich u.a. um:<br />
• 6 Arbeitsanweisungen (z.B. zum Umgang mit Fachliteratur und Informationsdatenbanken)<br />
• 13 GMP-Verträge (hauptsächlich bzgl. Herstellung klinischer Prüfmuster)<br />
• 75 Spezifikationen<br />
• 73 Prüfvorschriften<br />
• 44 Herstellungsvorschriften für Eigenprodukte<br />
Abb. 10: Entwicklung Richtlinien, Arbeitsanweisungen und Listen<br />
Ausserdem wurden 357 Dokumente überarbeitet und als neue Version in Kraft gesetzt. Insgesamt umfasst<br />
das Dokumentenmanagementsystem der Spital-Pharmazie mehr als 2’000 Dokumente.<br />
1.5.2 Qualifizierung und Validierung<br />
Ein Schwerpunkt der Qualitätssicherungstätigkeiten in <strong>2011</strong> bleib weiterhin das Aufgabengebiet Qualifizierung<br />
und Validierung.<br />
Die anhaltenden Validierungstätigkeiten spiegeln sich in der grossen Anzahl an genehmigten Validierungberichten<br />
wider. In den letzten Jahren wurden jährlich zwischen 14 und 16 Validierungsberichte<br />
neu erstellt. Dabei handelt es sich bei je 7 bzw. 8 Dokumenten um die Berichte der jährlichen Revalidierung<br />
bestehender Anlagen; die übrigen Berichte beschreiben Erst-, Prozess- oder Reinigungsvalidierungen.<br />
Erfolgreich abgeschlossen wurden u.a. die Qualifizierung der LF-Doppelbench und des<br />
Baxa-Compounders für die Herstellung von parenteralen Nährlösungen, des Druckfiltrationsgerätes,<br />
K l i n i k b e t r e u u n g K l i n i s c h e P h a r m a z i e<br />
H e r s t e l l u n g Q u a l i t ä t s k o n t r o l l e Q u a l i t ä t s s i c h e r u n g