Geschäftsbericht - Roche in Deutschland
Geschäftsbericht - Roche in Deutschland
Geschäftsbericht - Roche in Deutschland
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
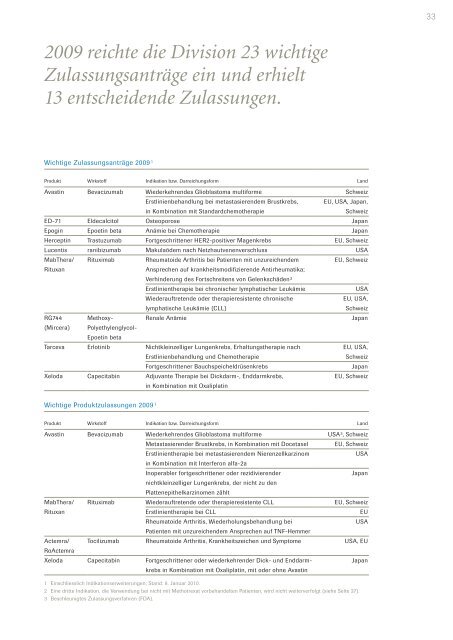
2009 reichte die Division 23 wichtige<br />
Zulassungsanträge e<strong>in</strong> und erhielt<br />
13 entscheidende Zulassungen.<br />
Wichtige Zulassungsanträge 2009 1<br />
Produkt Wirkstoff Indikation bzw. Darreichungsform Land<br />
Avast<strong>in</strong> Bevacizumab Wiederkehrendes Glioblastoma multiforme Schweiz<br />
Erstl<strong>in</strong>ienbehandlung bei metastasierendem Brustkrebs, EU, USA, Japan,<br />
<strong>in</strong> Komb<strong>in</strong>ation mit Standardchemotherapie<br />
Schweiz<br />
ED-71 Eldecalcitol Osteoporose Japan<br />
Epog<strong>in</strong> Epoet<strong>in</strong> beta Anämie bei Chemotherapie Japan<br />
Hercept<strong>in</strong> Trastuzumab Fortgeschrittener HER2-positiver Magenkrebs EU, Schweiz<br />
Lucentis ranibizumab Makulaödem nach Netzhautvenenverschluss USA<br />
MabThera/ Rituximab Rheumatoide Arthritis bei Patienten mit unzureichendem<br />
Rituxan<br />
Ansprechen auf krankheitsmodifizierende Antirheumatika;<br />
Verh<strong>in</strong>derung des Fortschreitens von Gelenkschäden 2<br />
EU, Schweiz<br />
Erstl<strong>in</strong>ientherapie bei chronischer lymphatischer Leukämie USA<br />
Wiederauftretende oder therapieresistente chronische<br />
EU, USA,<br />
lymphatische Leukämie (CLL)<br />
Schweiz<br />
RG744 Methoxy-<br />
Renale Anämie Japan<br />
(Mircera) Polyethylenglycol-<br />
Epoet<strong>in</strong> beta<br />
Tarceva Erlot<strong>in</strong>ib Nichtkle<strong>in</strong>zelliger Lungenkrebs, Erhaltungstherapie nach<br />
EU, USA,<br />
Erstl<strong>in</strong>ienbehandlung und Chemotherapie<br />
Schweiz<br />
Fortgeschrittener Bauchspeicheldrüsenkrebs Japan<br />
Xeloda Capecitab<strong>in</strong> Adjuvante Therapie bei Dickdarm-, Enddarmkrebs,<br />
<strong>in</strong> Komb<strong>in</strong>ation mit Oxaliplat<strong>in</strong><br />
EU, Schweiz<br />
Wichtige Produktzulassungen 2009 1<br />
Produkt Wirkstoff Indikation bzw. Darreichungsform Land<br />
Avast<strong>in</strong> Bevacizumab Wiederkehrendes Glioblastoma multiforme USA 3, Schweiz<br />
Metastasierender Brustkrebs, <strong>in</strong> Komb<strong>in</strong>ation mit Docetaxel EU, Schweiz<br />
Erstl<strong>in</strong>ientherapie bei metastasierendem Nierenzellkarz<strong>in</strong>om<br />
<strong>in</strong> Komb<strong>in</strong>ation mit Interferon alfa-2a<br />
USA<br />
Inoperabler fortgeschrittener oder rezidivierender<br />
Japan<br />
nicht kle<strong>in</strong>zelliger Lungenkrebs, der nicht zu den<br />
Plattenepithelkarz<strong>in</strong>omen zählt<br />
MabThera/ Rituximab Wiederauftretende oder therapieresistente CLL EU, Schweiz<br />
Rituxan Erstl<strong>in</strong>ientherapie bei CLL EU<br />
Rheumatoide Arthritis, Wiederholungsbehandlung bei<br />
Actemra/<br />
RoActemra<br />
Tocilizumab<br />
Patienten mit unzureichendem Ansprechen auf TNF-Hemmer<br />
Rheumatoide Arthritis, Krankheitszeichen und Symptome USA, EU<br />
Xeloda Capecitab<strong>in</strong> Fortgeschrittener oder wiederkehrender Dick- und Enddarmkrebs<br />
<strong>in</strong> Komb<strong>in</strong>ation mit Oxaliplat<strong>in</strong>, mit oder ohne Avast<strong>in</strong><br />
Japan<br />
1 E<strong>in</strong>schliesslich Indikationserweiterungen; Stand: 8. Januar 2010.<br />
2 E<strong>in</strong>e dritte Indikation, die Verwendung bei nicht mit Methotrexat vorbehandelten Patienten, wird nicht weiterverfolgt (siehe Seite 37).<br />
3 Beschleunigtes Zulassungsverfahren (FDA).<br />
USA<br />
33