Wissenschaftlicher Ergebnisbericht - Helmholtz-Zentrum für ...
Wissenschaftlicher Ergebnisbericht - Helmholtz-Zentrum für ...
Wissenschaftlicher Ergebnisbericht - Helmholtz-Zentrum für ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
104 WISSENSCHAFTLICHER ERGEBNISBERICHT | Infektion und Immunität | Strategien <strong>für</strong> Prävention und Therapie<br />
04.3 Antigentransportsysteme und Impfstoffe<br />
PROJEKTLEITER | Prof. Dr. Dr. Carlos A. Guzmán | Abteilung <strong>für</strong> Vakzinologie und Angewandte Mikrobiologie |<br />
cag@helmholtz-hzi.de<br />
PROJEKTMITARBEITER | Dr. Pablo D. Becker | Dr. Jennifer Debarry | Dr. Thomas Ebensen | Dr. Miriam Nörder |<br />
Dr. Peggy Riese | Rimma Libanova | Kirsten Scholz | Dr. Kai Schulze | Sebastian Weissmann | Dr. Beata Zygmunt<br />
Das Hauptziel dieses Projektes ist die Entwicklung von<br />
Werkzeugen und Strategien zur Verbesserung des Transports<br />
von Impfstoffantigenen, insbesondere über die Schleimhäute.<br />
Sie sollen anschließend bei der Herstellung von Impfstoffkandidaten<br />
gegen bestimmte Erkrankungen genutzt werden.<br />
Verbesserung des Antigen-Designs Sowohl eine Infektion<br />
mit Trypanosoma cruzi als auch eine Impfung gegen diesen<br />
Parasiten lösen eine starke Immunantwort aus. Dass T. cruzi<br />
dennoch im Wirt überleben kann, deutet auf unzureichende<br />
bzw. mangelhafte Immunantworten hin. Eine der Hauptcysteinproteinasen<br />
von T. cruzi, das sogenannte Cruzipain,<br />
weist gute Antigenmerkmale auf. Daher produzierten wir<br />
sowohl rekombinantes Cruzipain als auch dessen N- und Cterminale<br />
Domänen. Mäuse wurden mit den rekombinanten<br />
Proteinen in Kombination mit CpG-ODN immunisiert und die<br />
Antigen-spezifi schen Antikörperantworten analysiert. Die<br />
höchsten IgG-Titer wurden in Mäusen nachgewiesen, die mit<br />
der C-terminalen Domäne oder dem vollständigen Protein immunisiert<br />
wurden. Im Gegensatz dazu wurden nur schwache<br />
Antikörperantworten durch die N-terminale Domäne stimuliert.<br />
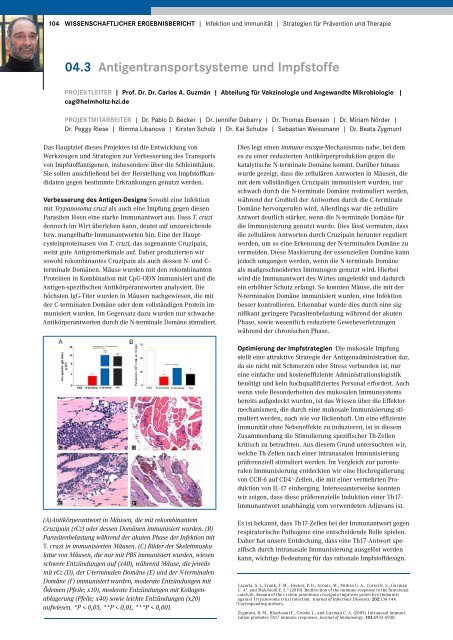
(A)Antikörperantwort in Mäusen, die mit rekombinantem<br />
Cruzipain (rCz) oder dessen Domänen immunisiert wurden. (B)<br />
Parasitenbelastung während der akuten Phase der Infektion mit<br />
T. cruzi in immunisierten Mäusen. (C) Bilder der Skelettmuskulatur<br />
von Mäusen, die nur mit PBS immunisiert wurden, wiesen<br />
schwere Entzündungen auf (x40), während Mäuse, die jeweils<br />
mit rCz (D), der C-terminalen Domäne (E) und der N-terminalen<br />
Domäne (F) immunisiert wurden, moderate Entzündungen mit<br />
Ödemen (Pfeile; x10), moderate Entzündungen mit Kollagenablagerung<br />
(Pfeile; x40) sowie leichte Entzündungen (x20)<br />
aufwiesen. *P < 0,05, **P < 0,01, ***P < 0,001.<br />
Dies legt einen immune escape-Mechanismus nahe, bei dem<br />
es zu einer reduzierten Antikörperproduktion gegen die<br />
katalytische N-terminale Domäne kommt. Darüber hinaus<br />
wurde gezeigt, dass die zellulären Antworten in Mäusen, die<br />
mit dem vollständigen Cruzipain immunisiert wurden, nur<br />
schwach durch die N-terminale Domäne restimuliert werden,<br />
während der Großteil der Antworten durch die C-terminale<br />
Domäne hervorgerufen wird. Allerdings war die zelluläre<br />
Antwort deutlich stärker, wenn die N-terminale Domäne <strong>für</strong><br />
die Immunisierung genutzt wurde. Dies lässt vermuten, dass<br />
die zellulären Antworten durch Cruzipain herunter reguliert<br />
werden, um so eine Erkennung der N-terminalen Domäne zu<br />
vermeiden. Diese Maskierung der essenziellen Domäne kann<br />
jedoch umgangen werden, wenn die N-terminale Domäne<br />
als maßgeschneidertes Immunogen genutzt wird. Hierbei<br />
wird die Immunantwort des Wirtes umgelenkt und dadurch<br />
ein erhöhter Schutz erlangt. So konnten Mäuse, die mit der<br />
N-terminalen Domäne immunisiert wurden, eine Infektion<br />
besser kontrollieren. Erkennbar wurde dies durch eine signifi<br />
kant geringere Parasitenbelastung während der akuten<br />
Phase, sowie wesentlich reduzierte Gewebeverletzungen<br />
während der chronischen Phase.<br />
Optimierung der Impfstrategien Die mukosale Impfung<br />
stellt eine attraktive Strategie der Antigenadministration dar,<br />
da sie nicht mit Schmerzen oder Stress verbunden ist, nur<br />
eine einfache und kosteneffi ziente Administrationslogistik<br />
benötigt und kein hochqualifi ziertes Personal erfordert. Auch<br />
wenn viele Besonderheiten des mukosalen Immunsystems<br />
bereits aufgedeckt wurden, ist das Wissen über die Effektormechanismen,<br />
die durch eine mukosale Immunisierung stimuliert<br />
werden, nach wie vor lückenhaft. Um eine effi ziente<br />
Immunität ohne Nebeneffekte zu induzieren, ist in diesem<br />
Zusammenhang die Stimulierung spezifi scher Th-Zellen<br />
kritisch zu betrachten. Aus diesem Grund untersuchten wir,<br />
welche Th-Zellen nach einer intranasalen Immunisierung<br />
präferenziell stimuliert werden. Im Vergleich zur parenteralen<br />
Immunisierung entdeckten wir eine Hochregulierung<br />
von CCR-6 auf CD4 + -Zellen, die mit einer vermehrten Produktion<br />
von IL-17 einherging. Interessanterweise konnten<br />
wir zeigen, dass diese präferenzielle Induktion einer Th17-<br />
Immunantwort unabhängig vom verwendeten Adjuvans ist.<br />
Es ist bekannt, dass Th17-Zellen bei der Immunantwort gegen<br />
respiratorische Pathogene eine entscheidende Rolle spielen.<br />
Daher hat unsere Entdeckung, dass eine Th17-Antwort spezifi<br />
sch durch intranasale Immunisierung ausgelöst werden<br />
kann, wichtige Bedeutung <strong>für</strong> das rationale Impfstoffdesign.<br />
Cazorla, S. I., Frank, F. M. , Becker, P. D., Arnaiz, M., Mirkin G. A., Corral R. S., Guzmán<br />
C. A*. and Malchiodi E. L.* (2010). Redirection of the immune response to the functional<br />
catalytic domain of the cystein proteinase cruzipain improves protective immunity<br />
against Trypanosoma cruzi infection. Journal of Infectious Diseases. 202:136-144.<br />
*Corresponding authors.<br />
Zygmunt, B. M., Rharbaoui F., Groebe L., and Guzman C. A. (2009). Intranasal immunization<br />
promotes Th17 immune responses. Journal of Immunology. 183:6933-6938.