Descargar PDF (2.9Mb) - SEOC
Descargar PDF (2.9Mb) - SEOC
Descargar PDF (2.9Mb) - SEOC
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
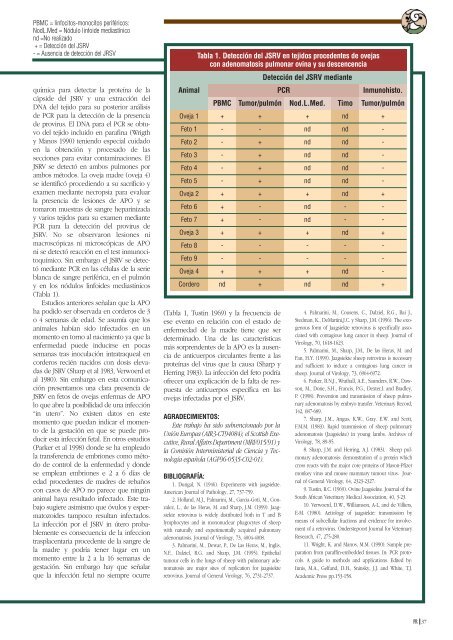
PBMC = linfocitos-monocitos periféricos:<br />
NodL.Med = Nódulo linfoide mediastínico<br />
nd =No realizado<br />
+ = Detección del JSRV<br />
- = Ausencia de detección del JRSV<br />
química para detectar la proteína de la<br />
cápside del JSRV y una extracción del<br />
DNA del tejido para su posterior análisis<br />
de PCR para la detección de la presencia<br />
de provirus. El DNA para el PCR se obtuvo<br />
del tejido incluido en parafina (Wrigth<br />
y Manos 1990) teniendo especial cuidado<br />
en la obtención y procesado de las<br />
secciones para evitar contaminaciones. El<br />
JSRV se detectó en ambos pulmones por<br />
ambos métodos. La oveja madre (oveja 4)<br />
se identificó procediendo a su sacrificio y<br />
examen mediante necropsia para evaluar<br />
la presencia de lesiones de APO y se<br />
tomaron muestras de sangre heparinizada<br />
y varios tejidos para su examen mediante<br />
PCR para la detección del provirus de<br />
JSRV. No se observaron lesiones ni<br />
macroscópicas ni microscópicas de APO<br />
ni se detectó reacción en el test inmunocitoquímico.<br />
Sin embargo el JSRV se detectó<br />
mediante PCR en las células de la serie<br />
blanca de sangre periférica, en el pulmón<br />
y en los nódulos linfoides mediastínicos<br />
(Tabla 1).<br />
Estudios anteriores señalan que la APO<br />
ha podido ser observada en corderos de 3<br />
o 4 semanas de edad. Se asumía que los<br />
animales habían sido infectados en un<br />
momento en torno al nacimiento ya que la<br />
enfermedad puede inducirse en pocas<br />
semanas tras inoculación intratraqueal en<br />
corderos recién nacidos con dosis elevadas<br />
de JSRV (Sharp et al 1983, Verwoerd et<br />
al 1980). Sin embargo en esta comunicación<br />
presentamos una clara presencia de<br />
JSRV en fetos de ovejas enfermas de APO<br />
lo que abre la posibilidad de una infección<br />
“in utero”. No existen datos en este<br />
momento que puedan indicar el momento<br />
de la gestación en que se puede producir<br />
esta infección fetal. En otros estudios<br />
(Parker et al 1998) donde se ha empleado<br />
la transferencia de embriones como método<br />
de control de la enfermedad y donde<br />
se emplean embriones e 2 a 6 días de<br />
edad procedentes de madres de rebaños<br />
con casos de APO no parece que ningún<br />
animal haya resultado infectado. Este trabajo<br />
sugiere asimismo que óvulos y espermatozoides<br />
tampoco resultan infectados.<br />
La infección por el JSRV in útero probablemente<br />
es consecuencia de la infeccion<br />
trasplacentaria procedente de la sangre de<br />
la madre y podría tener lugar en un<br />
momento entre la 2 a la 16 semanas de<br />
gestación. Sin embargo hay que señalar<br />
que la infección fetal no siempre ocurre<br />
Animal<br />
Oveja 1 + + + nd +<br />
Feto 1<br />
Feto 2<br />
Feto 3<br />
Feto 4<br />
Feto 5<br />
Oveja 2<br />
Feto 6<br />
Feto 7<br />
Oveja 3<br />
Feto 8<br />
Feto 9<br />
Oveja 4<br />
Cordero<br />
Tabla 1. Detección del JSRV en tejidos procedentes de ovejas<br />
con adenomatosis pulmonar ovina y su descencencia<br />
Detección del JSRV mediante<br />
PCR<br />
Inmunohisto.<br />
PBMC Tumor/pulmón Nod.L.Med. Timo Tumor/pulmón<br />
- - nd nd -<br />
- + nd nd -<br />
- + nd nd -<br />
- + nd nd -<br />
- + nd nd -<br />
+ + + nd +<br />
+ - nd - -<br />
+ - nd - -<br />
+ + + nd +<br />
- - - - -<br />
- - - - -<br />
+ + + nd -<br />
nd + nd nd +<br />
(Tabla 1, Tustin 1969) y la frecuencia de<br />
ese evento en relación con el estado de<br />
enfermedad de la madre tiene que ser<br />
determinado. Una de las características<br />
más sorprendentes de la APO es la ausencia<br />
de anticuerpos circulantes frente a las<br />
proteínas del virus que la causa (Sharp y<br />
Herring 1983). La infección del feto podría<br />
ofrecer una explicación de la falta de respuesta<br />
de anticuerpos específica en las<br />
ovejas infectadas por el JSRV.<br />
AGRADECIMIENTOS:<br />
Este trabajo ha sido subvencionado por la<br />
Unión Europea (AIR3-CT94084), el Scottish Executive,<br />
Rural Affairs Department (MRI/015/91) y<br />
la Comisión Interministerial de Ciencia y Tecnología<br />
española (AGF96-0535-C02-01).<br />
BIBLIOGRAFÍA:<br />
1. Dungal, N. (1946). Experiments with jaagsiekte.<br />
American Journal of Pathology, 27, 737-759.<br />
2. Holland, M.J., Palmarini, M., Garcia-Goti, M., Gonzalez,<br />
L., de las Heras, M. and Sharp, J.M. (1999). Jaagsiekte<br />
retrovirus is widely distributed both in T and B<br />
lymphocytes and in mononuclear phagocytes of sheep<br />
with naturally and experimentally acquired pulmonary<br />
adenomatosis. Journal of Virology, 73, 4004-4008.<br />
3. Palmarini, M., Dewar, P., De Las Heras, M., Inglis,<br />
N.F., Dalziel, R.G. and Sharp, J.M. (1995). Epithelial<br />
tumour cells in the lungs of sheep with pulmonary adenomatosis<br />
are major sites of replication for jaagsiekte<br />
retrovirus. Journal of General Virology, 76, 2731-2737.<br />
4. Palmarini, M., Cousens, C., Dalziel, R.G., Bai J.,<br />
Stedman, K., DeMartini,J.C. y Sharp, J.M. (1996). The exogenous<br />
form of Jaagsiekte retrovirus is specifically associated<br />
with contagious lung cancer in sheep. Journal of<br />
Virology, 70, 1618-1623.<br />
5. Palmarini, M., Sharp, J.M., De las Heras, M. and<br />
Fan, H.Y. (1999). Jaagsiekte sheep retrovirus is necessary<br />
and sufficient to induce a contagious lung cancer in<br />
sheep. Journal of Virology, 73, 6964-6972.<br />
6. Parker, B.N.J., Wrathall, A.E., Saunders, R.W., Dawson,<br />
M., Done, S.H., Francis, P.G., Dexter,I. and Bradley,<br />
P. (1998). Prevention and transmission of sheep pulmonary<br />
adenomatosis by embryo transfer. Veterinary Record,<br />
142, 687-689.<br />
7. Sharp, J.M., Angus, K.W., Gray. E.W. and Scott,<br />
F.M.M. (1983). Rapid transmission of sheep pulmonary<br />
adenomatosis (Jaagsiekte) in young lambs. Archives of<br />
Virology, 78, 89-95.<br />
8. Sharp, J.M. and Herring, A.J. (1983). Sheep pulmonary<br />
adenomatosis: demonstration of a protein which<br />
cross reacts with the major core proteins of Mason-Pfizer<br />
monkey virus and mouse mammary tumour virus. Journal<br />
of General Virology, 64, 2323-2327.<br />
9. Tustin, R.C. (1969). Ovine Jaagsiekte. Journal of the<br />
South African Veterinary Medical Association, 40, 3-23.<br />
10. Verwoerd, D.W., Williamson, A-L. and de Villiers,<br />
E-M. (1980). Aetiology of jaagsiekte: transmission by<br />
means of subcellular fractions and evidence for involvement<br />
of a retrovirus. Onderstepoort Journal for Veterinary<br />
Research, 47, 275-280.<br />
11. Wright, K. and Manos, M.M. (1990). Sample preparation<br />
from paraffin-embedded tissues. In: PCR protocols.<br />
A guide to methods and applications. Edited by:<br />
Innis, M.A., Gelfand, D.H., Sninsky, J.J. and White, T.J.<br />
Academic Press pp.153-158.<br />
PR 37