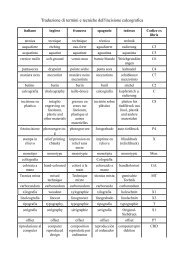
Trattato di litografia e moderne applicazioni - Toni Pecoraro
Trattato di litografia e moderne applicazioni - Toni Pecoraro
Trattato di litografia e moderne applicazioni - Toni Pecoraro
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Una <strong>di</strong>minuzione li trasforma in soli<strong>di</strong>.<br />
Cosi il Mercurio liquido alla temperatura or<strong>di</strong>naria, si soli<strong>di</strong>fica a - 42, l'Acqua a - 0, l'Alcool a<br />
- 170; per converso il ferro si liquefa a + 1700, l'Alluminio a + 1560, lo Zinco a + 400, il Sego a + 44, lo<br />
Colofonia a + 47, il Vetro a + 600.<br />
Questa è lo regola generale, però negli ultimi trovati della scienza, esiste anche un quarto stato della<br />
materia, nella quale sono <strong>di</strong>strutte le forme solide o fluide.<br />
È lo stato etereo o jonico, nel quale le particelle sono tanto piccole che non si toccano, anzi nel rapporto del<br />
volume, sono tanto lontane quanto sarebbe un astro da noi.<br />
Il calore non ha più azione sovr'essa, non può ne bruciare, ne gelare.<br />
I nostri sensi ed i nostri più delicati istrumenti non possono rivelarne l'esistenza.<br />
Essa empirebbe tutto l'universo, propagherebbe le onde elettriche magnetiche e luminose fra gli spazii<br />
siderei e pur esistendo sarebbe il vuoto.<br />
Riprendendo le materie che c'interessano, nella forma che i nostri sensi possono percepire, cercherò <strong>di</strong> dare<br />
una pallida idea dell'immenso quantitativo che è profuso sulla nostra terra.<br />
L'ossigeno come anzidetto è il componente dell'aria che respiriamo.<br />
Questa ha un peso reale. Sopra lo spazio <strong>di</strong> un centimetro quadrato è <strong>di</strong> Kg. 1.033. Ora quanti centimetri<br />
quadrati ha la superficie del nostro globo e tanti sono i Kg.1.033.<br />
È la pressione che si chiama atmosfera. Moltiplicando i due fattori uno per l'altro rappresenterebbe il peso<br />
totale dell'aria che ci circonda della quale il 21 % è puro ossigeno.<br />
Con questa operazione si otterrebbe una cifra seguita da una tal ridda <strong>di</strong> zeri che perderebbe ogni valore<br />
trascrivendola. Questo non sarebbe che una frazione della quantità, poiché esso si combina con tutto, li<br />
trasforma, li soli<strong>di</strong>fica o meglio li ossida. Il suo potere <strong>di</strong>sorganizzante è cosi grande che nulla sfugge alla sua<br />
azione, salvo poche eccezioni.<br />
L'acqua è ossigeno combinato con un altro gas: l'idrogeno. Il ferro arrugginisce al suo contatto, formando<br />
perossido <strong>di</strong> ferro. La fiamma arde perché trova in esso il suo alimento, toglietelo e si spegnerà prontamente,<br />
il vino inaci<strong>di</strong>sce perché, trasforma il suo alcool in acido acetico, la polvere da sparo detona perché nei suoi<br />
composti vi è accumulato tanto ossigeno che le permette una pronta accensione.<br />
E' dunque naturale che entri anche nelle nostre pietre a farne parte costitutiva. Si combina per affinità con<br />
due equivalenze <strong>di</strong> carbonio per fare l'acido carbonico, che troviamo nei nostri vini spumeggianti, nella birra,<br />
nelle acque gasose artificiali o naturali.<br />
Lievita la massa del pane, si sviluppa dai carboni ardenti, procurando accidenti a chi non arieggia<br />
bastantemente gli ambienti, dà il colore alle foglie, alle frutta, ai fiori, ed è la base delle essenze odorose,<br />
delle nafte, dei petroli se vi si aggiunge in dovute proporzioni altri corpi: l'idrogeno e l'azoto.<br />
Come è <strong>di</strong>mostrato nella tabella, il suo simbolo è O o facciamo precedere da C che è quello del carbonio<br />
faremo la formola C + O che è quanto <strong>di</strong>re il nome dei due corpi. Aggiungendo un piccolo 2 all'O<br />
numereremo le equivalenze <strong>di</strong> ossigeno, e la formola sarà:<br />
C+O²<br />
che corrisponde a quella dell'acido carbonico, mentre i simboli non numerati equivalgono sempre ad 1 come<br />
la prima e sarebbe ossido <strong>di</strong> carbonio.<br />
Non mi addentrerò in più minuti dettagli, <strong>di</strong>venterebbe troppo complicato, perché quell'1 è sempre<br />
rappresentato da un numero <strong>di</strong> atomi che sarebbero 8 per l'ossigeno e tutti i corpi ne hanno un numero<br />
determinato <strong>di</strong>verso che sarebbe la loro forma atomica <strong>di</strong> combinazione.<br />
Siccome questo trattato è uno stu<strong>di</strong>o più <strong>di</strong>mostrativo che scientifico, consiglio a coloro che maggiormente<br />
vorranno estendere le loro cognizioni, <strong>di</strong> rivolgersi ad una scuola <strong>di</strong> chimica.<br />
Passando al terzo corpo, il calcio, ho già accennato alla sua importanza nella natura.<br />
È la parte basica della pietra. Sottraendo da essa il suo ossigeno, per mezzo <strong>di</strong> potenti correnti elettriche,<br />
rimane il calcio ed il carbonio, che colla formola:<br />
Ca + C<br />
è il carburo <strong>di</strong> calce il quale, avi<strong>di</strong>ssimo dell'acqua, al suo contatto si decompone trasformandosi in ossido <strong>di</strong><br />
calce spenta, sprigionando nel contempo un gas infiammabilissimo, l'acetilene, usato per una nuova forma<br />
d'illuminazione e <strong>di</strong> riscaldamento.<br />
Se invece si elimina il carbonio per mezzo del calore, si trasforma in calce anidra cioè viva; senza acqua <strong>di</strong><br />
cristallizzazione e si simboleggia colla formola:<br />
Ca + O²<br />
In questo stato è così avida <strong>di</strong> acqua che al suo contatto si scalda fortemente finché si sia combinata<br />
completamente.<br />
La malta dei muratori è adoperata fredda e viene mescolata a sabbia o ghiaia colla quale si fabbricano case,<br />
argini, pavimenti, ecc.<br />
14