molecole trasportatrici di o negli animali : mioglobina ed emoglobina
molecole trasportatrici di o negli animali : mioglobina ed emoglobina
molecole trasportatrici di o negli animali : mioglobina ed emoglobina
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
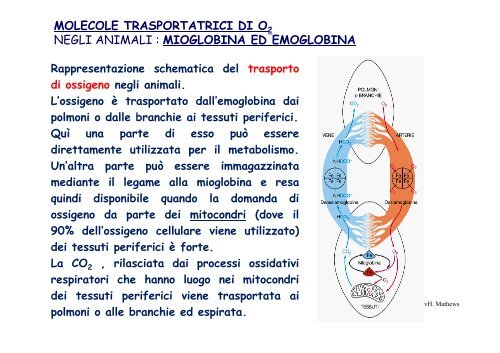
MOLECOLE TRASPORTATRICI DI O 2NEGLI ANIMALI : MIOGLOBINA ED EMOGLOBINARappresentazione schematica del trasporto<strong>di</strong> ossigeno <strong>negli</strong> <strong>animali</strong>.L’ossigeno è trasportato dall’<strong>emoglobina</strong> l daipolmoni o dalle branchie ai tessuti periferici.Quì una parte <strong>di</strong> esso può essere<strong>di</strong>rettamente utilizzata per il metabolismo.Un’altra parte può essere immagazzinatame<strong>di</strong>ante il legame alla <strong>mioglobina</strong> e resaquin<strong>di</strong> <strong>di</strong>sponibile quando la domanda <strong>di</strong>ossigeno da parte dei mitocondri (dove il90% dell’ossigeno cellulare viene utilizzato)dei tessuti periferici è forte.La CO 2 , rilasciata dai processi ossidativirespiratori che hanno luogo nei mitocondridei tessuti periferici viene trasportata aipolmoni o alle branchie <strong>ed</strong> espirata.da: vH. Mathews
O 2 , essendo un gas, è poco solubile in soluzione acquosa. Lasua concentrazione in soluzione è proporzionale alla suapressione parziale.Sangue arterioso: pO 2 = 100 mm Hg (13,33 kPa);[O 2 ] = 0,13 mmol/lSangue arterioso: [Hb] = 150 g/l;[O 2 ] = 8,6 mmol/lLa presenza dell’Hb aumenta <strong>di</strong> ~ 70 volte la capacità delsangue <strong>di</strong> trasportare O 2 .O 2permette l’estrazione <strong>di</strong> energia da 1 molecola <strong>di</strong> glucosiomaggiore <strong>di</strong>15volte:Organismi anaerobi: 1 molecola <strong>di</strong> Glucosio →2 ATPOrganismi aerobi: 1 molecola <strong>di</strong> Glucosio → 30 ATPLa maggior <strong>di</strong>sponibilità <strong>di</strong> energia utilizzabile dalla cellula percompiere lavoro (ATP) ha permesso l’evoluzione degli organismisuperiori sino all’uomo.
Eit Eritrocita = un sacchetto pieno <strong>di</strong> <strong>emoglobina</strong> e poche altre<strong>molecole</strong>; non contiene nucleo nè mitocondri; non si ha sintesiproteica. Necessità <strong>di</strong> vita breve non avendo la capacità <strong>di</strong>sostituire eventuali componenti danneggiati.Eritrocita: t 1/2 20 gg Contenuto <strong>di</strong> Hb 150 g/lHb occupa gran parte del volume dell’eritrocita
MIOGLOBINA ED EMOGLOBINA: proteine coniugatePROTEINE E CONIUGATE: apoproteina p + gruppo prosteticoApoproteina = catena polipepti<strong>di</strong>ca = GlobinaGruppo prostetico → gruppo non proteico → Eme →responsabile del colore rosso per la presenza <strong>di</strong> Fe +2MIOGLOBINAEMOGLOBINA( monomerica)( polimerica)i Biochimica per le <strong>di</strong>scipline biome<strong>di</strong>che ELSEVIER Srl 2011
Molecola purificata dai muscoli <strong>di</strong> capodoglioStruttura tri<strong>di</strong>mensionale terziaria definita dal Premio Nobel Kendrew nel1950 con la cristallografia ai raggi X)153 AA; una sola catenapolipepti<strong>di</strong>ca75% a-elica:8 segmenti(daA ad H);7 gomitiStruttura terziaria:core idrofobico: solo 4<strong>molecole</strong> <strong>di</strong> H 2 OTasca idrofobica tra isegmenti E <strong>ed</strong> F: legal’EMENella tasca idrofobica: solo2 His (AA idrofilici) = ruolofunzionale; devono essere acontatto con l’ambienteesternoHarper's. Biochimica illustrata. Ed.EMSI 2011
La Mioglobina ha un solo sito <strong>di</strong> legame per l’ossigenoda: Nelson & CoxCurva o gomito o ripiegamento4 proline nella molecolal’Eme è legato alla globinada numerosi legami deboliper lo più idrofobici e dallegame <strong>di</strong> coor<strong>di</strong>namentocon la His prossimale (F8)
EMOGLOBINA: prima proteina polimerica <strong>di</strong> cui è stata definita la strutturaquaternaria- Molecola quasi sferica ∅50Å; quattro cateneorganizzate a tetra<strong>ed</strong>ro,unite da interazioni noncovalentiHbA α 2 β 2- 4 Gruppi eme posti infessure vicine allasuperficie della molecola-I 4 siti per l’O sono Ogni subunità <strong>di</strong> Hb è molto2molto <strong>di</strong>stanti fra loro, lasimile il alla catena della<strong>di</strong>stanza fra i due atomi <strong>di</strong><strong>mioglobina</strong>: la catena α mancaFe più vicini è 25Ådel segmento D.Lega 4 <strong>molecole</strong> <strong>di</strong> O 2Harper's. Biochimica illustrata. Ed.EMSI 2011
EMOGLOBINA (Hb)Struttura tt tri<strong>di</strong>mensionale i quaternaria stu<strong>di</strong>ata t ai raggi X (come la Mb)dal Premio Nobel Perutz 1936 → 1959- 4 catene polipepti<strong>di</strong>che unite da interazioni non covalentiNell’adulto 98% Hb A → α 2 β 22% Hb A δ2% Hb A 2 → α 2 δ 2Nell’embrione Hb E → α 2 ε 2 ζ 2 ε 2 ζ 2 γ 2Nel feto Hb F → α 2 γ 2Catena αζ141 AACatene β δ γ 146 AA molto simili tra loroHarper's. Biochimica illustrata. Ed.EMSI 2011
Sono note le sequenze AA delle Hb da più <strong>di</strong> 60 specie (lampr<strong>ed</strong>a → uomo).Notevoli variabilità per la maggior parte delle posizioni in quasi tutte le specie.In 9 posizioni però c’è cèsempre lo stesso AA (residui costanti:costrizioni funzionali)RESIDUI ESSENZIALI DELLA EMOGLOBINA (costrizioni funzionali)PosizioniF8E7CD1F4B6C2HC2C4H10Aminoaci<strong>di</strong>HisHisPheLeuGlyProTyrThrLysRuoloIsti<strong>di</strong>na prossimale, lega EmeIsti<strong>di</strong>na <strong>di</strong>stale, vicina EmeIn contatto con Eme*In contatto con Eme*Permette la stretta vicinanza tra eliche B e ETermine dell’elica (gomito della catena polipept.)Lega tra loro eliche H e FLe forti caratteristiche non polari dell’interno si conservano inalterate a causa dellasostituzione tra AA idrofobici. Molto più variabili sono i residui della superficie dellamolecola.* Contribuisce a creare l’ambiente idrofobico necessario all’eme ostruendonela tasca idrofobica.
Confronto tra la struttura primaria (sequenze AA) della Mb <strong>di</strong> Capodoglio e lecatene α e β <strong>di</strong> Hb umana (confronto tra proteine <strong>di</strong>verse che hanno la stessafunzione)Solo 27 AA risultano identici dal confronto delle catene Mb, Hbα e Hbββo identicima ~ 40% o sostituzioni conservative (AA con le stesse caratteristiche,i.e. R idrofobico con R idrofobico)Le somiglianze sono maggiori tra le catene α e β <strong>di</strong> Hb che non tra queste e Mb a causadelle DIVERSE PRESSIONI EVOLUTIVE sul gene della catena mioglobinica →monomerica e su quelli delle catene dell’Hb → oligomeri <strong>di</strong> un tetrameroNelle catene α e β occorrono sulla superficie <strong>di</strong> contatto, potenzialità <strong>di</strong> legame einterazioni non richiesta nella Mioglobina:13 residui che nella struttura terziaria occupano posizioni analoghe:- sono polari perché rivolti verso la soluzione acquosa nella <strong>mioglobina</strong>- sono idrofobici perché si trovano nelle zone <strong>di</strong> contatto degli oligomeri nelle catene αe β
Biochimica per le <strong>di</strong>scipline biome<strong>di</strong>che ELSEVIER Srl 2011
Confronto tra la struttura terziaria <strong>di</strong> Mb e <strong>di</strong> una subunità Hbda: Nelson & Cox→ Sequenze molto <strong>di</strong>verse possono specificare strutture moltosimili
RAPPORTO GLOBINA:EMEIn H 2 O, l’eme leme isolato è in grado <strong>di</strong> legare l’O lO 2 solo per un attimo, poiché l’Eme lEme ferroso siossida molto rapidamente a EME ferrico con la formazione <strong>di</strong> un interme<strong>di</strong>o EME-O 2 -EME, sandwich, l’ossigeno viene legato irreversibilmente.Ruolo dell’apoproteinaL’avvolgimento globinico è l’avvolgimento nello spazio <strong>di</strong> una catena polipepti<strong>di</strong>ca che portaalla formazione <strong>di</strong> una cavità idrofobica per l’EME: lEME: porta 60 e più atomi <strong>di</strong> residui apolaridella proteina a contatto con l’Eme.In generale: la funzione <strong>di</strong> un gruppo prostetico <strong>di</strong>pende in parte dall’ambiente proteicoche lo circonda. Es. eme trasporta elettroni invece <strong>di</strong> O 2 in citocromo c e catalasi.In Mb e Hb la His <strong>di</strong>stale e altri residui intorno all’EME impe<strong>di</strong>scono la formazion<strong>ed</strong>ell’interme<strong>di</strong>o EME-O 2 -EME.il sito non polare che lega l’eme, escludendo l’H 2 O dall’ambiente, PROTEGGE LO STATOFERROSO DELL’EME DALL’OSSIDAZIONE (è molto più <strong>di</strong>fficile strappare un e - )SOLOnello stato ferroso l’eme lemelegalega l’ossigeno reversibilmente.La FUNZIONE DELLA GLOBINA non è tanto quella <strong>di</strong> fare da supportoall’Eme, quanto fornire al ferro un microambiente idrofobico essenziale perlo scambio <strong>di</strong> O 2
EME in Mb e Hb= PROTOPORFIRINA IX + Fe +2(parte organica) (parte inorganica)PROTOPORFIRINA:4 gruppi pirrolici uniti da pontimetinici, anello tetrapirrolicoplanarePROTOPORFIRINA IXSostituenti:4METILI2 VINILI2 PROPIONATIFe-protoporfirina IX
Il Fe +2 forma 4 legami <strong>di</strong> coor<strong>di</strong>nazione con i 4 N della protoporfirina (sul pianodell’EME)Il Fe +2 può formare altri 2 legami (5 a e 6 a posizione <strong>di</strong> coor<strong>di</strong>nazione) in<strong>di</strong>rezioni opposte tra loro e perpen<strong>di</strong>colari al piano dell’EME.5NNNN6
da: Nelson & Cox(prossimale, F8)-Il Fe +2 si lega ad una delle isti<strong>di</strong>ne con la 5 a posizione <strong>di</strong> coor<strong>di</strong>nazione del Fe +2 :His F8 o His PROSSIMALE-l’O 2 si lega all’eme con la 6 a posizione <strong>di</strong> coor<strong>di</strong>nazione del Fe +2 . Il sito <strong>di</strong> legame<strong>di</strong> O 2 si trova sul piano dell’EME dal lato opposto ad F8-Fe+2 (Ferroso) → Ferro<strong>mioglobina</strong>-Fe+3 (Ferrico) → Ferri<strong>mioglobina</strong> (o meta<strong>mioglobina</strong>)Solo la prima forma è capace <strong>di</strong> legare in forma reversibile O 2Un secondo residuo <strong>di</strong> isti<strong>di</strong>na HIS E7-HIS DISTALE si trova nelle vicinanzee forma un legame H con l’O 2
da: Nelson & Cox
• Il gruppo EME è situato t nella tascaidrofobica della <strong>mioglobina</strong>• Le catene laterali <strong>di</strong> propionato puntanoverso la superficie i della molecola l : a pHfisiologico sono ionizzate• -Il resto dell’EME è dentro la tascacircondato da residui i non polari:fannoeccezione le 2 isti<strong>di</strong>ne F8 <strong>ed</strong> E7• -Il Fe +2 nella deossi<strong>mioglobina</strong> è spostato<strong>di</strong> circa 0.3 Å fuori dal piano dell’EMEverso l’His prossimaleLo stesso vale per la Emoglobina
Basi strutturali della <strong>di</strong>minuita affinità <strong>di</strong> Mb e Hb per COMb <strong>ed</strong> Hb legano anche CO: molto importante dal punto <strong>di</strong> vista biologico perchéil metabolismo dell’EME libera CO1% dei siti Hb e Mb occupati da CO tollerabilese Hb e Mb affinità EME = per CO libero intollerabileEME libero e in soluzione lega CO 25000 > <strong>di</strong> O 2Mb e Hb affinità per CO 200 > O 2E’ stato <strong>di</strong>mostrato attraverso:•RX su cristalli•Spettroscopia dell’IR dei complessi CO e O 2 con Mb•Modelli sinteticiche la <strong>di</strong>minuita affinità <strong>di</strong> Mb e Hb per CO sta nella <strong>di</strong>versa geometria degliangoli Fe-CO nell’EME libero e nella CO-Hb o CO MbCO = veleno = blocca trasporto <strong>di</strong> O 2 : <strong>di</strong>minuisce siti <strong>di</strong>sponibili a legare O 2Fumo = occupazione <strong>di</strong> molti siti <strong>di</strong> Hb da CO: respirazione alterata
Mb e Hb legano COda: Campbell & Farrell(a) Eme liberocon imidazolo(b) ComplessoMb:CO(c) Ossi<strong>mioglobina</strong>Harper's. Biochimica illustrata. Ed.EMSI 2011L’ossigeno e il monossido <strong>di</strong> carbonio legati al gruppo EME della <strong>mioglobina</strong>.La presenza dell’isti<strong>di</strong>na E7 forza l’ossigeno o il CO a formare un legame con un angolo<strong>di</strong> 120°
CONFORMAZIONI strutturali della EMOGLOBINA funzionali altrasporto <strong>di</strong> OssigenoE’ stata postulata e poi <strong>di</strong>mostrata l’esistenza <strong>di</strong> due strutture quaternarie per l’Hb- una forma con legami più numerosi e più forti, con minore affinità per O 2 – Forma T(tesa)- una forma con legami più scarsi o più deboli, con maggiore affinità per O 2 – Forma R(rilassata) e la transizione TR in seguito a ossigenazione.
1) I cristalli <strong>di</strong> Hb si rompono quando l’Hb viene ossigenata ⇒ struttura #2) Diverso spettro O.D. <strong>emoglobina</strong> ossi e deossi3) Stu<strong>di</strong>o ai RX ⇒ # struttura 4 aOssigenazione ⇒i due EME β si avvicinano (39.9 33.4Å)i due EME α si allontananola cavità centrale si restringeHarper's. Biochimica illustrata. Ed.EMSI 2011
Variazioni della struttura quaternaria e nuovi contatti tra lesubunita’ in seguito a ossigenazioneEsistono stono 6 superfici <strong>di</strong> contatto tra le 4 catene (legami H)La forma a coda <strong>di</strong> ron<strong>di</strong>ne della superficie α 1 β 2 <strong>di</strong> contatto, mette in grado le duesubunità <strong>di</strong> scivolare facilmente l’una sull’altra: si rompono alcuni legami deboli, altrise ne formano.
Transizione strutturale TR in seguito ad ossigenazioneO 2da: Nelson & Co ox
Altri legami che rendono compatta la forma TDPG abbassa l’affinità per O 2 perché crea legami ad<strong>di</strong>zionali tra le subunitàstabilizzando la struttura quaternaria della deossi<strong>emoglobina</strong> (forma T).
- il DPG si lega 1:1 con deossi Hb- Il DPG si lega nella cavità centrale <strong>di</strong>deossi Hb- residui carichi+ <strong>di</strong> entrambe le catene β<strong>di</strong> deossi Hb interagiscono con lecariche– del DPG (5 a pH fisiologico)La transizione TR si ha per:a) rottura dei legami ionici chestabilizzano lo stato T della deossi Hbb) espulsione <strong>di</strong> DPG dalla cavità <strong>di</strong> deossiHb che si restringe: <strong>di</strong>minuisce la<strong>di</strong>stanza tra le eliche H delle catene β<strong>ed</strong> aumenta la <strong>di</strong>stanza dei gruppiterminali NH 3+che non possono piùrimanere in contatto col DPG: quin<strong>di</strong>per<strong>di</strong>ta dei legami che contribuivano arendere compatta la forma T.da: Voet & Voet (II Ed.)
Harper's. Biochimica illustrata. Ed.EMSI 2011
MODELLI PER SPIEGARE L’EFFETTO COOPERATIVOMODELLO CONCERTATO O SIMMETRICO O DI MONOD, 19651. In assenza <strong>di</strong> O 2 esistono le forme T <strong>ed</strong> R in equilibrio:2. L’equilibrio è spostato verso la forma T che è la meno affine a O 23. Il legame <strong>di</strong> una molecola <strong>di</strong> O 2 a una subunità <strong>di</strong> T trasforma tutto il tetramero in R:questo significa che è possibile solo un effetto cooperativo positivoDa: Strayer L.
MODELLO SEQUENZIALE O DI KOSHLAND1. In assenza <strong>di</strong> O 2 esiste solo la forma T2. Il legame <strong>di</strong> una molecola <strong>di</strong> O 2 a una subunità <strong>di</strong> T altera laconformazione solo <strong>di</strong> quella subunità3. La subunità che ha subito un cambio conformazionale stabilisce nuovicontatti con le altre subunità che possono favorire o sfavorire il legam<strong>ed</strong>el ligando (sono possibili effetti cooperativi positivi e negativi)può farDa: Strayer L.
Spiegazione dell’effetto Cooperativo:La deossi<strong>emoglobina</strong> è una molecola l rigida id per gli otto legami salini i eperi legami conil DPG. La affinità dei suoi gruppi eme per l’ossigeno è molto bassaL’ossigenazione ha luogo soloquando alcuni <strong>di</strong> questi legami salini vengono spezzatidal legame <strong>di</strong> una prima molecola <strong>di</strong> ossigeno all’eme che permette al Fe +2 <strong>di</strong>spostarsi verso il piano dell’EME.Il movimento trascina con sè l’isti<strong>di</strong>na prossimale nonché tutta l’elica F.Questo fa sì che la subunità α cui il primo ossigeno si è legato cambi conformazionein seguito alla rottura intracatena <strong>di</strong> alcuni legami e alla formazione <strong>di</strong> nuovi.Il cambiamento conformazionale <strong>di</strong> una subunità influenza i legami intercatena chetenevano la subunità legata alle altre portando,man mano che la pression<strong>ed</strong>ell’ossigeno aumenta ,al progressivo indebolmento fino alla rottura dei legamisalini intercatena. Ciò facilita il legame delle successive <strong>molecole</strong> <strong>di</strong> ossigenoIl cambiamento della struttura quaternaria fa restringere la cavità centrale <strong>di</strong>DeoxHb che non può più alloggiare il DPG che viene espulso.Si rompono così anche questi legami ionici favorendo sempre più il prevalere dellastruttura R <strong>di</strong> Hb,più affine all’ossigeno.L’affinità <strong>di</strong> O 2 per la forma T <strong>ed</strong> R è, rispettivamente, <strong>di</strong> 1:300.