You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
h<br />
V=konst.<br />
T0<br />
ogrjevni spremnik, T1<br />
A<br />
G<br />
p=G/A=konst.<br />
MEHANIKA FLUIDA II – Što valja zapamtiti 16<br />
2<br />
1<br />
nikakav rad, pa sva dovedena toplina Q12 prelazi u<br />
unutarnju energiju termodinamičkog sustava, tj. vrijedi<br />
U 2 − U1<br />
= Q12<br />
ili u 2 − u1<br />
= q12<br />
Specifični toplinski kapacitet je toplina koju treba dovesti<br />
jedinici mase tvari da bi joj se temperatura povisila za 1<br />
K. Specifični toplinski kapacitet cv pri konstantnom<br />
⎛ dq ⎞ ⎛ du<br />
⎞<br />
volumenu se definira kao cv<br />
= ⎜ ⎟ = ⎜ ⎟<br />
⎝dT ⎠ ⎝dT ⎠ .<br />
v= konst.<br />
v<br />
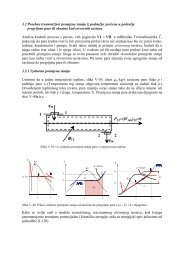
Primjer 4. Grijanje plina pri konstantnom tlaku<br />
Termodinamički sustav sadrži plin konstantne početne<br />
temperature, koji je zatvoren u cilindru s pomoću<br />
pomičnog stapa (koji idealno brtvi, a pomiče se bez<br />
trenja), čija je površina A, a težina zajedno s utegom G,<br />
tako da je konstantni tlak u plinu p=G/A (pretpostavlja<br />
se da je vanjski tlak jednak nuli). Dovođenjem topline<br />
termodinamičkom sustavu mijenja se volumen plina te<br />
dolazi do pomicanja stapa s utegom prema gore, što<br />
znači da termodinamički sustav vrši mehanički rad, koji<br />
je jednak umnošku težine G i visine h pomaka stapa.<br />
Ako se težina G izrazi s pomoću tlaka plina G=pA, tada<br />
izraz za izvršeni rad termodinamičkog sustava glasi:<br />
W =− pAh=−p V − V<br />
ogrjevni spremnik, T1 ( )<br />
12 2 1<br />
gdje su V1 i V2 volumeni plina u početnom i krajnjem<br />
ravnotežnom stanju. Prema tome ako je Q12 toplina dovedena između početnog i krajnjeg<br />
stanja, prvi zakon termodinamike poprima oblik<br />
U − U = Q − p V −V ili u − u = q − p v − v<br />
( ) ( )<br />
2 1 12 2 1 2 1 12 2 1<br />
Treba ponovo naglasiti, da će termodinamički sustav pri prijelazu iz stanja 1 u stanje 2<br />
prolaziti kroz niz ravnotežnih stanja samo ako se dovođenje topline odvija vrlo sporo. U<br />
tom se slučaju prvi zakon termodinamike može postaviti za dva vrlo bliska stanja između<br />
kojih je dovedena diferencijalno mala količina topline dq, izvršen je infinitezimalno mali<br />
rad dw=-pdv, pa je i promjena unutarnje energije du infinitezimalno mala. Time se dolazi<br />
do diferencijalnog oblika prvog zakona termodinamike, koji glasi<br />
du = dq<br />
− pdv<br />
Treba još jednom naglasiti da gornji oblici prvog zakona termodinamike vrijede samo za<br />
ravnotežne promjene stanja. Kod brzog dovođenja topline, u plinu bi se pojavio gradijent<br />
temperature, gibanje plina i gradijent tlaka, te za stap više ne bi vrijedila mehanička<br />
ravnoteža (G=pA), jer bi se on mogao gibati ubrzano, te postići konačnu brzinu. U tom<br />
slučaju ne bi vrijedio izraz za izvršeni rad pa zbog toga ni dani izraz za prvi zakon<br />
termodinamike.<br />
Entalpija<br />
Iz diferencijalne formulacije prvog zakona termodinamike du = dq<br />
− pdv<br />
, jasno je da za<br />
v=konst. sva dovedene toplina prelazi u unutarnju energiju, pa slijedi jednostavni izraz za<br />
specifični toplinski kapacitet cv. Za procese pri konstantnom tlaku zgodno je uvesti<br />
entalpiju h u obliku d h =<br />
dq<br />
+ vdp<br />
. Držeći p=konst. (dp=0) jasno je da se sva dovedena