You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
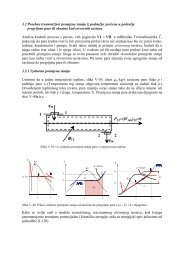
MEHANIKA FLUIDA II – Što valja zapamtiti 18<br />
⎛∂u⎞ ⎛∂u⎞ du = ⎜ ⎟ ds+<br />
⎜ ⎟ dv , odnosno<br />
⎝ ∂s ⎠v ⎝ ∂v<br />
⎠s<br />
��� ���<br />
T − p<br />
du = T ds<br />
− pdv<br />
ili dU = T dS<br />
− pdV<br />
usporedbom gornjeg izraza (Gibbsova relacija) s izrazom za prvi zakon termodinamike<br />
du = dq<br />
− pdv<br />
slijedi<br />
d q = T ds<br />
ili d Q = T dS<br />
Treba naglasiti da je gornji izraz izveden pod pretpostavkom neprekidne toplinske i<br />
mehaničke ravnoteže termodinamičkog sustava što znači da je valjan samo za ravnotežne<br />
procese.<br />
Drugi zakon termodinamike<br />
(a) Ako se stanje termodinamičkog sustava mijenja od stanja 1 do stanja 2 ravnotežnim<br />
procesom, promjena entropije definirana je integralom<br />
2<br />
2<br />
dq<br />
dQ<br />
s 2−s<br />
1 = ∫ ili S 2−S1<br />
=<br />
T<br />
∫ T<br />
1<br />
1<br />
(b) Svaki spontani proces (koji je po definiciji neravnotežan) u izoliranom zatvorenom<br />
termodinamičkom sustavu vodi povećanju entropije S. Sustav dolazi u ravnotežno<br />
stanje kada entropija S postigne svoj maksimum. Prema tome, kod neravnotežnih<br />
procesa dolazi do povećanja entropije termodinamičkog sustava i kad nema izmjene<br />
topline, te se prethodni izraz može poopćiti tako da vrijedi za bilo koji proces, tj. za<br />
promjenu entropije termodinamičkog sustava vrijedi<br />
2<br />
2<br />
dq<br />
dQ<br />
s 2−s<br />
1 ≥ ∫ ili S 2−S1<br />
≥<br />
T<br />
∫ T<br />
1<br />
1<br />
gdje se znak jednakosti odnosi na ravnotežne procese, a znak veće na neravnotežne, a<br />
samim tim na ireverzibilne procese. Temeljem prethodnog izraza može se definirati i<br />
produkcija entropije<br />
2<br />
2<br />
⎛ dq ⎞<br />
⎛ dQ<br />
⎞<br />
σ = ∫⎜ ds<br />
− ⎟ ≥ 0 ili ∑ = ⎜d<br />
⎟ ≥ 0<br />
1 ⎝ T<br />
∫ S −<br />
⎠<br />
1 ⎝ T ⎠<br />
gdje se ponovo znak jednakosti odnosi na ravnotežne procese. U izoliranom<br />
termodinamičkom sustavu produkcija entropije jednaka je promjeni entropije. Ako u<br />
izoliranom termodinamičkom sustavu nema promjene entropije proces je reverzibilan, a<br />
ako postoji porast entropije proces je ireverzibilan. Treba naglasiti da u termodinamičkom<br />
sustavu koji izmjenjuje toplinu s okolinom entropija može rasti (ako mu se toplina dovodi )<br />
ili padati (kada mu se toplina odvodi). S druge strane produkcija entropije, koja je mjera<br />
nepovratnosti termodinamičkog procesa, mora biti jednaka nuli (za ravnotežne procese) ili<br />
pozitivna veličina (za ireverzibilne procese).<br />
Termodinamički koncept i strujanje fluida<br />
Postavlja se pitanje kako gore izloženi koncept iz termodinamike koji je definiran i<br />
primjenjiv na ravnotežna stanja termodinamičkog sustava, primijeniti u strujanju fluida u<br />
kojem se tipično pojavljuju gradijenti brzine, tlaka i temperature, koje je dakle<br />
neravnotežno. Odgovor leži u principu lokalne ravnoteže u kojem se svaka čestica fluida<br />
(iz koncepta kontinuuma) smatra termodinamičkim sustavom. Budući da čestica fluida<br />
mase dm zauzima infinitezimalni volumen dV (pri čemu je dm=ρdV), sve ekstenzivne