Медицинская визуализация - Новая Медицина Тысячелетия
Медицинская визуализация - Новая Медицина Тысячелетия
Медицинская визуализация - Новая Медицина Тысячелетия
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
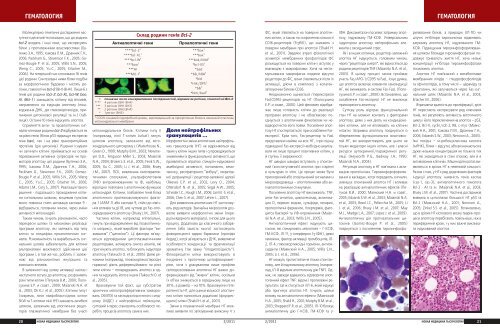
ГЕМАТОЛОГИЯГЕМАТОЛОГИЯМолекулярно-генетичні дослідження наступногодесятиліття показали, що до родиниbcl-2 входять і інші гени, що експресуютьбілки з протилежними властивостями (БутенкоЗ.А., 1995; Ісакoва Л.М., Дранник Г.H.,2006; Packham G., Stevenson F.K., 2005; Gomez-BougieP. et al., 2005; Willis S.N., 2005;Weng C., 2005; Yu.C., 2005; Erlacher M.,2006). На теперішній час клоновано 16 генівцієї родини. Синтезовані ними білки подібніза морфологічною будовою і містять регіони,гомологічні bcl-2 (ВН1-ВН4). Лише 6 згенів цієї родини (bcl-2, bcl-XL, bcl-W, boo,Al, Mcl-1) захищають клітину від впливів,направлених на індукцію апоптозу (пошкодженняДНК, дія глюкокортикоїдів, припиненняцитокінової регуляції та ін.) (таблиця).Останні 10 генів індукують апоптоз.Сприйняття анти- та проапоптичних сигналівчленами родини bcl-2 відбувається якна рівні генів (білок р53 підвищує експресіюгена bax), так і на рівні транскрипційнихпротеїнів (дія цитокінів). Рішення існуватичи загинути клітині приймається на основіпереважання активних супресорів чи промоторівапоптозу цієї родини (Бутенко З.А.,1995; Ісакoва Л.М., Дранник Г.H., 2006;Packham G., Stevenson F.K., 2005; Gomez-Bougie P. et al., 2005; Willis S.N., 2005; WengC., 2005; Yu.C., 2005; Erlacher M., 2006;Adams J.M., Cory S., 2007). Реалізація такогорішення - подальшого проходження клітинисигнальним шляхом, кінцевим пунктомякого повинна стати активація каспази 9 -відбувається, головним чином, через зміниактивності мітохондрій.Таким чином, існують різноманітні, частоперехресні шляхи та механізми реалізаціїпрограми апоптозу, які залежать від типуклітин та специфіки проапоптичних сигналів.Різноманітність та варіабельність сигнальнихшляхів забезпечують для клітиниальтернативні можливості здійснення цієїпрограми і, в той же час, роблять її залежноювід різноманітних внутрішніх тазовнішніх впливів.В залежності від шляху активації каспаз інаступного вступу до апоптозу, розрізняютьрізні типи клітин (Петухов В.И., 2000; ПолосухинаЕ.Р. и соавт., 2000; Maianski N.A. etal., 2003; Oh K.J. et al., 2005). Клітини типу I(зокрема, лінія лімфобластоїдних клітинSKW та Т-клітини лінії Н9) зазнають загибелішляхом, залежним від апоптичних рецепторівплазматичної мембрани без участіАнтиапоптичні генимітохондріальних білків. Клітини типу II(наприклад, лінії Т-клітин Jurkat) гинутьшляхом апоптозу, залежного від мітохондріальногоцитохрому с (Waterhouse N.,Green D., 1999; Mutphy B.M., 2003; NewmeyerD.D., Ferguson-Miller S., 2003; MaianskiN.A., 2004; Broker L.E. et al., 2005; Fesik S.W.,2005; Xu C., 2005; Li J. et al., 2006; BrueyJ.M., 2007). ПСК, викликана хіміотерапевтичнимисполуками, ультрафіолетовим(УФ) випромінюванням та ІВ, найбільшвірогідно пов’язана з апоптичною функцієюмітохондрій. Клітини, позбавлені генів білкаапоптичного протеазоактивуючого фактора-1(APAF-1) або каспази 9, стійкі до хімічнихвпливів та дії ІВ, але чутливі до Fas-опосередкованогоапоптозу (Bruey J.M., 2007).Частина клітин, наприклад епітеліальні,гинуть при відокремленні від позаклітинногоматриксу, який виробляє фактори “виживання”(“цитокіни”). Ці фактори зв'язуютьсявідповідними цитоплазматичнимирецепторами, активують синтез агентів, якіпригнічують апоптоз, та блокують індукториапоптозу (Takeuchi O. et al., 2005). Деякі речовини(наприклад, глюкокортикостероїднігормони) діють диференційовано на різнітипи клітин – попереджають апоптоз в однихта індукують його в інших (Takeuchi O. etal., 2005).Враховуючи той факт, що субстратомхронічних мієлопроліферативних захворювань(ХМПЗ) та мієлодиспластичного синдрому(МДС) є нейтрофільні лейкоцити,суттєвий інтерес становлять особливості перебігупроцесів апоптозу саме в них.Склад родини генів Bcl-2Проапоптичні гени****bcl-2 1 ***bax 1****bcl-XL 1 ***bax 1****bcl-W 1 ***bok/Mtd 1***boo 1 *bcl-XS 1***Al*bad***Mcl-1 1 *bik/Nbk 1*bid*Hrk/DP5 1*blk 1*bim/bad 1* позначає число консервативних послідовностей, відомих як регіони, гомологічні Bcl-2**** 4 регіони (ВН1-ВН4)*** 3 регіони (ВН1-ВН3)** 2 регіони (ВН3,ВН4)* 1 регіон (ВН3)1 COOH-кінцевий гідрофобний домен, відповідальний за прикріплення білків в зовнішній пластинцімітохондріальної мембраниДоля нейтрофільнихгранулоцитів …Морфологічні зміни апоптичних нейтрофільнихгранулоцитів (НГ) не відрізняються відтаких у клітин інших типів і супроводжуютьсязниженням їх функціональної активності, щопроявляється втратою стимулін-індукованоїамебоїдної активності, поглинання, хемотаксису,респіраторного “вибуху”, секреторноїдегрануляції і рецептор-залежної адгезії(Reeves E.P. et al., 2002; Levy O., 2004;Oltersdorf N. et al., 2005; Segal A.W., 2005;Scheider I.C., Haugh J.M., 2006; Jan M.-S. et al.,2006; Chen S. et al., 2007; Lehrer L., 2007).Для виявлення апоптичних НГ застосовуютьряд методів. Звичайна мікроскопія дозволяєвиявити морфологічні зміни (передусімядерного матеріалу), типові для цьогопроцесу. Додатково до класичного забарвлення(або замість нього) застосовуютьфлюоресцентні ядерні барвники (пропідіяйодид), котрі зв'язуються з ДНК, виявляючиособливості конденсації та фрагментаціїхроматину (так звану “гіподиплоїдність”).Флюоресцетні мітки використовують впоєднанні з проточною цитофлюорометрією,хоча з урахуванням лише профілюсвітлорозсіювання апоптичні НГ важко диференціювативід “живих” клітин, оскількиїх об’єм знижується в середньому лише на30%, а діаметр – на 10%. Враховуючи гетерогенністьНГ, для оцінки кількості апоптичнихклітин наносяться додаткові (флуоресцентні)мітки (Shakil H. et al., 2001).Зміни в плазматичній мембрані НГ можливовиявити по зв’язуванню анексину V зФС, який з’являється на поверхні апоптичнихклітин, а також по скороченню кількостіCD16-рецепторів (FcγRIII), що зникають зповерхні мембрани при апоптозі (Shakil H.et al., 2001). Завдяки втраті фізіологічноїасиметрії мембранних фосфоліпідів ФСрозміщується на поверхні клітин і вступає увзаємодію з макрофагами. Хоча на нестимульованихмакрофагах людини відсутнірецептори до ФС, вони з’являються після їхактивації, діючи в комплексі з колагензв’язуючимбілком CD36.Неоднозначно оцінюється гіперекспресіяFas(CD95)-рецепторів на НГ (ПолосухинаЕ.Р. и соавт., 2000). Цей феномен відображаєлише готовність клітин до реалізаціїпрограми апоптозу і не обов’язково поєднуєтьсяз апоптичним фенотипом чи невідворотністюйого появи. Посилення апоптозуНГ спостерігається і при ослабленні Fasекспресії.Крім того, Fas-рецептор та FasLпредставлені майже на всіх НГ, і при оцінціпідвищеної Fas-експресії необхідно аналізуватине лише процент позитивних клітин, ай ступінь її вираженості.НГ швидко швидко вступають у спонтанний(конститутивний) апоптоз при старіннів культурах in vitro. Це процес може бутиприскорений або сповільнений сигналами змікросередовища – апоптогенними або антиапоптогеннимистимулами.Посилення апоптозу НГ викликають: ТNF,анти-Fas-антитіла, циклогексімід, актиноміцинD, перекис водню, сульфіди, гепарин,протеолітичні ферменти, гіпертермія, фагоцитозбактерій та УФ-опромінення (MaianskiN.A. et al., 2003; Willis S.N., 2005).Антиапоптичний ефект індукують цитокіни,які стимулюють мієлопоез – Г-КСФ,ГМ-КСФ, ІЛ-1?, γ-інтерферон (γ-ІФН), деякіхемокіни, фактор активації тромбоцитів, ІЛ-2, ІЛ-4, глюкокортикоїдні гормони, антиоксиданти(Маянский Н.А., 2005; Willis S.N.,2005; Li J. et al., 2006).НГ можуть протистояти не тільки спонтанному,але й індукованому апоптозу (наприклад,ІЛ-8 відміняє апоптогенну дію ТNF). Однак,не завжди вдавалось відтворити апоптогеннийефект ТNF: відомі і протилежні результати.Це ж стосується і ІЛ-6, який індукуєабо пригнічує апоптоз НГ. Існують шляхивпливу на антиапоптичні ефекти (МаянскийН.А., 2005; Shakil H., 2001; Mutphy B.M. et al.,2003; Sheppard F.R. et al., 2005). ІЛ-10 блокуєантиапоптичну дію Г-КСФ, ГМ-КСФ та γ-ІФН. Дексаметазон посилює затримку апоптозу,індуковану ГМ-КСФ. Універсальниміндуктором апоптозу нейтрофільних елементівє оксидантний стрес.Як і в інших клітинах, рецептор-залежнийапоптоз НГ індукується, головним чином,через “рецептори смерті”, які відносяться дородини рецепторів ТNF (Maianski N.A. et al.,2003). В цьому процесі також приймаєучасть Fas/APO-1/CD95 та FasL. Існує думка,що апоптоз включає елементи самоіндукціїНГ, які виникають в системі Fas-FasL (ПолосухинаЕ.Р. и соавт., 2000). Встановлено, щоослаблення Fas-експресії НГ не виключаєприскореного апоптозу.Суттєву роль відіграє функціональнийстан НГ на момент контакту з факторамиапоптозу: деякі з них діють на кондиціонованіклітини, але не впливають на клітиниінтактні. Затримка апоптозу поєднується іззбереженням функціональних властивостейНГ, які використовують для цього нетільки медіатори інших клітин, але і власніресурси аутокринної/паракринної регуляції(Heyworth P.G., Badway J.A., 1990;Maianski N.A., 2004).Регуляція апоптозу в НГ пов’язана з активацієюпротеїнкіназ. Тирозинфорсфорилюванняв каскадах, котрі передають сигнали,зменшує спонтанний апоптоз НГ і впливаєна реалізацію антиапоптичних ефектів (ПетуховВ.И., 2000; Маянский Н.А. и соавт.,2005; Edvards S.W. et al., 2003; Maianski N.A.et al., 2003; Reed J.C., Pellecchia M., 2005; LiJ. et al., 2006; Bruey J.M. et al., 2007; MayM.J., Madge L.A., 2007; Lopez J. et al., 2009).Антиапоптична дія протизапальних цитокінів(Gomez-Bougie P. et al., 2005)поєднується з посиленням тирозинфосфорилюваннябілків, а природні (ІЛ-10) чиштучні інгібітори тирозинкіназ відміняютьзатримку апоптозу НГ, індукованого ГМ-КСФ. Підвищення тирозинфосфорилюванняшляхом блокади тирозинфосфатази подовжуєтривалість життя НГ, хоча низькіконцентрації інгібітора тирозинфосфатазипосилюють апоптоз.Апоптоз НГ пов’язаний з метаболітамимембранних ліпідів – гліцерофосфоліпідівта сфінголіпідів, в тому числі – цераміду тасфінгозину, які залучаються через Fas-сигнальнийшлях (Maianski N.A. et al., 2003;Erlacher M., 2006).Втрачаючи здатність до проліферації, зріліНГ перестають експресувати ряд ключовихгенів, які регулюють активність мітотичногоциклу і його переключення на апоптоз – р53,Bcl-2, Bcl-Х, cyclin/cdc-2, RB, c-myc (МаянскийН.А., 2001; Ісакoва Л.М., Дранник Г.H.,2006; Edvards S.W., 2003; Nencioni A., 2005).Їхні похідні – м-рибонуклеїнова кислота(мРНК), білки – відсутні, або визначаються вдуже низьких концентраціях не тільки в тихНГ, які знаходяться в стані спокою, але й вактивованих клітинах. Мішені для каспаз виявляєтьсяв зрілих НГ в невеликій кількості.Разом з тим, у НГ є ряд додаткових факторівіндукції апоптозу: наявність генів каспаз(cas-1, cas-3), антиапоптичного гомологаBcl-2 - А1 та ін. (Maianski N.A. et al., 2003;Bruey J.M. et al., 2007). Частина дослідниківвиявила в цитоплазмі більшості НГ р53 таBcl-2 (Маянский Н.А., 2001; Nencioni A.,2005; Zinkel S.S. et al., 2005). Встановлено,що в зрілих НГ кісткового мозку тварин процесиапоптозу перебігають повільніше, ніж впериферичній крові, і у них важче викликатиіндукований апоптоз.20НОВАЯ МЕДИЦИНА ТЫСЯЧЕЛЕТИЯ2/20112/2011 НОВАЯ МЕДИЦИНА ТЫСЯЧЕЛЕТИЯ 21