Werkstofftechnik Maschinenbau
Werkstofftechnik Maschinenbau
Werkstofftechnik Maschinenbau
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
542<br />
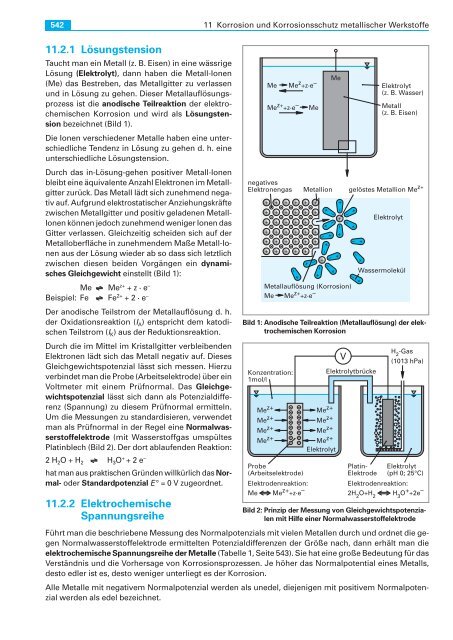
11.2.1 Lösungstension<br />
Taucht man ein Metall (z. B. Eisen) in eine wäss rige<br />
Lösung (Elekt roly t), dann haben die Metall-Ionen<br />
(Me) das Be stre ben, das Me tall gitter zu verlassen<br />
und in Lösung zu ge hen. Dieser Me tallauflösungs -<br />
prozess ist die anodi sche Teilre aktion der elektro -<br />
chemischen Korrosion und wird als Lösungsten -<br />
sion bezeichnet (Bild 1).<br />
Die Ionen verschiedener Me talle haben eine unter -<br />
schiedli che Tendenz in Lösung zu ge hen d. h. eine<br />
unterschiedliche Lösungstension.<br />
Durch das in-Lösung-gehen po si tiver Metall-Io nen<br />
bleibt eine äquivalente An zahl Elektronen im Me tall -<br />
gitter zurück. Das Me tall lädt sich zuneh mend nega -<br />
tiv auf. Aufgrund elektrostati scher An zie hungs kräfte<br />
zwischen Metallgitter und po sitiv geladenen Metall-<br />
Io nen können jedoch zu nehmend weniger Ionen das<br />
Gitter verlassen. Gleichzeitig scheiden sich auf der<br />
Metalloberflä che in zunehmen dem Maße Metall-Io -<br />
nen aus der Lösung wieder ab so dass sich letztlich<br />
zwi schen diesen beiden Vor gängen ein dy nami -<br />
sches Gleichgewicht einstellt (Bild 1):<br />
Me Me z+ + z · e –<br />
Beispiel: Fe Fe 2+ + 2 · e –<br />
Der anodische Teilstrom der Metallauflösung d. h.<br />
der Oxidationsreaktion (I A) entspricht dem katodi -<br />
schen Teilstrom (I K) aus der Reduktionsreaktion.<br />
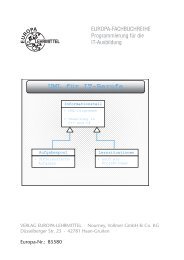
Durch die im Mittel im Kristallgitter verbleibenden<br />
Elektro nen lädt sich das Metall negativ auf. Dieses<br />
Gleichge wichtspotenzial lässt sich messen. Hierzu<br />
verbin det man die Probe (Arbeitselekt rode) über ein<br />
Volt meter mit ei nem Prüf normal. Das Gleich ge -<br />
wichts poten zial lässt sich dann als Potenzial diffe -<br />
renz (Spannung) zu diesem Prüf normal er mitteln.<br />
Um die Messungen zu standardisieren, verwendet<br />
man als Prüfnormal in der Regel eine Normalwas -<br />
ser stoff elekt rode (mit Wasserstoff gas um spültes<br />
Platin blech (Bild 2). Der dort ablaufenden Reaktion:<br />
2 H2O + H2 H3O + + 2 e –<br />
hat man aus praktischen Gründen willkürlich das Normal-<br />
oder Standard po tenzial E° = 0 V zugeordnet.<br />
11.2.2 Elektrochemische<br />
Spannungsreihe<br />
11 Korrosion und Korrosionsschutz metallischer Werkstoffe<br />
Bild 1: Anodische Teilreaktion (Metallauflösung) der elektrochemischen<br />
Korrosion<br />
Bild 2: Prinzip der Messung von Gleichgewichtspotenzialen<br />
mit Hilfe einer Normalwasserstoffelektrode<br />
Führt man die beschriebene Messung des Nor malpoten zials mit vielen Metallen durch und ordnet die ge -<br />
gen Nor malwasserstoffelektrode ermittelten Potenzialdifferenzen der Größe nach, dann erhält man die<br />
elektroche mische Spannungs reihe der Metalle (Tabelle 1, Seite 543). Sie hat eine große Be deutung für das<br />
Ver ständnis und die Vorher sage von Korrosi onsprozessen. Je höher das Normal potential ei nes Me talls,<br />
desto edler ist es, desto weniger unterliegt es der Korrosion.<br />
Alle Metalle mit negativem Normalpotenzial werden als unedel, diejenigen mit positivem Normalpotenzial<br />
werden als edel bezeichnet.