Stereochemie - Institut für Chemie und Biochemie an der FU Berlin
Stereochemie - Institut für Chemie und Biochemie an der FU Berlin
Stereochemie - Institut für Chemie und Biochemie an der FU Berlin
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
3<br />
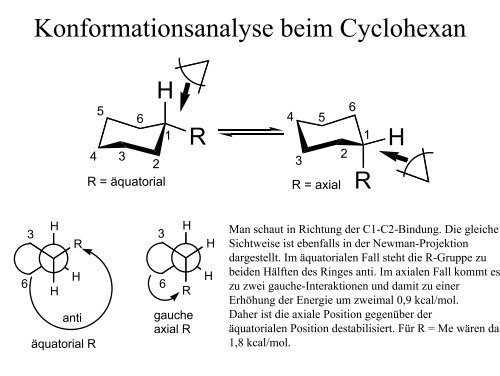
Konformations<strong>an</strong>alyse beim Cyclohex<strong>an</strong><br />
H<br />
R<br />
H<br />
6 6<br />
H<br />
<strong>an</strong>ti<br />
äquatorial R<br />
H<br />
5<br />
6<br />
1 R<br />
4 5<br />
6<br />
4 3<br />
2<br />
3<br />
2<br />
R = äquatorial R = axial<br />
3<br />
H<br />
R<br />
gauche<br />
axial R<br />
H<br />
H<br />
1<br />
R<br />
H<br />
M<strong>an</strong> schaut in Richtung <strong>der</strong> C1-C2-Bindung. Die gleiche<br />
Sichtweise ist ebenfalls in <strong>der</strong> Newm<strong>an</strong>-Projektion<br />
dargestellt. Im äquatorialen Fall steht die R-Gruppe zu<br />
beiden Hälften des Ringes <strong>an</strong>ti. Im axialen Fall kommt es<br />
zu zwei gauche-Interaktionen <strong>und</strong> damit zu einer<br />
Erhöhung <strong>der</strong> Energie um zweimal 0,9 kcal/mol.<br />
Daher ist die axiale Position gegenüber <strong>der</strong><br />
äquatorialen Position destabilisiert. Für R = Me wären das<br />
1,8 kcal/mol.