Preview Giáo án hóa học 11 cơ bản cả năm soạn theo chương trình mới (2017-2018) thực hiện GV Lữ Bảo Khánh (Four-column Form)
https://drive.google.com/file/d/1UDaVcbqRJwaFDjre1-TEQxbKV2zmmaCy/view?usp=sharing
https://drive.google.com/file/d/1UDaVcbqRJwaFDjre1-TEQxbKV2zmmaCy/view?usp=sharing
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Năm <strong>học</strong> <strong>2017</strong>-<strong>2018</strong><br />
Hóa <strong>học</strong> <strong>11</strong>CB<br />
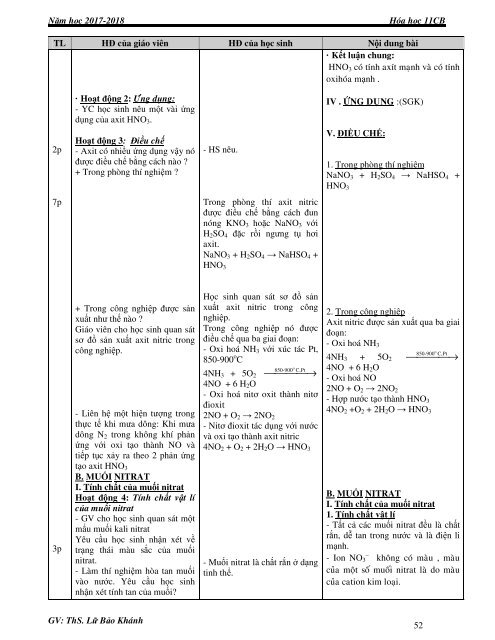
TL HĐ của giáo viên HĐ của <strong>học</strong> sinh Nội dung bài<br />
· Kết luận chung:<br />
HNO 3 coù tính axít maïnh vaø coù tính<br />
oxihoùa mạnh .<br />
· Hoạt động 2: Öùng dụng:<br />
- YC <strong>học</strong> sinh nêu một vài ứng<br />
dụng của axit HNO 3 .<br />
IV . ÖÙNG DUÏNG :(SGK)<br />
2p<br />
Hoạt động 3: Điều chế<br />
- Axit có nhiều ứng dụng vậy nó<br />
được điều chế bằng cách nào ?<br />
+ Trong phòng thí nghiệm ?<br />
- HS nêu.<br />
V. ĐIỀU CHẾ:<br />
1. Trong phòng thí nghiệm<br />
NaNO 3 + H 2 SO 4 → NaHSO 4 +<br />
HNO 3<br />
7p<br />
Trong phòng thí axit nitric<br />
được điều chế bằng cách đun<br />
nóng KNO 3 hoặc NaNO 3 với<br />
H 2 SO 4 đặc rồi ngưng tụ hơi<br />
axit.<br />
NaNO 3 + H 2 SO 4 → NaHSO 4 +<br />
HNO 3<br />
3p<br />
+ Trong công nghiệp được sản<br />
xuất như thế nào ?<br />
<strong>Giáo</strong> viên cho <strong>học</strong> sinh quan sát<br />
sơ đồ sản xuất axit nitric trong<br />
công nghiệp.<br />
- Liên hệ một <strong>hiện</strong> tượng trong<br />
<strong>thực</strong> tế khi mưa dông: Khi mưa<br />
dông N 2 trong không khí phản<br />
ứng với oxi tạo thành NO và<br />
tiếp tục xảy ra <strong>theo</strong> 2 phản ứng<br />
tạo axit HNO 3<br />
B. MUỐI NITRAT<br />
I. Tính chất của muối nitrat<br />
Hoạt động 4: Tính chất vật lí<br />
của muối nitrat<br />
- <strong>GV</strong> cho <strong>học</strong> sinh quan sát một<br />
mẩu muối kali nitrat<br />
Yêu cầu <strong>học</strong> sinh nhận xét về<br />
trạng thái màu sắc của muối<br />
nitrat.<br />
- Làm thí nghiệm hòa tan muối<br />
vào nước. Yêu cầu <strong>học</strong> sinh<br />
nhận xét tính tan của muối?<br />
Học sinh quan sát sơ đồ sản<br />
xuất axit nitric trong công<br />
nghiệp.<br />
Trong công nghiệp nó được<br />
điều chế qua ba giai đoạn:<br />
- Oxi hoá NH 3 với xúc tác Pt,<br />
850-900 o C<br />
o<br />
850-900<br />
4NH 3 + 5O 2 ⎯⎯⎯<br />
C,Pt<br />
⎯→<br />
4NO + 6 H 2 O<br />
- Oxi hoá nitơ oxit thành nitơ<br />
đioxit<br />
2NO + O 2 → 2NO 2<br />
- Nitơ đioxit tác dụng với nước<br />
và oxi tạo thành axit nitric<br />
4NO 2 + O 2 + 2H 2 O → HNO 3<br />
- Muối nitrat là chất rắn ở dạng<br />
tinh thể.<br />
2. Trong công nghiệp<br />
Axit nitric được sản xuất qua ba giai<br />
đoạn:<br />
- Oxi hoá NH 3<br />
o<br />
850-900<br />
4NH 3 + 5O 2 ⎯⎯⎯<br />
C,Pt<br />
⎯→<br />
4NO + 6 H 2 O<br />
- Oxi hoá NO<br />
2NO + O 2 → 2NO 2<br />
- Hợp nước tạo thành HNO 3<br />
4NO 2 +O 2 + 2H 2 O → HNO 3<br />
B. MUỐI NITRAT<br />
I. Tính chất của muối nitrat<br />
1. Tính chất vật lí<br />
- Tất <strong>cả</strong> các muối nitrat đều là chất<br />
rắn, dễ tan trong nước và là điện li<br />
mạnh.<br />
–<br />
- Ion NO 3 khoâng coù maøu , maøu<br />
cuûa moät soá muoái nitrat laø do maøu<br />
cuûa cation kim loaïi.<br />
<strong>GV</strong>: ThS. <strong>Lữ</strong> <strong>Bảo</strong> Kh<strong>án</strong>h<br />
52