Rôle de la protéine associée au nucléoïde Fis dans le contrôle de la ...
Rôle de la protéine associée au nucléoïde Fis dans le contrôle de la ...
Rôle de la protéine associée au nucléoïde Fis dans le contrôle de la ...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Introduction bibliographique<br />
30%), alors que PelB et PelC sont quasiment inactives (Tardy et al., 1997). Au début <strong>de</strong><br />
l’infection, <strong>le</strong> milieu intercellu<strong>la</strong>ire végétal colonisé par Erwinia présente un pH légèrement<br />
aci<strong>de</strong> (entre 5,0 et 6,5 selon <strong>le</strong> végétal), ce qui suggère que <strong>le</strong>s enzymes PelA, PelD et PelE<br />
sont probab<strong>le</strong>ment <strong>le</strong>s plus actives lors <strong>de</strong> cette étape.<br />
L’activité <strong>de</strong>s endo-pectate lyases dépend éga<strong>le</strong>ment <strong>de</strong> <strong>la</strong> présence d'un cofacteur<br />
ionique diva<strong>le</strong>nt, <strong>le</strong> calcium (Lojkowska et al., 1995; Shevchik et Hugouvieux-Cotte-Pattat,<br />
1997; Tardy et al., 1997). El<strong>le</strong>s peuvent être séparées en <strong>de</strong>ux groupes : PelA, PelD et PelE<br />
agissent préférentiel<strong>le</strong>ment sur <strong>la</strong> pectine non méthylée, <strong>le</strong>s <strong>au</strong>tres pectate lyases ont une<br />
activité optima<strong>le</strong> sur <strong>la</strong> pectine partiel<strong>le</strong>ment méthylée (Tardy et al., 1997). L’activité in vitro<br />
<strong>de</strong>s Pels varie selon <strong>la</strong> longueur <strong>de</strong> <strong>la</strong> chaîne du substrat. Ainsi, PelD a une activité optima<strong>le</strong><br />
sur <strong>de</strong>s tétramères, PelB sur <strong>de</strong>s hexamères et PelA, PelI et PelL sont plus actives sur <strong>de</strong>s<br />
heptamères et octamères (Roy et al., 1999). Cette diversité <strong>de</strong>s pectate lyases permet à<br />
E. chrysanthemi <strong>de</strong> dégra<strong>de</strong>r <strong>de</strong>s pectines variées et d’infecter un <strong>la</strong>rge spectre d’hôtes. Des<br />
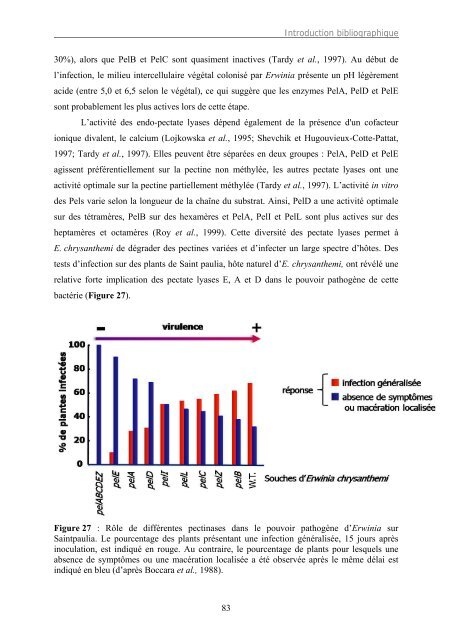
tests d’infection sur <strong>de</strong>s p<strong>la</strong>nts <strong>de</strong> Saint p<strong>au</strong>lia, hôte naturel d’E. chrysanthemi, ont révélé une<br />
re<strong>la</strong>tive forte implication <strong>de</strong>s pectate lyases E, A et D <strong>dans</strong> <strong>le</strong> pouvoir pathogène <strong>de</strong> cette<br />
bactérie (Figure 27).<br />
Figure 27 : <strong>Rô<strong>le</strong></strong> <strong>de</strong> différentes pectinases <strong>dans</strong> <strong>le</strong> pouvoir pathogène d’Erwinia sur<br />
Saintp<strong>au</strong>lia. Le pourcentage <strong>de</strong>s p<strong>la</strong>nts présentant une infection généralisée, 15 jours après<br />
inocu<strong>la</strong>tion, est indiqué en rouge. Au contraire, <strong>le</strong> pourcentage <strong>de</strong> p<strong>la</strong>nts pour <strong>le</strong>squels une<br />
absence <strong>de</strong> symptômes ou une macération localisée a été observée après <strong>le</strong> même dé<strong>la</strong>i est<br />
indiqué en b<strong>le</strong>u (d’après Boccara et al., 1988).<br />
83