Scan 6, december 2003 - UMC Utrecht
Scan 6, december 2003 - UMC Utrecht
Scan 6, december 2003 - UMC Utrecht
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
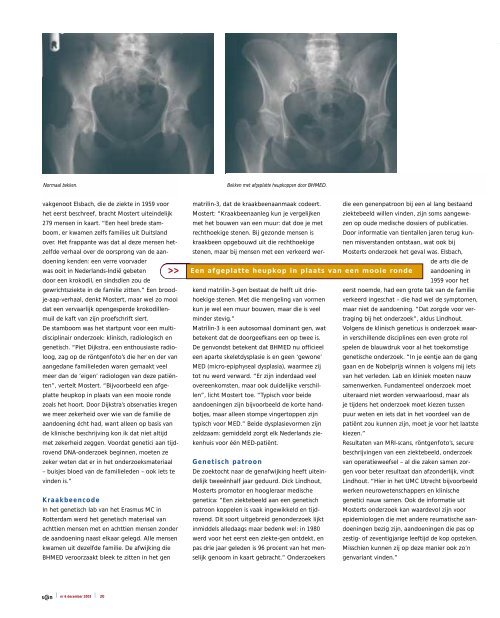
Normaal bekken.<br />
Bekken met afgeplatte heupkoppen door BHMED.<br />
vakgenoot Elsbach, die de ziekte in 1959 voor<br />
het eerst beschreef, bracht Mostert uiteindelijk<br />
279 mensen in kaart. “Een heel brede stamboom,<br />
er kwamen zelfs families uit Duitsland<br />
over. Het frappante was dat al deze mensen hetzelfde<br />
verhaal over de oorsprong van de aandoening<br />
kenden: een verre voorvader<br />
matrilin-3, dat de kraakbeenaanmaak codeert.<br />
Mostert: “Kraakbeenaanleg kun je vergelijken<br />
met het bouwen van een muur: dat doe je met<br />
rechthoekige stenen. Bij gezonde mensen is<br />
kraakbeen opgebouwd uit die rechthoekige<br />
stenen, maar bij mensen met een verkeerd werkend<br />
die een genenpatroon bij een al lang bestaand<br />
ziektebeeld willen vinden, zijn soms aangewezen<br />
op oude medische dossiers of publicaties.<br />
Door informatie van tientallen jaren terug kunnen<br />
misverstanden ontstaan, wat ook bij<br />
Mosterts onderzoek het geval was. Elsbach,<br />
de arts die de<br />
was ooit in Nederlands-Indië gebeten<br />
door een krokodil, en sindsdien zou de<br />
>> Een afgeplatte heupkop in plaats van een mooie ronde aandoening in<br />
1959 voor het<br />
gewrichtsziekte in de familie zitten.” Een broodje-aap-verhaal,<br />
denkt Mostert, maar wel zo mooi<br />
dat een vervaarlijk opengesperde krokodillenmuil<br />
de kaft van zijn proefschrift siert.<br />
De stamboom was het startpunt voor een multidisciplinair<br />
onderzoek: klinisch, radiologisch en<br />
genetisch. “Piet Dijkstra, een enthousiaste radioloog,<br />
zag op de röntgenfoto’s die her en der van<br />
aangedane familieleden waren gemaakt veel<br />
meer dan de ‘eigen’ radiologen van deze patiënten”,<br />
vertelt Mostert. “Bijvoorbeeld een afgeplatte<br />
heupkop in plaats van een mooie ronde<br />
zoals het hoort. Door Dijkstra’s observaties kregen<br />
we meer zekerheid over wie van de familie de<br />
aandoening écht had, want alleen op basis van<br />
de klinische beschrijving kon ik dat niet altijd<br />
met zekerheid zeggen. Voordat genetici aan tijdrovend<br />
DNA-onderzoek beginnen, moeten ze<br />
zeker weten dat er in het onderzoeksmateriaal<br />
– buisjes bloed van de familieleden – ook iets te<br />
vinden is.”<br />
Kraakbeencode<br />
In het genetisch lab van het Erasmus MC in<br />
Rotterdam werd het genetisch materiaal van<br />
achttien mensen met en achttien mensen zonder<br />
de aandoening naast elkaar gelegd. Alle mensen<br />
kwamen uit dezelfde familie. De afwijking die<br />
BHMED veroorzaakt bleek te zitten in het gen<br />
matrilin-3-gen bestaat de helft uit drie-<br />
hoekige stenen. Met die mengeling van vormen<br />
kun je wel een muur bouwen, maar die is veel<br />
minder stevig.”<br />
Matrilin-3 is een autosomaal dominant gen, wat<br />
betekent dat de doorgeefkans een op twee is.<br />
De genvondst betekent dat BHMED nu officieel<br />
een aparte skeletdysplasie is en geen ‘gewone’<br />
MED (micro-epiphyseal dysplasia), waarmee zij<br />
tot nu werd verward. “Er zijn inderdaad veel<br />
overeenkomsten, maar ook duidelijke verschillen”,<br />
licht Mostert toe. “Typisch voor beide<br />
aandoeningen zijn bijvoorbeeld de korte handbotjes,<br />
maar alleen stompe vingertoppen zijn<br />
typisch voor MED.” Beide dysplasievormen zijn<br />
zeldzaam: gemiddeld zorgt elk Nederlands ziekenhuis<br />
voor één MED-patiënt.<br />
Genetisch patroon<br />
De zoektocht naar de genafwijking heeft uiteindelijk<br />
tweeënhalf jaar geduurd. Dick Lindhout,<br />
Mosterts promotor en hoogleraar medische<br />
genetica: “Een ziektebeeld aan een genetisch<br />
patroon koppelen is vaak ingewikkeld en tijdrovend.<br />
Dit soort uitgebreid genonderzoek lijkt<br />
inmiddels alledaags maar bedenk wel: in 1980<br />
werd voor het eerst een ziekte-gen ontdekt, en<br />
pas drie jaar geleden is 96 procent van het menselijk<br />
genoom in kaart gebracht.” Onderzoekers<br />
eerst noemde, had een grote tak van de familie<br />
verkeerd ingeschat – die had wel de symptomen,<br />
maar niet de aandoening. “Dat zorgde voor vertraging<br />
bij het onderzoek”, aldus Lindhout.<br />
Volgens de klinisch geneticus is onderzoek waarin<br />
verschillende disciplines een even grote rol<br />
spelen de blauwdruk voor al het toekomstige<br />
genetische onderzoek. “In je eentje aan de gang<br />
gaan en de Nobelprijs winnen is volgens mij iets<br />
van het verleden. Lab en kliniek moeten nauw<br />
samenwerken. Fundamenteel onderzoek moet<br />
uiteraard niet worden verwaarloosd, maar als<br />
je tijdens het onderzoek moet kiezen tussen<br />
puur weten en iets dat in het voordeel van de<br />
patiënt zou kunnen zijn, moet je voor het laatste<br />
kiezen.”<br />
Resultaten van MRI-scans, röntgenfoto’s, secure<br />
beschrijvingen van een ziektebeeld, onderzoek<br />
van operatieweefsel – al die zaken samen zorgen<br />
voor beter resultaat dan afzonderlijk, vindt<br />
Lindhout. “Hier in het <strong>UMC</strong> <strong>Utrecht</strong> bijvoorbeeld<br />
werken neurowetenschappers en klinische<br />
genetici nauw samen. Ook de informatie uit<br />
Mosterts onderzoek kan waardevol zijn voor<br />
epidemiologen die met andere reumatische aandoeningen<br />
bezig zijn, aandoeningen die pas op<br />
zestig- of zeventigjarige leeftijd de kop opsteken.<br />
Misschien kunnen zij op deze manier ook zo’n<br />
genvariant vinden.”<br />
l nr 6 <strong>december</strong> <strong>2003</strong> l 20