Bibliothek.pdf
Bibliothek.pdf
Bibliothek.pdf
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
ERGEBNISSE<br />
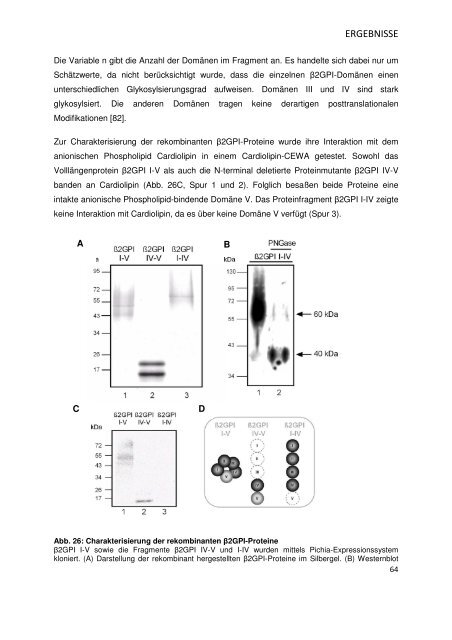
Die Variable n gibt die Anzahl der Domänen im Fragment an. Es handelte sich dabei nur um<br />
Schätzwerte, da nicht berücksichtigt wurde, dass die einzelnen β2GPI-Domänen einen<br />
unterschiedlichen Glykosylsierungsgrad aufweisen. Domänen III und IV sind stark<br />
glykosylsiert. Die anderen Domänen tragen keine derartigen posttranslationalen<br />
Modifikationen [82].<br />
Zur Charakterisierung der rekombinanten β2GPI-Proteine wurde ihre Interaktion mit dem<br />
anionischen Phospholipid Cardiolipin in einem Cardiolipin-CEWA getestet. Sowohl das<br />
Volllängenprotein β2GPI I-V als auch die N-terminal deletierte Proteinmutante β2GPI IV-V<br />
banden an Cardiolipin (Abb. 26C, Spur 1 und 2). Folglich besaßen beide Proteine eine<br />
intakte anionische Phospholipid-bindende Domäne V. Das Proteinfragment β2GPI I-IV zeigte<br />
keine Interaktion mit Cardiolipin, da es über keine Domäne V verfügt (Spur 3).<br />
A<br />
B<br />
C<br />
D<br />
Abb. 26: Charakterisierung der rekombinanten β2GPI-Proteine<br />
β2GPI I-V sowie die Fragmente β2GPI IV-V und I-IV wurden mittels Pichia-Expressionssystem<br />
kloniert. (A) Darstellung der rekombinant hergestellten β2GPI-Proteine im Silbergel. (B) Westernblot<br />
64