Bibliothek.pdf
Bibliothek.pdf
Bibliothek.pdf
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
ERGEBNISSE<br />
Das Fragment β2GPI I-IV hemmte den alternativen Komplementweg. Mittels Zymosanversuch wurde<br />
humanes Plasma mit Zymosan und β2GPI I-V beziehungsweise den Proteinfragmenten β2GPI IV-V<br />
und β2GPI I-IV sowie dem Komplementregulator Faktor H inkubiert und mittels SDS-PAGE und<br />
Westernblot auf die Generierung von C3a untersucht (Kaninchen-anti-C3a-Antikörper).<br />
3.9.3 Interaktion von β2GPI I-IV mit C3b<br />
Das Spaltprodukt C3b spielt sowohl als Teil der C3-Konvertase eine zentrale Rolle bei der<br />
Komplementaktivierung als auch bei der Markierung von Fremdoberflächen. Um zu<br />
überprüfen, ob β2GPI Einfluss auf die Funktion von C3b hat, wurde zunächst mittels ELISA<br />
die Interaktion von β2GPI mit C3b untersucht. Das C-terminal deletierte Fragment β2GPI I-IV<br />
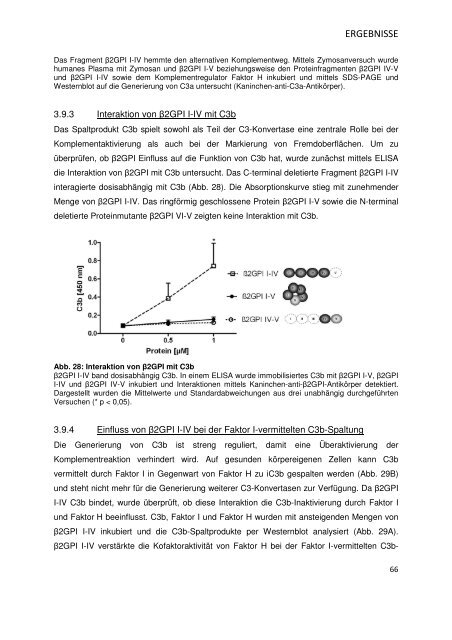
interagierte dosisabhängig mit C3b (Abb. 28). Die Absorptionskurve stieg mit zunehmender<br />
Menge von β2GPI I-IV. Das ringförmig geschlossene Protein β2GPI I-V sowie die N-terminal<br />
deletierte Proteinmutante β2GPI VI-V zeigten keine Interaktion mit C3b.<br />
Abb. 28: Interaktion von β2GPI mit C3b<br />
β2GPI I-IV band dosisabhängig C3b. In einem ELISA wurde immobilisiertes C3b mit β2GPI I-V, β2GPI<br />
I-IV und β2GPI IV-V inkubiert und Interaktionen mittels Kaninchen-anti-β2GPI-Antikörper detektiert.<br />
Dargestellt wurden die Mittelwerte und Standardabweichungen aus drei unabhängig durchgeführten<br />
Versuchen (* p < 0,05).<br />
3.9.4 Einfluss von β2GPI I-IV bei der Faktor I-vermittelten C3b-Spaltung<br />
Die Generierung von C3b ist streng reguliert, damit eine Überaktivierung der<br />
Komplementreaktion verhindert wird. Auf gesunden körpereigenen Zellen kann C3b<br />
vermittelt durch Faktor I in Gegenwart von Faktor H zu iC3b gespalten werden (Abb. 29B)<br />
und steht nicht mehr für die Generierung weiterer C3-Konvertasen zur Verfügung. Da β2GPI<br />
I-IV C3b bindet, wurde überprüft, ob diese Interaktion die C3b-Inaktivierung durch Faktor I<br />
und Faktor H beeinflusst. C3b, Faktor I und Faktor H wurden mit ansteigenden Mengen von<br />
β2GPI I-IV inkubiert und die C3b-Spaltprodukte per Westernblot analysiert (Abb. 29A).<br />
β2GPI I-IV verstärkte die Kofaktoraktivität von Faktor H bei der Faktor I-vermittelten C3b-<br />
66